沙利度胺对A549细胞体外增殖的影响及其作用机制
徐小峰,徐 玲,陈文萍,夏春伟
(南京市胸科医院 呼吸科,江苏 南京,210029)
肺癌是严重威胁人类健康的恶性肿瘤之一,发病率及死亡率在我国均呈上升趋势,预计到 2025年,我国肺癌患者将达到 100万,成为世界第一肺癌大国[1]。非小细胞肺癌(Non small-cell lung cancer,NSCLC)约占全部肺癌的85%,多数患者在确诊时已出现转移,失去了根治性手术的机会。研究发现,肿瘤的生长和转移依赖血管和淋巴管的生成,血管内皮生长因子(VEGF)是刺激恶性肿瘤血管形成的重要生长因子;血管内皮生成因子 C(VEGF-C)可以通过选择性的淋巴管生成,促进淋巴结转移播散[2]。近年来体内外实验发现,沙利度胺(反应停,Thalidomide)具有免疫调节和抗血管生成作用,目前临床已用于治疗浆细胞肿瘤,对某些实体瘤如肾癌、前列腺癌等也有一定疗效,但其作用机制尚无定论。本研究旨在观察沙利度胺对NSCLC细胞株 A549体外增殖及VEGF和VEGF-C表达的影响,探讨沙利度胺抗肿瘤作用的可能机制及其用于治疗 NSCLC的可行性。
1 材 料
沙利度胺,Sigma公司;Trizol液及MMLV逆转录酶,日本 TOYOBA公司;PCR MasterMix试剂盒,美国 Promega公司;鼠抗人 VEGF和VEGF-C多克隆抗体,晶美生物公司;BCIP/NBT显色试剂盒、RAPA蛋白裂解液、BCA蛋白浓度测定试剂盒,碧云天生物技术研究所。引物由上海生工生物技术服务有限公司合成。
A549细胞由中国医学科学院肿瘤所分子生物学检测中心提供。
MCO-15AC CO2恒温培养箱,日本 SANYO;酶标仪、DY-III8型电泳仪,北京六一仪器厂;PE-9600 PCR基因扩增仪,美国 PE公司;凝胶成像系统,英国 UVB公司。
2 方 法
2.1 细胞培养及实验分组
A549细胞贴壁生长于含10%胎牛血清,100 u/L青霉素、100μg/mL链霉素的DMEM培养基中,37℃、5%CO2培养箱培养,倒置显微镜下观察细胞形态良好无退化,每3~4 d传代一次,隔日换液,取对数生长期细胞进行实验。实验分为对照组和沙利度胺 5,10,20,40,60mg/L剂量组。沙利度胺以无菌的二甲亚砜(DMSO)溶解并配制成20mg/mL的贮存液,临用时用DMEM培养基稀释至所需浓度。
2.2 MTT法检测细胞增殖抑制率
将对数生长期的A549细胞重悬于含10%胎牛血清的DMEM培养液,接种于96孔板,细胞密度为1×104/mL,过夜。次日取出培养板,加入不同浓度沙利度胺 20μL,每孔总体积为200μL,每个浓度设置4个复孔,并设置含0.5%DMSO的DMEM培养液替代实验用药物作为空白对照,继续培养24,48和72 h,取出培养板,每孔加入5mg/mL MTT溶液20μL,置37℃,4 h,取出培养板,弃去培养液,每孔加入DMSO 150μL,充分震荡混匀 10 min后,置酶标仪测定570 nm波长处吸光度(A)值。实验重复 3次,取平均值。细胞增殖抑制率(%)=(1-A实验/A空白对照)×100%。
2.3 RT-PCR半定量检测相关基因 mRNA表达水平
Trizol一步法提取细胞总RNA。逆转录体系为20μL:细胞总RNA3μL(2.5~3 μg),10 U/μL RNAsin 1μL,5×逆转录反应缓冲液4μL,10μmol/LdNTP 2μL,25 pmol/μL随机引物1μL,MMLV逆转录酶 100 U,25 mmol/LmgCl20.5μL。30℃反应10 min,42℃反应20 min,99℃ 5 min终止反应。所用VEGF和VEGF-C及内参照GAPDH引物均由上海生工公司合成。VEGF引物(扩增产物583bp):上游为5′-CGAAACCATGAACTTTCTGCTGTC-3,下游为5′-TCACCGCCTCGGCTTGTCACAT-3′。VEGFC引物 (扩增产物 462 bp):上游为5-GGCCCCAAACCAGTAACAATC-3′;下游为5′-GGGGCAGGTTCTTTTACATACAC-3′。GAPDH引物(扩增产物 306 bp):上游为5′-CGGAGTCAACGGATTGGTCGTAT-3′;下游为5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。PCR体系为:逆转录产物2μL(0.1~2μg),10 pmol/μL上、下游引物各2.5μL,PCR Master Mix 12.5μL,其余以无核酶水补足至25μL。扩增条件:95℃ 30 s,56℃30 s,72℃45 s,共35个循环,最后72℃延伸5min。扩增产物经1.5%琼脂糖凝胶电泳(80V,35min)后,紫外透射仪下观察并照相,在凝胶上进行扫描定量,以目的基因与内参照的荧光比值代表 mRNA的表达水平。
2.4 Western-blot方法检测 VEGF和VEGF-C蛋白水平的表达
用RAPA裂解液裂解各组细胞提取总蛋白,采用BCA法测定各组总蛋白浓度,制备 10%SDSPAGE,每泳道加总蛋白100μg,进行电泳,经湿转印到 PVDF膜上(美国 Amresco公司),5%BSATBST常温下封闭1h,分别加入鼠抗人 VEGF和VEGF-C及GAPDH多克隆抗体(1∶50稀释),4℃孵育过夜,然后加入HRP标记的兔抗鼠 IgG(1∶1 000稀释),37℃孵育 1 h,TBST洗涤,BCIP/NBT显色试剂盒显影,拍照保存,Gel-Pro Analyzer分析软件计算 VEGF和VEGF-C相对含量,即 TGF-β/GAPDH和PCNA/GAPDH灰度比值。每组重复 3次。
2.5 统计学分析
3 结 果
3.1 不同质量浓度的沙利度胺对A549细胞增殖抑制的影响
各组细胞的的增殖抑制率见表1,不同质量浓度的沙利度胺作用于A549细胞24 h后,细胞呈不同程度的增殖抑制,组间两两比较分析结果显示,随着沙利度胺质量浓度的增高,A549细胞的增殖抑制率增高,差异均具有统计学意义(P<0.05),沙利度胺对A549细胞的增殖抑制呈浓度依赖性。
3.2 沙利度胺对A549细胞VEGF和VEGF-C mRNA和蛋白水平表达的影响
表1 不同质量浓度的沙利度胺作用于A 549细胞的增殖抑制率比较(n=3,±s)Tab.1 The growth inhibiting of A 549 cells after interfered by mass concentration of thalidomide(n=3,±s)

表1 不同质量浓度的沙利度胺作用于A 549细胞的增殖抑制率比较(n=3,±s)Tab.1 The growth inhibiting of A 549 cells after interfered by mass concentration of thalidomide(n=3,±s)
组间两两比较:1 P<0.05Interclass paired comparison:1P<0.05
组别 剂量/(mg/L) A值 抑制率/%对照组 - 0.742±0.054 -沙利度胺组 5 0.650±0.032 12.40±1.06 10 0.571±0.053 23.05±0.761 20 0.507±0.047 31.66±0.911 40 0.482±0.033 36.42±0.661 60 0.453±0.036 38.94±1.191
RT-PCR和Western-blot结果显示,各组均可检测到 VEGF和VEGF-C mRNA和蛋白水平的表达。不同质量浓度的沙利度胺作用于A549细胞24 h后,VEGF和VEGF-CmRNA和蛋白水平的表达呈不同程度的下降趋势(见表2),与对照组相比,差异均有统计学意义(P<0.05)。组间两两比较分析结果显示,随着沙利度胺质量浓度的增高,A549细胞的VEGF和VEGF-CmRNA和蛋白水平的表达下降,沙利度胺对A549细胞VEGF和VEGF-C mRNA和蛋白水平的表达抑制作用呈浓度依赖性(P<0.05)。
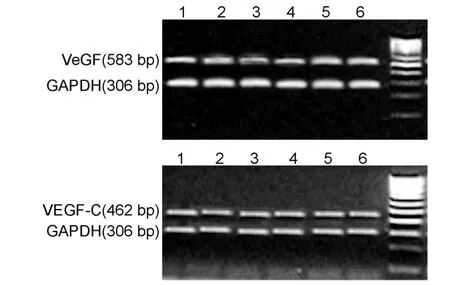
图1 各组A549细胞VEGF和VEGF-C mRNA表达水平Fig.1 The mRNA expression level of VEGF and VEGF-C in A549 cells
表2 各组A549细胞VEGF和VEGF-C mRNA和蛋白水平的表达情况(n=3,±s)Tab.2 The mRNA and protein level expressions of VEGF and VEGF-Cin every group(n=3,±s)
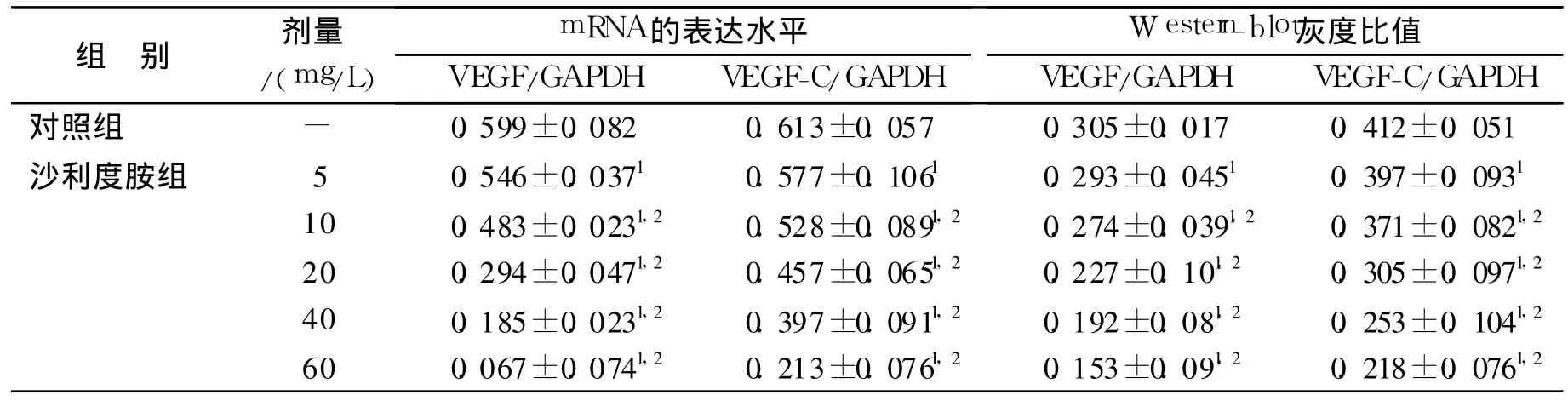
表2 各组A549细胞VEGF和VEGF-C mRNA和蛋白水平的表达情况(n=3,±s)Tab.2 The mRNA and protein level expressions of VEGF and VEGF-Cin every group(n=3,±s)
与对照组比较:1P<0.05;组间两两比较:2 P<0.05Compared with control group:1 P<0.05;Interclass paired comparison:2P<0.05
组别 剂量/(mg/L)mRNA的表达水平VEGF/GAPDH VEGF-C/GAPDH Western-blot灰度比值VEGF/GAPDH VEGF-C/GAPDH对照组 - 0.599±0.082 0.613±0.057 0.305±0.017 0.412±0.051沙利度胺组 5 0.546±0.0371 0.577±0.1061 0.293±0.0451 0.397±0.0931 10 0.483±0.0231,2 0.528±0.0891,2 0.274±0.0391,2 0.371±0.0821,2 20 0.294±0.0471,2 0.457±0.0651,2 0.227±0.101,2 0.305±0.0971,2 40 0.185±0.0231,2 0.397±0.0911,2 0.192±0.081,2 0.253±0.1041,2 60 0.067±0.0741,2 0.213±0.0761,2 0.153±0.091,2 0.218±0.0761,2
4 讨 论
沙利度胺是一种谷氨酸衍生物,最初用于治疗早孕反应和镇静催眠,后因其严重的致畸作用而被禁用[3]。20世纪 90年代,有学者发现沙利度胺具有抑制血管生成作用而应用于浆细胞肿瘤的治疗,目前也应用于某些实体瘤,如肾癌、前列腺癌等。本研究发现,沙利度胺体外能抑制人 NSCLC细胞株A549细胞的增殖,并随着沙利度胺质量浓度的增加,细胞增殖抑制作用增强,呈浓度依赖性。刘如等[4]的研究也证实沙利度胺能够抑制人鼻咽癌细胞株 CNE-2细胞增殖,呈浓度依赖性。
肿瘤血管生成受多种因子的调控,如血管生成因子,细胞因子及其抑制因子等。VEGF家族由VEGF-A(或 VEGF)、B、C、D、E和胎盘生长因子(Placenta growth factor,PIGF)等组成,这些因子均与血管生成有关。其中VEGF可能是最强的促血管生成因子,对血管内皮细胞的增殖、水解基膜、迁移和血管构建的调控作用较强,还可诱导肿瘤淋巴管形成,是淋巴管转移的原因之一[5]。沙利度胺可以抑制肝细胞性肝癌细胞VEGF的表达[6]。VEGF-C也具有诱导新生血管生成的作用,而且在淋巴管系统发育中起重要调节作用[7]。沙利度胺可特异性抑制VEGF-C,能阻断肿瘤的血管生成和淋巴管生成,削弱肿瘤的淋巴管转移[8]。本研究结果表明,经不同质量浓度的沙利度胺作用24 h,VEGF和VEGF-C mRNA和蛋白水平的表达均不同程度的下降,呈浓度依赖性模式,即随着沙利度胺质量浓度的增加,VEGF和VEGF-C mRNA和蛋白水平的表达下降。沙利度胺可能通过下调 A549细胞中 VEGF和VEGF-C的表达,从而抑制肿瘤血管和淋巴管的生成,最终达到抗肿瘤的作用。
综上所述,沙利度胺体外对NSCLC细胞株A549具有生长抑制作用,其作用机制可能通过下调A549细胞中 VEGF和VEGF-C的表达,从而抑制肿瘤血管和淋巴管的生成,最终达到抑制肿瘤生长及转移的作用。本研究为临床应用沙利度胺治疗肺癌提供了一定的理论依据,以VEGF和VEGF-C及其受体为靶点的治疗,可能成为NSCLC潜在的治疗策略。
[1]邹小农.中国肺癌流行病学[J].中国肿瘤防治杂志,2007,14(12):881.
[2]丁旭青,杨鲲鹏,王旭广,等.COX-2和VEGF-C表达与NSCLC淋巴转移的关系[J].河南外科学杂志,2007,13(3):1-2.
[3]李琳,郑捷.沙利度胺药理作用及临床应用[J].中国临床药学杂志,2008,17(2):123-126.
[4]刘如,王涛,戈伟,等.沙利度胺对人鼻咽癌细胞株血管内皮生长因子表达影响的观察[J].中华肿瘤防治杂志,2008,15(22):1706-1709.
[5]Kato Y,Asano K,Mogi T,et a1.Clincical significance of circulating vascular endothelial growth factor in dogs with mammary gland tumors[J].Vet Med Sci,2007,69(1):77-80.
[6]Pinter M,Wichlas M,Schmid K,etal.Thalidomide in advanced hepatocellular carcinoma as antiangiogenic treatment approach:a phase I/II trial[J].Eur J Gastroenterol Hepatol,2008,20:1012-1019.
[7]Kaushal V,Mukunyadzi P,Dennis R A,et a1.Stage-specific characterization of the vascular endothelial growth factor axis in prostate cancer:expression of lymphangiogenic markers is associated with advanced-stage disease[J].Clin Cancer Res,2005,11(2):584-593.
[8]Krishnan J,Kirkin V,Stefen A,et a1.Diferential in vivo and in vitro expression of vascular endothelial growth factor VEGF-C and VEGF-D in tumors and its relationship to lymphatic metastasis in immunocompetent rats[J].Cancer Res,2003,63(3):713-722.

