氧化苦参碱对内毒素作用下人牙周膜细胞增殖、细胞周期和超微结构的影响
陈 凌,吴 赟,骆 凯,闫福华
(福建医科大学 1.附属第一医院 口腔科,2.附属口腔医院 牙周科,福建 福州 350004)
牙周膜细胞(periodontal ligament cell,PDLC)是牙周组织再生修复的细胞基础,细菌内毒素(LPS,脂多糖)对PDLC有明显的细胞毒作用,因此阻断LPS对PDLC的破坏对于维护牙周组织健康有着重要意义[1-3]。
氧化苦参碱(oxymatrine,OMT)是苦豆子、苦参、广豆根等豆科槐属植物中生物碱的主要成份。近年来对OMT的研究发现对多种急性渗出性炎症具有明显的拮抗作用,本研究通过细胞学研究探讨 OMT对LPS作用下的人 PDLC增殖、细胞周期和超微结构改变的影响,为OMT应用于牙周病防治提供参考。
1 材料和方法
1.1 试剂和仪器
OMT(陕西惠科生物工程公司);DMEM培养液、胰蛋白酶、新生牛血清(FBS)(GIBCO,美国);牙龈卟啉菌 LPS(晶美生物工程公司);MTT(Sigma公司)。
CO2孵箱(Heraeus,德国);Humareader酶标仪(Human,德国);流式细胞仪(Coulter公司,美国);透射电镜(日立 Hu-12A,日本)。
1.2 人 PDLC的体外培养
收集临床因正畸拔除的前磨牙,要求无龋坏、尖周炎及牙周疾病,牙拔出后即放入装有无血清DMEM培养液的小瓶中,在超净工作台内用含有抗生素(青霉素100 u/mL,链霉素100μg/mL)的磷酸盐缓冲液(PBS)反复冲洗。刮取根中 1/3牙周膜组织,加入含20%FBS的DMEM培养液4mL,在饱和湿度,5%CO2,95%空气,37℃标准环境下静置孵育,待原代人 PDLC细胞从组织块周围游出并铺满培养板底 70%左右时,消化传代。取3~4代细胞用于实验,实验前对细胞进行免疫组化角蛋白和波形丝蛋白染色,鉴定细胞起源。
1.3 OMT对LPS作用下人 PDLC增殖的影响
取生长良好的人 PDLC,接种于96孔培养板,每孔 200μL,接种细胞浓度为1×105/mL,孵育 24 h贴壁后,弃原培养液,PBS清洗 2次加药,每组设6个复孔。分组:空白对照组(仅含1%FBS的DMEM培养液);25μg/mL LPS刺激组;25μg/mL LPS+1,10,25μg/mL OMT刺激组。在24,48,72 h检测。
终止反应前 5 h加入5mg/mL MTT溶液20 μL,继续培养4 h,吸弃上清液,每孔加DMSO 150 μL溶解,震荡 10 min,用酶标仪在490 nm波长处检测各孔吸光度(A)值,每组每孔测 3次取其均值。
1.4 OMT对LPS作用下人 PDLC细胞周期的影响
取生长良好的人 PDLC接种于200mL培养瓶,孵育 24 h贴壁后弃原培养液,PBS清洗 2次加药。分组:空白对照组(仅含1%FBS的DMEM培养液);25μg/mL LPS刺激组;25μg/mL LPS+1,10,25μg/mL OMT刺激组。
72 h后每组设5个平行样本,生理盐水2.5mL洗涤 2次(800 r/min离心 5 min),弃上清,加入生理盐水1mL将细胞混匀,再加入无水乙醇 2mL立即震荡混匀,封口膜封口,置4℃冷藏室固定备用。检测前,800 r/min离心 5min,弃无水乙醇,用生理盐水洗涤 2次,收取沉淀细胞(1 000 r/min,10 min),用4℃预冷 PBS洗 2次,每份标本加PI染液,4℃避光染色 l h,200筛网过滤后,将细胞置氩激光光源,功率为250 mW,激发波长488 nm条件下进行流式细胞仪测定及联机专用软件分析处理,计算各细胞周期时相细胞比例。
1.5 OMT对LPS作用下人 PDLC细胞超微结构的影响
取第4代生长良好的人 PDLC接种于200mL培养瓶,孵育 24 h贴壁后弃原培养液,PBS清洗 2次加药。分组:空白对照组(含1%FBS的DMEM培养液培养);阳性对照组(LPS培养24 h后洗去,加培养液再培养48 h);实验组(LPS培养24 h后洗去,加OMT再培养48 h,OMT终浓度为10μg/mL,LPS终浓度为100μg/mL)。消化收集细胞,PBS洗涤,1 200 r/min离心 10 min;包埋、聚合:35℃12 h,45℃ 12 h,60℃ 3 d;切片、染色:超薄切片机切 70~80 nm的超薄切片,经醋酸铀、柠檬酸铅分别染色5 min,水洗,在透射电镜下观察并摄片。
1.6 统计分析
2 结 果
2.1 OMT对LPS作用下人 PDLC增殖的影响
结果见表1。25μg/mL LPS能够有效地抑制PDLC增殖,其效应随时间延长而增强,各时相点不同浓度 OMT对LPS抑制PDLC增殖有明显的拮抗作用,并在一定范围内随浓度增大而增强,LPS组及各实验组之间均有显著性差异。
2.2 OMT对LPS诱导的人 PDLC细胞周期的影响
流式细胞仪检测结果见表2。与空白对照组相比,LPS培养后,使 DNA合成前期(G1期)细胞占百分比由48.3%增加至87.3%;相反,DNA合成期(S期)细胞百分比由39.6%下降至8.3%,两组之间有显著性差异(P<0.05)。OMT干预培养后,DNA合成前期(G1期)细胞所占百分比明显与阳性对照组相比下降,而DNA合成期(S期)细胞百分比上升,并在一定范围内呈浓度依赖性。
2.3 OMT对LPS作用下人 PDLC细胞超微结构的影响
表1 OMT对LPS诱导的人 PDLC增殖的影响(n=6,±s)Tab.1 The effects of oxymatrine on multiplication situation of PDLC under existing LPS(n=6,±s)

表1 OMT对LPS诱导的人 PDLC增殖的影响(n=6,±s)Tab.1 The effects of oxymatrine on multiplication situation of PDLC under existing LPS(n=6,±s)
与对照组比较:1P<0.05;与LPS组比较:2P<0.05Compared to control group:1P<0.05;Compared to LPS group:2P<0.05
组别 A490 24h 48 h 72 h空白对照组 0.436±0.012 0.576±0.014 0.674±0.023 LPS组 0.186±0.0211 0.264±0.0171 0.338±0.0131 LPS+1μg/mL OMT 0.307±0.0182 0.405±0.0252 0.526±0.0122 LPS+10μg/mL OMT 0.346±0.0252 0.436±0.0322 0.576±0.0272 LPS+25μg/mL OMT 0.361±0.0112 0.485±0.0242 0.596±0.0172
表2 OMT对LPS诱导的人PDLC细胞周期的影响(n=5,±s)Tab.2 The effects of oxymatrine on cell cycle of PDLC under existing LPS(n=5,±s)
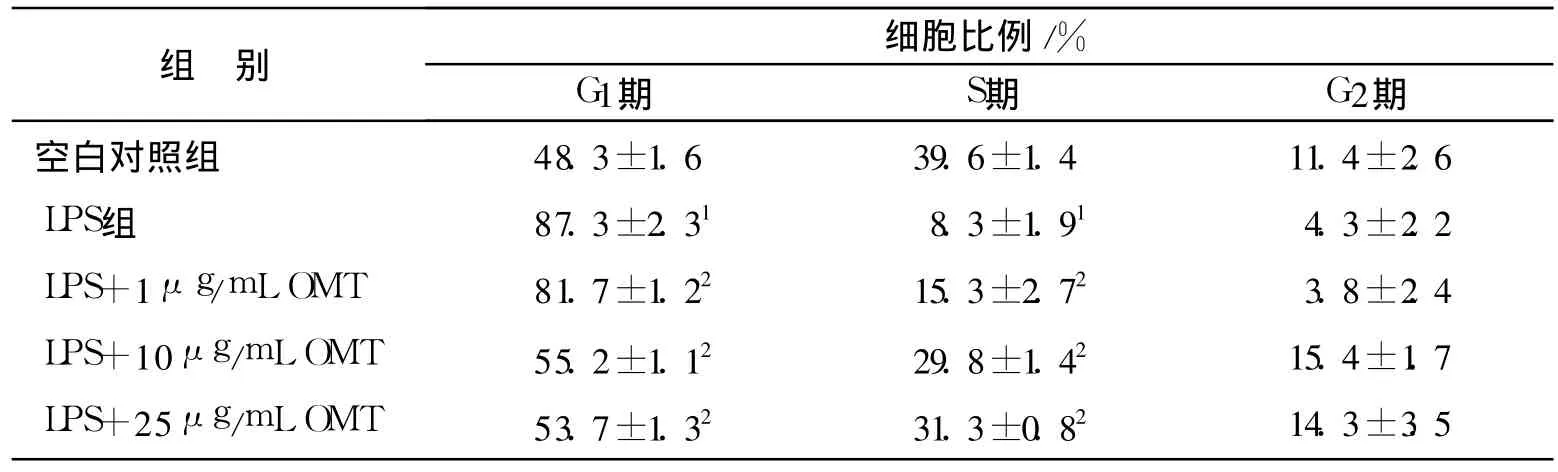
表2 OMT对LPS诱导的人PDLC细胞周期的影响(n=5,±s)Tab.2 The effects of oxymatrine on cell cycle of PDLC under existing LPS(n=5,±s)
与对照组比较:1P<0.05;与LPS组比较:2P<0.05Compared to control group:1P<0.05;Compared to LPS group:2P<0.05
组别 细胞比例/%G1期 S期 G2期空白对照组 48.3±1.6 39.6±1.4 11.4±2.6 LPS组 87.3±2.31 8.3±1.91 4.3±2.2 LPS+1μg/mL OMT 81.7±1.22 15.3±2.72 3.8±2.4 LPS+10μg/mL OMT 55.2±1.12 29.8±1.42 15.4±1.7 LPS+25μg/mL OMT 53.7±1.32 31.3±0.82 14.3±3.5
对照组透射电镜观察,细胞膜表面结构完整、微绒毛较多、核仁明显、常染色体为主、异染色体位于细胞边缘部、胞质丰富、细胞内粗面内质网数量较多、线粒体形态正常、细胞胞浆外可见分泌的胶原、脂滴,溶酶体少见(图1~3)。与对照组比较,LPS组超微结构发生了明显的变化。主要表现为出现大量肿胀的线粒体、线粒体嵴排列紊乱、胞浆中有自噬小体、其内为变性的线粒体,出现髓样结构、脂滴明显增多、多见空泡、溶酶体数量大量增加(图4)。与LPS组比较加入OMT后线粒体肿胀不明显,内质网无明显扩张,溶酶体数量也明显减少,细胞微丝丰富,微绒毛无明显肿胀(图5)。

图1 对照组(异染色体位于细胞边缘部、脂滴,溶酶体少见)(×16k)Fig.1 Control group(Different chromosomes in cells,edge,lipid drops enzyme body rare)(×16k)
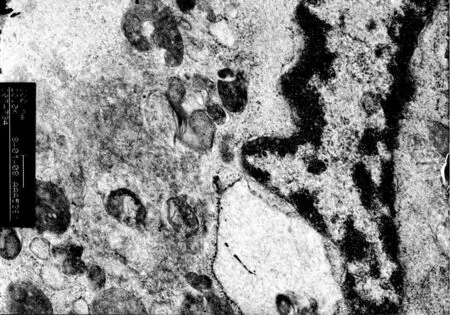
图2 对照组(核仁明显、线粒体形态正常)(×20k)Fig.2 Control group(Nuclear benevolence obvious,mitochondria form normal)(×20k)
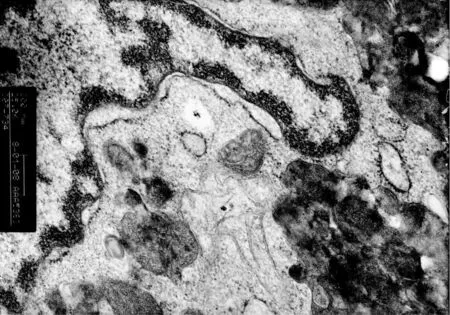
图3 对照组(内质网、线粒体形态正常)(×25k)Fig.3 Control group(Endoplasmic reticulum,mitochondria normal form)(×25k)
3 讨 论
牙周病可造成牙周支持组织的破坏,牙周附着丧失,最终导致牙齿丧失,牙周组织细胞,包括牙周膜细胞、成骨细胞、成牙骨质细胞和未分化的间充质细胞。其中PDLC是一组具有多向分化潜能的异质性的多能干细胞,可分化为成纤维细胞、成骨细胞和成牙骨质细胞,在牙周组织再生过程中发挥重要的作用,是牙周新附着的主要细胞来源[4]。
LPS具有极其广泛的生物学活性 ,能够引起许多细胞的生理或病理反应。研究表明,在牙周组织慢性炎症的发生过程中,LPS通过与血液中和细胞表面的内毒素结合蛋白(LBP)及内毒素受体CD14分子结合形成复合物,引起炎性反应,阻断 LPS介导的炎性反应的破坏对于保护PDLC有着重要意义[5]。
OMT在中枢神经系统、心血管系统、抗病毒、抗炎、免疫及抗肿瘤等方面有重要的药理活性和应用前途,各类制剂被广泛研究并应用于临床[6]。挖掘OMT在牙周发挥的抗炎及抑制炎症介质的作用可以为牙周病的治疗开辟一条新途径,提供新的思路。
在预实验中发现 OMT对PDLC的作用是有浓度依赖性的,超过一定浓度范围,OMT对PDLC有强烈的抑制作用。因此本文选取了1~25μg/mL OMT进行实验,结果表明不同浓度(1~25μg/mL)OMT对LPS抑制PDLC增殖有明显的拮抗作用,并在该范围内随浓度增大而增强。
本研究结果表明,LPS能够明显抑制人牙周膜细胞的生长与增殖,改变 PDLC细胞周期各期细胞所占百分比,使大多数细胞更多的停滞在DNA合成前期,而一定量的OMT对LPS刺激下的PDLC具有明显的保护作用,并在一定范围内呈量效关系,对LPS导致的牙周的炎症反应可发挥相应的对抗作用。本研究结果发现在100μg/mL LPS作用下PDLC超微结构发生了明显的变化,主要作用部位为细胞的生物膜系统,对线粒体破坏明显、脂滴明显增多、多见空泡、溶酶体数量大量增加,加入10μg/mLOMT后,LPS导致的细胞超微结构损伤明显减轻,主要表现在线粒体肿胀消失,溶酶体数量也明显减少,提示 OMT可阻断细菌脂多糖对人牙周膜细胞的破坏。李鹏等[7]研究发现 OMT等苦豆子生物碱对LPS刺激小鼠腹腔巨噬细胞和人早幼粒白血病细胞体外培养上清液及小鼠足肿胀的局部炎症渗出液中 TNF-α、IL-6和IL-8均具有一定的抑制作用,提示 OMT的抗炎免疫作用可能与其抑制早期致炎性细胞因子的产生有关。因此推测 OMT作用的机制可能是通过降低炎症介质水平以达到抑制炎症反应,防止 LPS对PDLC破坏的目的,但其具体作用机制还有待深入探讨。
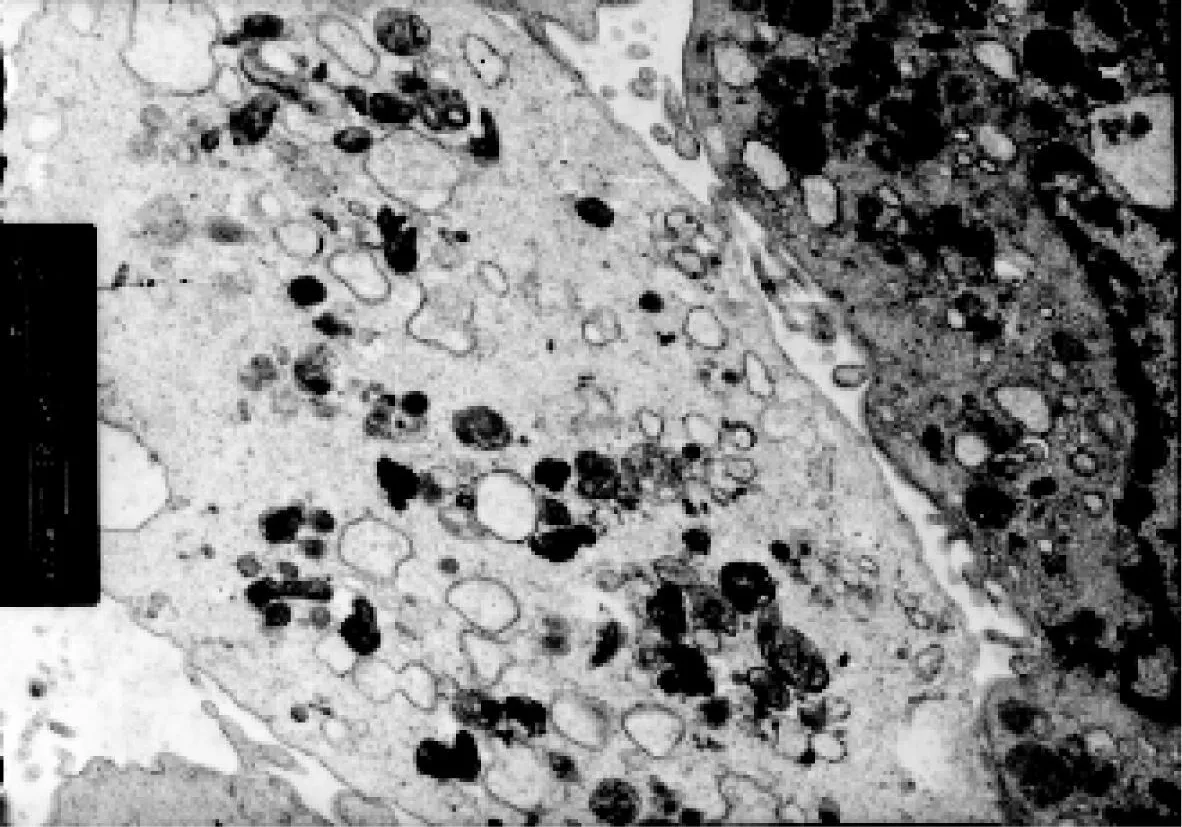
图4 LPS组(脂滴明显增多、多见空泡、溶酶体数量大量增加)(×8k)Fig.4 Control group(Lipid drops obviously increase,more empty bubble are seen,the lysosome number increased)(×8k)
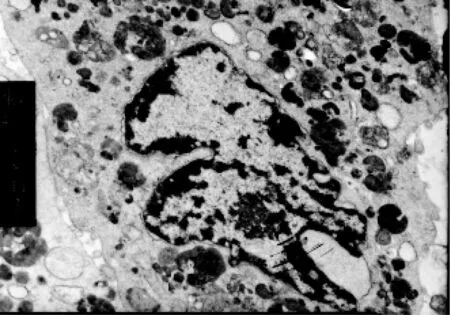
图5 实验组(溶酶体数量较少、与LPS组比较超微结构损伤明显减轻)(×8k)Fig.5 OMT group(The lysosome quantity is less,compared with LPSgroup and the ultrastructure damage is reduced significantly)(×8k)
[1]袁乃梅,马志伟,万玲,等.中间普氏菌和脆弱类杆菌内毒素对人牙周膜细胞增殖和超微结构的影响[J].牙体牙髓牙周病杂志,2002,12(8):424-427.
[2]张凤秋,吴织芬,万玲.牙周优势菌内毒素的生物学活性及与牙周炎相关的发病机制[J].牙体牙髓牙周病学杂志,2003,13(3):166-169.
[3]Wada N,Maeda H,Yoshimine Y,etal.Lipopolysaccharide stimulates expression of osteoprotegerin and receptor activator of NF-kappa B ligand in periodontal ligament fibroblasts through the induction of IL-1 beta and tumor necrosis factor-alpha[J].Bone,2004,35(3):629-635.
[4]Nojima N,Kobayashi M,Shionome M,etal.Fibroblastic cells derived from bovine periodontal ligamentshave thephenoltypesof osteoblasts[J].J Periodont Res,1990,25(3):179-185.
[5]Vita N,Lefort S,Sozzani P,etal.Detection and biochemicalcharacter-istics of the receptor for complexes of soluble CD14 and bacterical LPS[J].J Immunol,1997,158(7):3457-3462.
[6]黄秀梅,李波.氧化苦参碱对TNF-α、IL-6和IL-8的影响[J].中成药,2003,25(11):903-906.
[7]李鹏,司维柯,王源,等.苦参碱和氧化苦参碱抑制HepG2细胞增殖的对比研究[J].中国生化药物杂志,2004,25(5):261-264.

