肾上腺素对大鼠前脂肪细胞增殖、分化及其细胞内cAMP的影响
戴 冰,肖子曾,黄开颜,彭 柳,郭小鸽,赵 婧
(1.湖南中医药大学 第一附属医院,2.湖南中医药大学,湖南 长沙 410007)
增殖和分化是细胞发育过程中的两个不同方向,人及动物的脂肪组织含有增殖、分化活跃的前脂肪细胞,它对脂肪组织的增生、肥大起重要的作用,脂肪组织在体内受到各种因素包括体液、神经和激素的作用。肾上腺素类是重要的神经递质和内分泌物质,有研究证明,肾上腺素可升高视网膜色素上皮细胞(RPE)细胞内cAMP水平,其作用机制是通过结合RPE细胞膜上 β受体,使细胞内cAMP浓度增加[1]。有报道肾上腺素对人前脂肪细胞有刺激增殖、分化作用[2],但肾上腺素对大鼠前脂肪细胞增值和分化的作用未见报道。本文选用肾上腺素作用大鼠前脂肪细胞,旨在探讨肾上腺素对大鼠前脂肪细胞增殖和分化的影响及其作用机制。
1 材 料
1.1 动物
健康SD大鼠,清洁级,雌雄各半,体重(200±20)g,由河南省实验动物中心提供,许可证号:SCXK(豫)2005-0001。
1.2 试剂
肾上腺素、细胞培养液(DMEM/低糖),美国Hyclone公司;胎牛血清,兰州民海生物有限公司;胰酶,Sigma公司;cAMP试剂盒,上海中医药大学同位素室;其余试剂均为分析纯。
1.3 仪器
3K30型高速冷冻离心机,Sigma公司;UV-1600紫外分光光度计,北京瑞利分析仪器公司产品;佳能照相系统、XDS-1B体式倒置相差显微镜,日本Olympus;Heracell型细胞培养箱,德国贺利氏。
2 方法与结果
2.1 磷酸盐缓冲液(PBS)的配制
NaCl8.00g,KCl0.20g,Na2HPO4·12H2O3.49g,KH2PO40.20g溶于去离子水1000mL,调整pH值为7.2,高压灭菌,4℃保存。
2.2 大鼠前脂肪细胞的培养及传代
取雄性大鼠腹股沟部纯净脂肪颗粒,用PBS洗涤后剪成0.5~1mm3大小的颗粒,1 000 r/min离心 10 min取上层纯脂肪颗粒,轻轻地铺于经培养液润湿的培养瓶壁上。3~5min后徐徐加入含20%胎牛血清的DMEM低糖培养液5~10mL,塞紧瓶塞,将底面翻转朝上。37℃、5%CO2培养1~2h,待黏附牢固后,翻转培养瓶做正常培养,每日观察。原代培养区域性单层汇合达到约1/2瓶底面积后即可传代,取培养7代以内的大鼠前脂肪细胞用于实验。
2.3 大鼠前脂肪细胞生长血线
按马瑾瑜等[3]的方法测定。结果如图1。从生长曲线可见前脂肪细胞的倍增时间约为60 h左右。
2.4 组织化学提取法测定大鼠前脂肪细胞分化过程中的标志物——磷酸甘油脱氢酶(GPDH)
根据Stuart等[4]的方法进行测定,吸弃培养瓶内培养液,用PBS冲洗 2~3次,每孔加入冻存的细胞超声破碎溶液0.5mL,摇晃数分钟,将含有细胞的悬液加入小瓶中冰浴30~60s,用分光光度法测定GPDH的活性。吸取已配制的酶测定液1.5mL,加入待测溶液300μL,测定340 nm波长处的吸光度(A)值,加入磷酸二羟丙酮 100μL,1 min后再次测定340 nm波长处的A值。1单位GPDH的活性为每1min氧化NADH 1.0nmol的量。作出时间-A值曲线。结果如图2。图2表明,传代细胞形成单层汇合后,在10μmol/L胰岛素和1μmol/L地塞米松的作用下即开始上升并迅速增加,9d左右到达高峰并维持在高水平。形态上表现为单层汇合1周后,细胞内出现大量脂滴。而传代的前脂肪细胞不能自发形成分化。

图1 前脂肪细胞的生长曲线Fig.1 The growth curve of preadipocytes
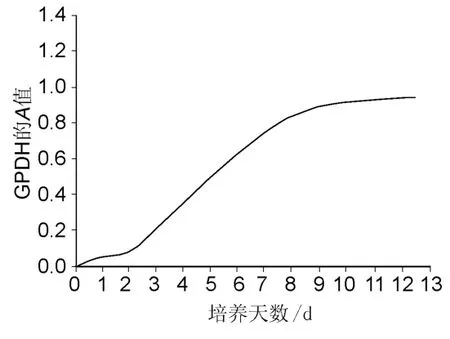
图2 前脂肪细胞分化过程中GPDH的动态变化Fig.2 The dynamic change of GPDH in preadipocyte differentiation process
2.5 油红O染色提取法测定脂肪细胞内脂肪含量
根据Ramirez等方法测定,吸弃培养瓶中的培养液,用PBS冲洗2~3次,加入10%的甲醛缓冲液室温下固定1h,去固定液,加入油红O染色,室温下染色2h,去染色剂,以无菌双蒸水冲洗2次,洗去未着色的染料,倒置显微镜下观察,照相。结束后,以DMSO溶解,测定490nm波长处的A值。结果如图3。由图3可见,前脂肪细胞内的脂肪含量在单层形成6~7d后迅速增加,11d左右到达高峰,与形态学上的单层汇合后1周左右细胞内出现脂肪颗粒完全吻合。细胞内脂肪含量的增加比 GPDH的出现要晚约6d。说明酶的出现在先,脂肪出现在后。
2.6 前脂肪细胞的指标测定
取传代7代以内的细胞分为:空白组,肾上腺素组,肾上腺素+普萘洛尔组,测定细胞的增殖、GP-DH及细胞内脂肪含量,结果如表1。
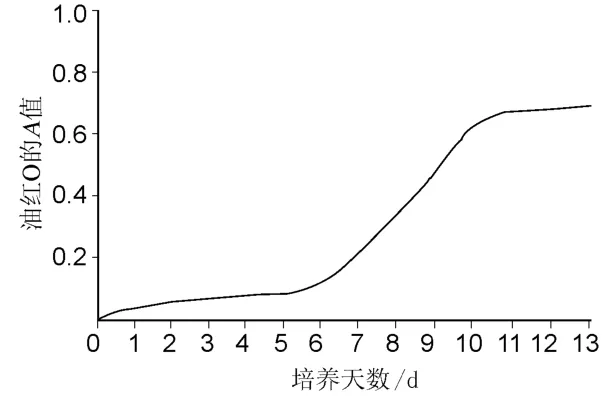
图3 前脂肪细胞分化过程中细胞内脂肪含量的变化Fig.3 The changes of cell′s fat content in preadipocyte differentiation process
表1 肾上腺素对大鼠前脂肪细胞增殖、分化的影响(±s,n=6)Tab.1 Effects of epinephrine on rat preadipocyte proliferation and differentiation(±s,n=6)
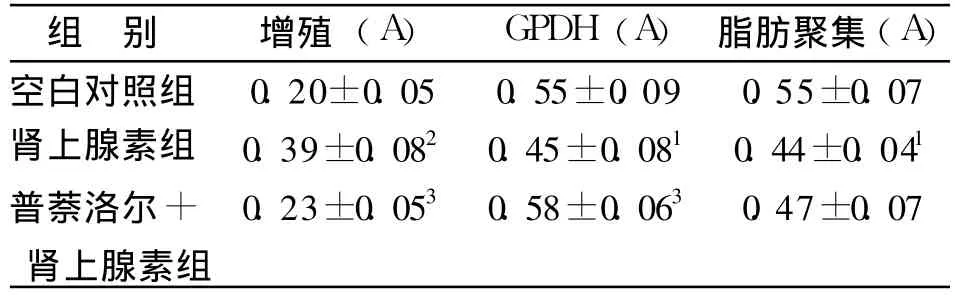
表1 肾上腺素对大鼠前脂肪细胞增殖、分化的影响(±s,n=6)Tab.1 Effects of epinephrine on rat preadipocyte proliferation and differentiation(±s,n=6)
与空白对照组比较:1 P<0.05,2P<0.01;与肾上腺素组比较:3 P<0.051 P<0.05,2 P<0.01 vs control group;3P<0.05 vs epinephrine group
普萘洛尔+肾上腺素组0.23±0.05 0.58±0.06 0.47±0.07
表1表明,肾上腺素组、普萘洛尔 +肾上腺素组与空白对照组比较,前者各项指标均有显著性差异,后者无著性差异;提示肾上腺素对大鼠前脂肪细胞的增殖有促进作用,对分化过程中 GPDH的升高及脂肪积聚均有抑制作用,β受体阻滞剂普萘洛尔可以阻断肾上腺素诱导前脂肪细胞增殖的促进及对分化过程中 GPDH的升高及脂肪积聚的抑制作用。
2.7 不同时间点肾上腺素诱导的大鼠前脂肪细胞内cAMP水平的测定
2.7.1 分组、给药 取传代 7代以内的细胞分为:空白血清对照组、肾上腺素+空白血清组(即每1mL 10%培养液加肾上腺素0.01mL,简称肾上腺素组)。
2.7.2 细胞内cAMP水平的检测取第6代大鼠前脂肪细胞,以2×105个/mL的浓度传于50mL培养瓶中,置37℃、5%CO2培养至生长旺盛时,弃培养液,给药后分别培养48,72,96h,收集细胞,用pH 4.75的醋酸缓冲液悬浮,调整浓度至106个/mL,取细胞悬液1mL,1500r/min离心5min,使细胞沉淀,弃去上清液,细胞沉淀加pH 4.75醋酸缓冲液1mL混悬,反复冻融 3~4次,3 000r/min离心15min,取上清液100μL按照药盒说明书进行测定。利用cAMP与125I-cAMP和特异性蛋白激酶竞争结合原理测定细胞内cAMP浓度,GC-1200r放射免疫计数器上测定放射性强度,从标准曲线上得出细胞内cAMP。实验数据以(±s)表示,方差齐者采用单因素方差分析方法,方差不齐者以秩和检验。细胞内cAMP水平检测如表2。
表2 测定不同时间点肾上腺素对大鼠前脂肪细胞内cAMP的影响(±s,n=6)Tab.2 Effects of epinephrine on cAMP which was from rat preadipocyte at different time points(±s,n=6)
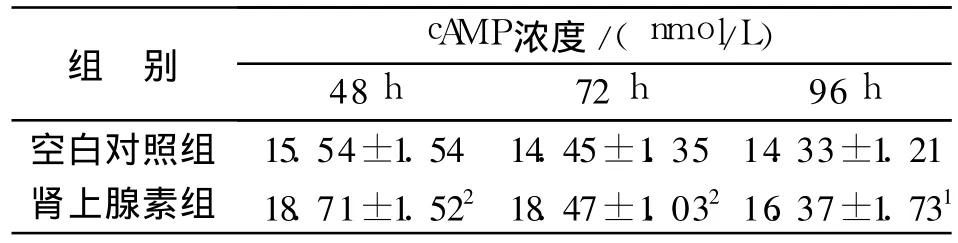
表2 测定不同时间点肾上腺素对大鼠前脂肪细胞内cAMP的影响(±s,n=6)Tab.2 Effects of epinephrine on cAMP which was from rat preadipocyte at different time points(±s,n=6)
与空白对照比较:1P<0.05,2P<0.011P<0.05,2P<0.01 vs control group
组别 cAMP浓度/(nmol/L)48h 72 h 96h空白对照组 15.54±1.54 14.45±1.35 14.33±1.21肾上腺素组 18.71±1.522 18.47±1.032 16.37±1.731
表2表明,肾上腺素组与空白对照组比较,在48,72,96h3个时间点均有显著性差异,提示肾上腺素可使大鼠前脂肪细胞内cAMP水平升高;48,72 h时间点与96 h时间点比较,有显著性差异。肾上腺素对cAMP水平升高的促进作用在48 h可达到最佳作用效果,而后,随时间的延长而降低。
3 讨 论
前脂肪细胞在促分化条件下单层汇合形成10 d后,细胞内已积聚了相当多的脂肪,变为近似圆形的多脂滴细胞。此时在培养液内加入各浓度的含药血清及其入血成分,作用5d后细胞内的脂肪明显减少,原来的大脂滴变细小,少数细胞甚至消失了细胞内的脂肪。油红 O的染色变浅,提取后A值降低,故据此来判断药物对脂肪积聚的作用。
前脂肪细胞为脂肪细胞的前身,又称成脂细胞,前脂肪细胞通过有丝分裂使脂肪细胞增多的方式称脂肪细胞的增殖。根据脂肪细胞分化过程中脂滴的变化可将脂肪细胞大致分为脂肪前体细胞(尚未出现脂滴之前的梭形细胞,adipocytepreeursc)、前脂肪细胞(刚出现脂滴后的细胞,preadipocyte)和成熟的脂肪细胞(1个或多个大脂滴以饱和状态充满了细胞的大部分,稍微扁平的核位于周围胞浆的狭带中,GPDH酶活性显著升高,adipocyte)。人和动物的脂肪组织中存在功能活跃的前脂肪细胞,是脂肪组织增生、肥大以及脂肪分解的重要作用位点,它的存在和作用持续于人的一生,与肥胖及脂肪移植成活率都有密切的关系。有研究表明其分化异常可导致肥胖及脂肪发育不良等疾病的发生。本实验的研究,有助于进一步探讨药物对人体脂肪代谢的影响。
本研究通过在不同时间点测定肾上腺素对大鼠前脂肪细胞内cAMP水平的作用,证明肾上腺素使细胞内cAMP水平升高,同时证明各个单体在48,72,96h3个时间点细胞内cAMP水平均有明显变化。综上各实验表明,肾上腺素对大鼠前脂肪细胞内cAMP的作用,与肾上腺素作用的时间的长短有关,48h后可达到最高水平。
本实验证明肾上腺素对大鼠前脂肪细胞的增殖有促进作用,对分化过程中GPDH的升高及脂肪积聚均有抑制作用,而普萘洛尔与肾上腺素合用时可阻断上述作用;肾上腺素还可使前脂肪细胞内的cAMP水平降低。由于肾上腺素有激活α、β受体的作用,普萘洛尔是β受体阻断剂[5],通过用普萘洛尔阻断 β受体的作用,故肾上腺素的这些作用可能通过前脂肪细胞的β受体完成。表明肾上腺素-β受体-cAMP系统可能参与了大鼠前脂肪细胞的增殖与分化。
[1]孙京华,王净信.肾上腺素对视网膜色素上皮细胞ATP酶活性及细胞内cAMP和钙离子浓度的影响[J].华中科技大学学报,2006,35(3):392-395.
[2]朱晓海,何清濂,林子豪.人前脂肪细胞培养及增殖与分化模型的建立[J].中华整形烧伤外科杂志,1999,15(3):199-200.
[3]马瑾瑜,顾映红,余竹元.用快速比色计量法测定细胞生长[J].上海医科大学学报,1993,20:309-311.
[4]Stuart J,Simpson J S.Dehydrogenase enzyme cytochemistry of unfixed leucocytes[J].JClin Path,1970,23:517-521.
[5]潘燕,徐红岩,张岫美.羟乙葛根素对肾上腺素受体的阻断作用[J].中国生化药物杂志,2006,27(3):145-147.

