骨髓间充质干细胞在大鼠重症急性胰腺炎中的作用
王建祥,王 平,吴海龙,刘 峰,周 锐
(华中科技大学 附属普爱医院 普外科,湖北 武汉 430033)
重症急性胰腺炎(SAP)是一种严重的全身性疾病,该病早期即可引起肺脏,肝脏等多功能器官衰竭。骨髓间充质干细胞(MSCS)是一种具有自我修复和多向分化潜能的原始细胞。近年许多研究表明MSCS可分化为成熟的肝细胞、胆管上皮细胞、血管内皮细胞、心肌细胞、肺泡上皮细胞等[1-3]。MSCS还可以通过表达不同的表面分子,行使免疫调节功能。目前利用MSCS极强的分化能力,将它用于缺血性心脏病、心肌梗死等疾病的治疗[4-5],显示了MSCS在临床应用中的巨大潜能。但将其用于胰腺炎领域的研究还处于初级阶段,本实验拟向 SAP模型大鼠体内移植异体 MSCS,来验证 MSCS是否能抑制炎症因子的释放,从而缓解炎症反应。
1 材 料
雨蛙素(caerulein)、脂多糖(lipopolysaccharide,LPS),Sigma公司;LPS胎牛血清,杭州四季青生物研究所;DMEM培养基,Gibco公司;Hoechst33258贮存液,上海化学试剂公司;TNF-α,IL-6放免分析测定试剂盒,北京东雅生物技术研究所。
成年健康 SD大鼠 114只,清洁级,体重 180~220 g,雌雄各半,湖北省实验动物中心提供,动物合格证号:SCXK(鄂)2006-0005。
2 方 法
2.1 大鼠 MSCS的分离、原代和传代培养
引颈法处死 SD大鼠,取出大鼠股骨和胫骨,冲出骨髓细胞,用Piltenger法[6]收集细胞,全骨髓贴壁接种于25 cm2培养瓶,每3 d换一次培养液,4~6 d细胞约90%融合,按 1∶2或 1∶3比例传代培养。
2.2 大鼠 MSCS标记率检测
P3代 MSCS待其生长融合80%左右,加入Hoechst33258贮存液,使 Hoechst33258终浓度为10 μg/L,放入37℃,5%CO2饱和湿度培养箱中孵育15 min。取细胞悬液滴到载玻片下用荧光显微镜观察,发现较多圆形黄绿色荧光颗粒则表示标记成功。
2.3 大鼠 SAP模型制备
将 SD大鼠随机分为4组:A组为空白对照组6只(未作任何处理);B组为单纯注射 MSCS组36只;C组为胰腺炎组36只。将用生理盐水配制的雨蛙素溶液按 20μg/kg注射至大鼠腹腔,连续 6次,每次间隔 1 h,最后一次注射雨蛙素的同时注射 LPS溶液10mg/kg;D组为治疗组36只,将雨蛙素溶液20μg/kg注射至大鼠腹腔,连续 6次,每次间隔 1 h,最后一次注射雨蛙素的同时注射 LPS溶液,注射LPS完毕后立刻于尾静脉注射标记的MSCS生理盐水悬液1mL(细胞密度 1×106/mL)。
2.4 组织化学检测
2.4.1 大鼠血浆中 TNF-α、IL-6的检测 分别取注射细胞后0.5,2,4,6,12 h下腔静脉血液4~5mL置于离心管中,分离血浆,集中用ELISA试剂盒检测血浆中 TNF-α、IL-6的浓度。
2.4.2 组织学检测 取出各大鼠胰腺,将一部分标本做石蜡切片,另外一部分做冰冻切片。取右肺下叶制作石蜡切片,右肺上叶制作冰冻切片。
2.4.3 大鼠肺的湿/干重比值 统一取试验开始后6 h大鼠左肺,称量湿重,放置70℃恒温烤箱烘烤72 h至恒重,称量干重。计算湿/干重比值。
2.5 切片荧光判定
切片中未见荧光:-;切片中偶见荧光(单个视野内可见荧光细胞数≤5):±;可见散在荧光细胞(每个视野内可见荧光细胞数≤10):﹢;可见较多荧光细胞(每个视野可以见荧光细胞数≤20):﹢﹢;可见大量荧光细胞(每个视野可以见荧光细胞数≥20):﹢﹢﹢;可见成团荧光细胞:﹢﹢﹢﹢。
2.6 统计学分析
3 结 果
3.1 细胞生长情况及鉴定
至第3代时,倒置相差显微镜下观察 MSCS,细胞基本呈均一的梭形。流式细胞仪示大鼠 MSCS为CD34-,CD44+,CD90+,阳性率分别为0.04%,90.81%,95.53%。
3.2 大鼠死亡情况
A、B组中均无大鼠死亡;C组12 h全部存活,24 h存活 2只,48 h内全部死亡;D组12 h全部存活,24 h后4只存活,48 h后3只存活,72 h后2只存活。
3.3 肺的湿 /干重比值
结果见表1。大鼠注射 MSCS细胞对大鼠肺脏无明显损伤;联合注射雨蛙素和LPS后,大鼠造成SPA后并且导致肺损伤;联合注射雨蛙素和LPS,同时注射 MSCS可以减轻 SPA导致的肺损伤。
表1 大鼠造模后6h大鼠肺湿/干重比(±s)Tab.1 Changes of lung wet dry ratio in each group of rats at 6 h(±s)

表1 大鼠造模后6h大鼠肺湿/干重比(±s)Tab.1 Changes of lung wet dry ratio in each group of rats at 6 h(±s)
与A组比较:1 P<0.01;与C组比较:2 P<0.01Compared with group A:1P<0.01;Compared with group C:2 P<0.01
?
3.4 大鼠血浆中 TNF-α,IL-6的浓度变化
结果见表2~3。单纯注射 MSCS并不会引起血浆中炎症因子 TNF-α、IL-6的升高,联合注射雨蛙素和LPS后可导致血浆中炎症因子 TNF-α、IL-6显著升高。注射雨蛙素和LPS后立即注射 MSCS可显著降低血浆中炎症因子 TNF-α、IL-6水平。
3.5 胰腺和肺病理改变
3.5.1 胰腺组织病理变化A组和B组胰腺间质无明显改变,无炎性细胞浸润,无坏死灶。C组大体观,胰腺高度水肿,表面有许多出血点;镜下胰腺间质内动脉痉挛,静脉明显扩张淤血,炎症细胞浸润,腺泡呈孤岛状,广泛腺细胞坏死,细胞结构模糊不清(图1)。D组大体观,胰腺仍充血水肿,但程度较 C组轻,表面出血点也较少;镜下胰腺间质充血水肿,炎性细胞浸润比 C组轻,有少量局灶性坏死,血管病变较 C组明显减轻(图2)。
表2 SAP中各组大鼠血浆中的TNF-α变化(±s)Tab.2 Changes of plasma TNF-αin each group rats(±s)
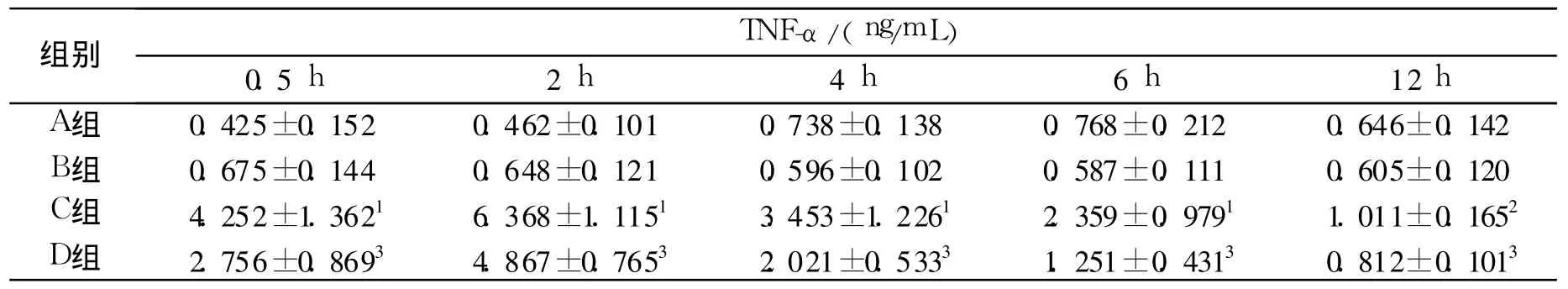
表2 SAP中各组大鼠血浆中的TNF-α变化(±s)Tab.2 Changes of plasma TNF-αin each group rats(±s)
与A组比较:1 P<0.01,2 P<0.05;与C组比较:3P<0.05Compared with group A:1P<0.01,2P<0.05;Compared with group C:3P<0.05
?
表3 SAP中各组大鼠血浆中的IL-6变化(±s)Tab.3 Changes of plasma IL-6 in each group of rats(±s)
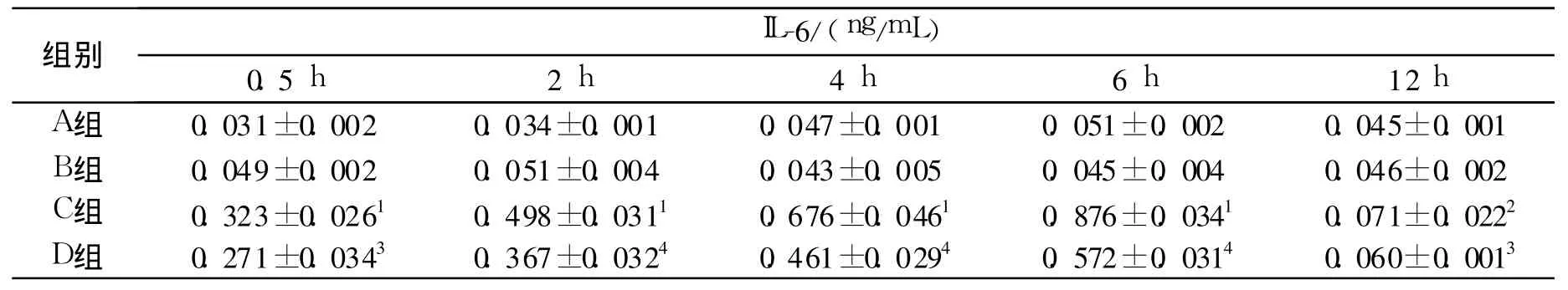
表3 SAP中各组大鼠血浆中的IL-6变化(±s)Tab.3 Changes of plasma IL-6 in each group of rats(±s)
与A组比较:1 P<0.01,2 P<0.05;与C组比较:3P<0.05,4P<0.01Compared with group A:1P<0.01,2P<0.05;Compared with group C:3P<0.05,4P<0.01
?

图1 C组SAP胰腺 6h病理变化Fig.1 The pathological changes of pancreas in Cgroup at 6 h
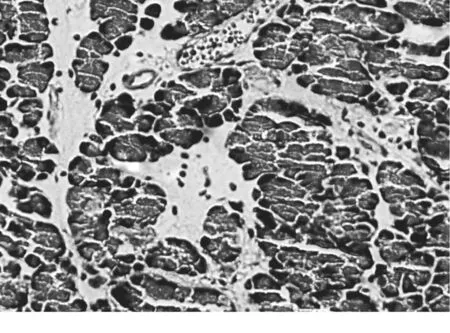
图2 D组SAP胰腺 6 h病理变化Fig.2 The pathological change of pancreas in D group at 6 h
3.5.2 肺组织的病理改变 A组和B组肺泡结构完整,肺泡上皮形态正常,肺泡间隔未见增宽,肺泡间质内未见水肿,出血和炎细胞浸润。C组肺表面有少量出血点;镜下肺泡壁结构破坏,肺泡壁毛细血管弥漫性扩张充血;肺泡间隔明显增宽,肺间质明显水肿,有大量炎性细胞浸润(图3)。D组肺表面未见明显出血点。镜下绝大部分肺泡壁结构完整,肺泡壁毛细血管轻度充血。肺泡间隔增宽较 C组轻,肺间质轻度水肿,少量炎性细胞浸润(图4)。
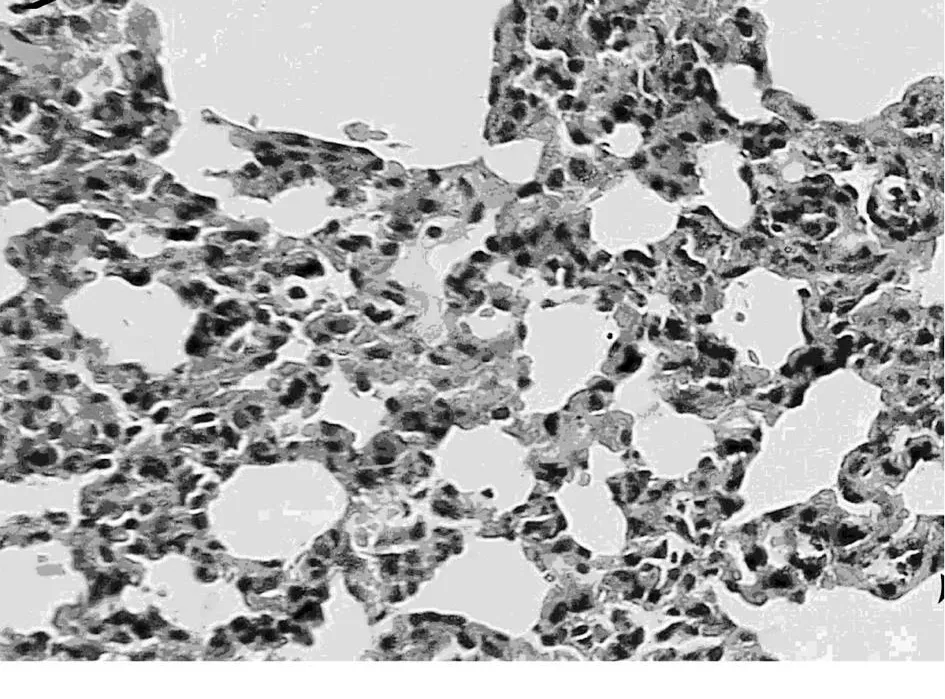
图3 C组6 h肺组织病理变化Fig.3 The pathological changes of lungs in C group at 6 h
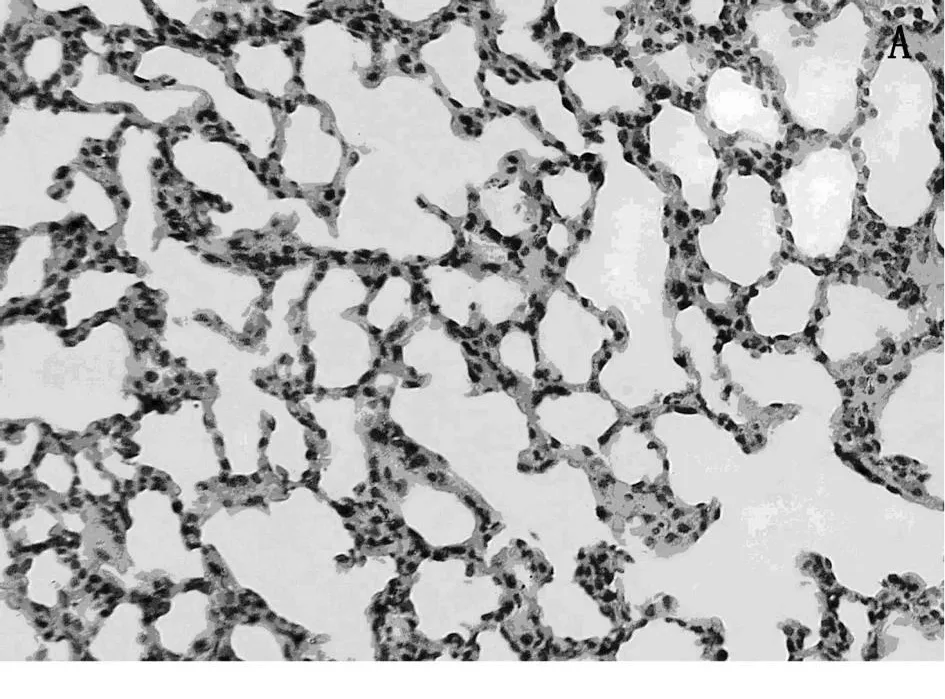
图4 D组6 h肺组织病理变化Fig.4 The pathological changes of lungs in D group at 6h
3.6 MSCS在胰腺和肺组织中的分布差异
结果见表4。对照组MSCS在胰腺、肺和肝脏组织中的分布无明显差异,D组MSCS在0.5 h在各组织分布无明显差异,从2 h开始可见明显分布差异,其中胰腺组织较多,肺组织其次,肝脏组织较少。D组与B组相比,D组胰腺和肺荧光细胞均数比同时间点 B组荧光细胞数多;而D组和B组肝脏内荧光细胞数在不同时间点相对比,差别不明显。死亡的大鼠体同 D组2 h以后相比,胰腺、肺和肝脏内荧光细胞数均较 D组存活的大鼠这些脏器内的荧光细胞数要少。
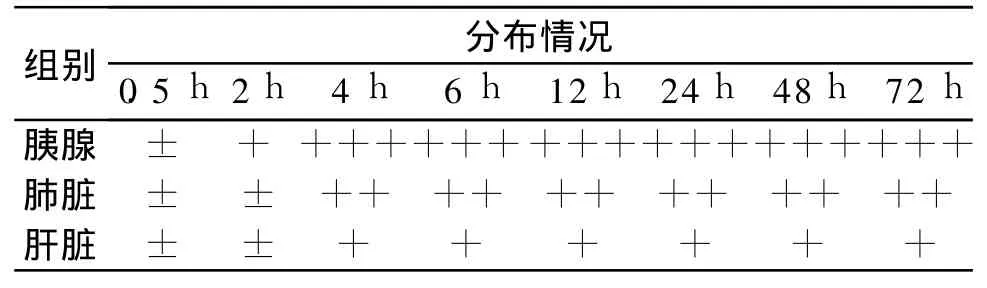
表4 D组不同时间点各器官中的MSCS分布情况Tab.4 The difference of distribution of stained MSCS at different time points
3.7 MSCS的分化情况
将 D组存活至72 h的SD大鼠肺和胰腺组织行HE染色,与B组SD大鼠72 h肺组织和胰腺组织对比,发现破损胰腺腺泡和肺泡壁细胞未见明显修复和再生。与B组24,48 h时肺组织肺泡壁和胰腺腺泡细胞相比也未见明显修复和再生。
4 讨 论
在SAP发病过程中,TNF-α和IL-6作为炎症介质有强烈的致炎活性[7],并且TNF-α作为SAP始动因子的作用已有研究证实[8]。
MSCS是存在于骨髓中不同于造血干细胞的一类组织干细胞,具有极强的可塑性,MSCS免疫原性较小,属于未分化的前体干细胞,因此MSCS移植同种异体后无排斥反应或反应较弱。
本研究结果显示,联合注射雨蛙素和LPS后大鼠体内 TNF-α、IL-6各时间点水平均比空白对照明显升高(P<0.01),高峰分别出现在注射后2和6 h。同时病理切片观察发现胰腺和肺组织发生充血水肿,大量炎性细胞浸润等明显改变。而治疗组在注射 MSCS后血浆各个时间点细胞因子 TNF-α、IL-6水平较单纯 SAP组显著降低(P<0.01),同时胰腺和肺组织损伤及炎性细胞浸润明显减轻。表明MSCS移植对SAP早期损伤具有保护作用。
MSCS移植后能减轻大鼠 SAP炎症反应,降低血浆中 TNF-α、IL-6的水平具体机理尚不清楚。MSCS表面具有 TNF-α、IL-6受体,通过与TNF-α、IL-6的直接结合可能是降低其水平的机制之一。本实验中荧光 MSCS在健康大鼠各组织中的分布无明显差异,而在SAP受损部位则有明显聚集,且一定程度上与损伤程度成正相关。研究表明在机体受损情况下MSCS有类似白细胞向损伤部位定向趋化移动能力。通过对比死亡和存活大鼠不同组织中MSCS的分布情况,可发现 SAP死亡大鼠胰腺和肺组织内 MSCS含量明显少于存活大鼠的含量,这可能与SAP损伤过重,组织毛细血管痉挛坏死导致血供不足,阻止了MSCS移动有关。
Neil等[9]研究发现放射性肺炎大鼠模型移植MSCS后,肺损伤减轻,从第7天开始 MSCS分化为肺泡Ⅱ细胞,但转化率较低。Tomita等[10]分离培养大鼠骨髓 MSCS,经5-氮杂胞苷诱导后移植入自体心肌冷冻损伤所得瘢痕组织中心,5周后表达肌钙蛋白I和肌球蛋白重链,表明 MSCS向心肌细胞分化。本实验大鼠 SAP移植 MSCS后72 h肺组织和胰腺组织均未见明显再生细胞。表明 MSCS可以通过分化之外的另一机制参与炎症反应,即与细胞因子相互作用的免疫调节机制。该机制可能在减轻SAP早期损伤中起重要作用。
MSCS对大鼠 SAP的作用机制较为复杂,既有免疫调节作用,还可能有横向分化为受损组织进行修复作用。本研究表明,在SAP早期可能以免疫调节为主,因为时间原因对于后期的分化修复作用未能深入研究。随着对分化调控、信号转导、归巢分子机制等研究的深入以及更多的大规模的研究,MSCS在SAP临床应用中有着广阔前景。
[1]Theise N D,Henegariu O,Grove J,etal.Radiation pneumonitis in mice:a severe injury model for pneumocyte engraftment from bone marrow[J].Exp Hematol,2002,30(11):1333-1338.
[2]Theise N D,Badve S,Saxena R,etal.Derivation of hepatocytes from bone marrow cells in mice after radiation-induced myeloablation[J].Hepatology,2000,31(1):235-240.
[3]Brazelton TR,Rossi FM,Keshet GI,etal.From marrow tobrain:Expression of neuronal phenotypes in adult mice[J].Science,2000,290(5497):1775-1779.
[4]Orlic D,Kajstura J,Chimenti S,etal.Bone marrow cells regenerate infracted myocardium[J].Nature,2001,410(6829):701-705.
[5]Jackson K A,Majka SM,Wang H,etal.Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells[J].J Clin Invest,2001,107(11):1395-1402.
[6]Pittenger M F,Mackay A M,Beck SC,etal.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284:143-147.
[7]庄岩,杨尹默,王维民,等.急性胰腺炎鼠白细胞介素(IL)1β、IL-18、肿瘤坏死因子 α、IL-1β转化酶的表达[J].中华实验外科杂志,2005,22(1):71-72.
[8]Mews P,Philips P,Fahmy R,et a1.Pancreatic stellate cells respond to inflammatory cytokines:potential role in chronic pancreatitis[J].Gut,2002,50(4):535-541.
[9]Neil D T,Octavian H,Joanna G,etal.Radiation pneumonitis in mice:A severe injury model for pneumocyte engraftment from bone marrow[J].Exp Hematol,2002,30:1333-1338.
[10]Tomita S,Li P K,Richard D,etal.Autologous transplantation of bone marrow cells improves damaged heart function[J].Circulation,1999,100(Supp 1):247.

