木犀草素对四氯化碳致大鼠肝纤维化的保护作用及其机制研究
李林林,龚国清,冯贻东,王 寅
(中国药科大学 药理教研室 药学医学基础实验教学中心,江苏 南京 210009)
肝纤维化主要是一种病理概念,系指肝组织内细胞外基质(extra cellular matrix,ECM)成分过度增生与异常沉积,所导致的肝脏结构和(或)功能异常改变的病理变化。研究发现肝星状细胞(hepatic stellate cells,HSC)是过多 ECM沉积的主要来源细胞,抑制HSC活化增殖、促进细胞凋亡是肝纤维化防治的方向[1]。木犀草素(luteolin)是一种很具有代表性的天然黄酮,具有抗菌、消炎、抗肿瘤等多种药理作用[2-4],并且是白毛夏枯草中治疗慢性支气管炎的主要活性成分。本研究探讨了木犀草素对大鼠肝纤维化的保护作用,为开发有潜力的抗肝纤维化药物提供实验依据。
1 材料与方法
1.1 药物及试剂
木犀草素,杭州福斯特药业有限公司,批号:080511;四氯化碳(CCl4,分析纯),汕头市西陇化工厂有限公司,批号:080103-2;秋水仙碱,昆明制药集团股份有限公司生产,批号:090325-01;透明质酸(HA)、层黏蛋白(LN)放射免疫分析药盒,北京北方生物技术研究所,批号:20100120;谷氨酸丙酮酸转氨酶(ALT)、谷氨酸草酰乙酸转氨酶(AST)、总蛋白(TP)、白蛋白(Alb)、肝组织超氧化物歧化酶(SOD)、丙二醛 (MDA)、羟脯氨酸(Hyp)测定试剂盒,南京建成生物工程研究所;新生牛血清,杭州四季青生物工程材料有限公司;DMEM(高糖)培养基,美国 Gibco公司;胰蛋白酶,Amresco公司;MTT,Amresco公司。
1.2 动物与细胞
SD大鼠 50只,体重 180~220 g,♂♀各半,南京医科大学实验动物中心提供,合格证号:SCXK(苏)2002-0031。
大鼠肝星状细胞(HSC-T6),为SV40转染 SD大鼠 HSC,为永生化细胞,表型为活化的HSC,具纤维化特性,购自中科院细胞库;人肝星状细胞(Lx-2),美国标准菌种收藏所(American Type Culture Collection),由华侨大学吕颖慧博士惠赠。
1.3 肝纤维化大鼠模型建立
将大鼠随机分为5组,每组10只,分别为空白对照组、CCl4模型组、秋水仙碱阳性对照组(0.2mg/kg)、木犀草素低剂量(20mg/kg)组和高剂量(80mg/kg)组,其中秋水仙碱和木犀草素均研磨后用0.5%CMC-Na溶液混悬后给药,灌胃体积均为1mL/100 g。全部动物于实验室饲养1周后,对照组与模型组给予 0.5%CMC-Na溶液,其余组灌胃给予相应剂量的药物,1次/d。同时,对照组皮下注射花生油溶液,其余各组每周 2次按0.2mL/100 g剂量皮下注射 40%CCl4花生油溶液(首剂量用纯CCl4),连续 12周。
1.4 检测指标和方法
末次给药后,禁食不禁水过夜,24 h后摘眼球取血,分离出血清。另取左叶肝组织用10%中性甲醛固定,石蜡包埋切片,HE染色,光镜下观察其组织形态学变化;采血后取肝右叶约0.5 g,在低温条件下剪碎,放入匀浆器中,再加入9倍体积的冷生理盐水,研磨成匀浆后,离心取得肝匀浆液。
按照试剂盒说明书检测血清 ALT、AST、TP、Alb、肝组织SOD、MDA、Hyp。按照试剂盒操作说明用放射免疫法测定血清 HA、LN。
1.5 MTT法检测 HSC-T6增殖抑制率
取指数生长期 HSC-T6(5×104/mL)接种于96孔培养板中,100μL/孔,在37℃,5%CO2条件下孵育,24 h后加无血清培养液37℃再孵育 24 h,使细胞生长同步进入休止期。弃上清,换含不同浓度药物(木犀草素浓度为1,10,100μmol/L)的全培养液200 μL/孔,每组6复孔,培养至24,48,72 h,终止培养前 4 h加5mg/mL MTT溶液20μL/孔,弃上清液,加入二甲亚砜(DMSO)150 μL/孔,震荡混匀,在490 nm波长处测定各孔吸光度(A)值。细胞增殖抑制率(IR)=(1-A实验/A对照)×100%。
1.6 木犀草素对Lx-2增殖的影响
取对数生长期的Lx-2以1×104个/mL浓度接种于96孔细胞培养板中,每孔加入细胞悬液0.2mL,置于37℃,5%CO2细胞培养箱中孵育 24 h。待大部分细胞贴壁后弃上清,加入含不同浓度木犀草素的DMEM培养基,木犀草素各组的浓度分别为20,25,30,35,40 mol/L,另设空白对照组。每组设6个复孔,48,72,96 h后,每孔加入5mg/mLMTT溶液20μL,置37℃,5%CO2培养箱中,继续培养4 h后轻轻吸尽上清液,每孔加入DMSO 150μL,溶解细胞内结晶,在492 nm波长处测定A值。
1.7 统计方法
2 结 果
2.1 大鼠一般情况
正常组大鼠的精神好,活动佳,饮食正常,体重增加明显,大便正常,皮毛有光泽;模型组大鼠精神萎靡,活动明显减少,体重增加慢且饮食少,大便稀水样,皮毛无光泽而且略发黄。木犀草素高、低剂量组及秋水仙碱阳性对照组的大鼠精神活动尚可,皮毛有光泽,体重亦增加,但比正常组的大鼠体重低,状态好于模型组。
2.2 木犀草素对肝纤维化大鼠肝功能的影响
结果见表1。模型组大鼠的血清 ALT、AST明显升高,TP、Alb显著降低,与正常对照组比较差异有显著性(P<0.01或 P<0.05),各给药组均可降低大鼠血清 ALT、AST的含量(P<0.01),改善 TP,升高 Alb(P<0.05)的含量。
表1 木犀草素对CCl4致大鼠肝损伤肝功能的影响(n=10,±s)Tab.1 Effect of luteolin on the hepatic function in rats with CCl4 induced liver fibrosis(n=10,±s)
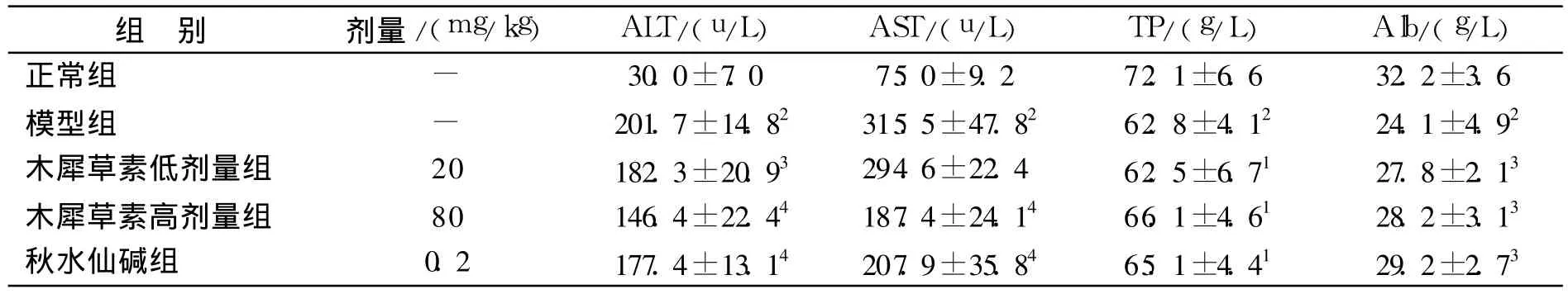
表1 木犀草素对CCl4致大鼠肝损伤肝功能的影响(n=10,±s)Tab.1 Effect of luteolin on the hepatic function in rats with CCl4 induced liver fibrosis(n=10,±s)
与正常组比较:1P<0.05,2P<0.01;与模型组比较:3P<0.05,4P<0.01Compared with control group:1 P<0.05,2P<0.01;Compared with modle group:3P<0.05,4 P<0.01
秋水仙碱组 0.2 177.4±13.14 207.9±35.84 65.1±4.41 29.2±2.73
2.3 木犀草素对大鼠血清 HA、LN及肝组织SOD、MDA、Hyp的影响
结果见表2。12周时肝纤维化模型组血清HA、LN显著升高,肝组织MDA、Hyp含量明显升高,SOD活性显著降低,与正常组比较,差异具有统计学意义(P<0.01);与模型组比较,木犀草素高、低剂量组与秋水仙碱阳性对照组大鼠的HA、LN显著降低(P<0.05),肝组织MDA、Hyp含量明显下降(P<0.05或 P<0.01),而且这三组均可以显著升高 SOD的活性(P<0.05或 P<0.01)。
表2 木犀草素对CCl4致肝损伤大鼠血清 HA、LN及肝组织SOD、MDA、Hyp的影响(n=10,±s)Tab.2 Effects of luteolin on the levels of serum HA,LNand thecontents of SOD,MDA,Hyp in rats with CCl4 induced liver fibrosis(n=10,±s)
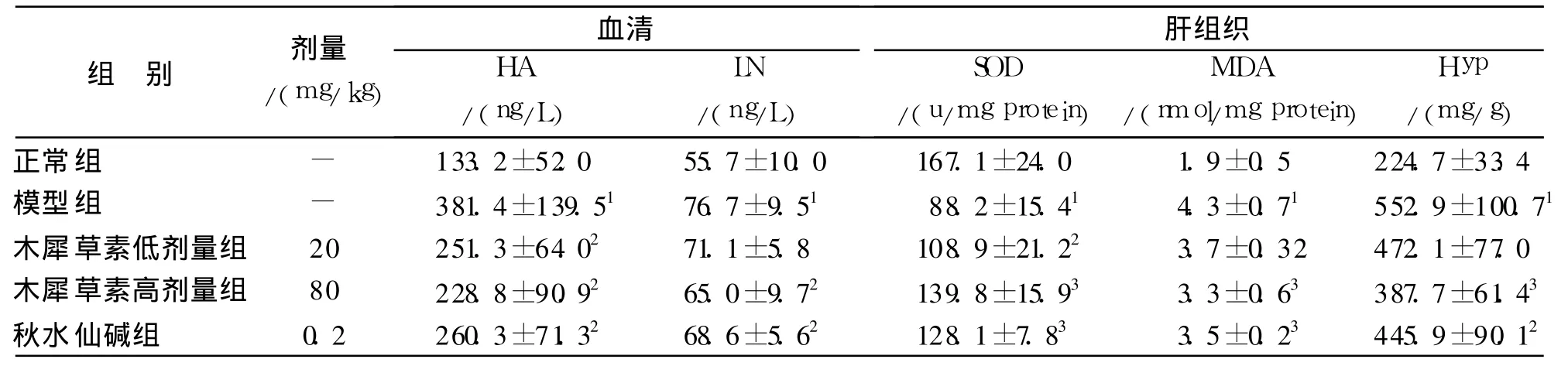
表2 木犀草素对CCl4致肝损伤大鼠血清 HA、LN及肝组织SOD、MDA、Hyp的影响(n=10,±s)Tab.2 Effects of luteolin on the levels of serum HA,LNand thecontents of SOD,MDA,Hyp in rats with CCl4 induced liver fibrosis(n=10,±s)
与正常组比较:1P<0.01;与模型组比较:2 P<0.05,3P<0.01Compared with control group:1P<0.01;Compared with modle group:2P<0.05,3P<0.01
?
2.4 肝组织病理学变化
2.4.1 形态学观察 正常组为正常肝脏表现,颜色深红,表面光滑,质地较软;纤维化模型组肝脏体积增大,颜色浅,灰黄色,表面有粗颗粒状;木犀草素低剂量组与秋水仙碱组大鼠肝脏体积有显著增大,颜色浅,表面欠光滑;木犀草素高剂量组大鼠肝脏颜色呈暗红色,体积略增大,边缘略钝,表面欠光滑。
2.4.2 组织病理学分析 HE染色观察结果显示,正常对照组的肝组织肝细胞索排列规则有序,结构清晰,肝细胞以中央静脉为中心呈放射状分布,肝组织内无脂肪空泡,仅汇管区和中央静脉有少许胶原纤维存在;模型组肝小叶结构破坏,肝索排列紊乱,少量炎性细胞浸润,纤维组织增生明显,将肝小叶分隔成大小不等的肝细胞团,肝细胞广泛变性坏死,汇管区扩大、胶原沉积;同纤维化模型组比较,木犀草素低剂量肝小叶结构破坏程度降低,肝脏胶原纤维增生亦减轻,纤维条索疏松变窄;木犀草素高剂量组结缔组织增生不明显,肝小叶结构明显改善,肝细胞脂肪空泡变性减少,炎性反应及坏死减轻;秋水仙碱组肝小叶样结构较正常,肝细胞体积增大,间质增生较明显,轻于模型组。见图1。
2.5 木犀草素对HSC-T6及Lx-2增殖的影响
木犀草素对HSC-T6的增殖有明显的抑制作用,且随着浓度的上升而抑制率逐渐升高,并且呈明显的时间剂量依赖性。10μmol/L木犀草素48 h时的抑制率达 34.4%;对Lx-2细胞增殖也有一定抑制作用,40μmol/L木犀草素48 h时的抑制率达18.7%。本犀草素对两种细胞的抑制结果有所不同,可能与人和大鼠 HSC对木犀草素的敏感性不同有关。

图1 肝组织切片HE染色(×100)Fig.1 Light microscopy showing liver tissue in each group(HE staining,×100)
3 讨 论
各种原因引起的肝细胞脂肪变性、淤胆及炎症等,达到一定严重程度均可刺激肝内局部贮脂细胞、静止的纤维母细胞增生并形成胶原纤维,增多的纤维组织形成细小的条索和菲薄的间隔,使肝脏纤维化。肝纤维化是各种病因所致的慢性肝病的共同病理过程,也是向肝硬化发展的主要中间环节[5],对它早期诊断和及时抗纤维化治疗,对肝硬化的防治、延缓、逆转等都起到极大的作用。
本实验中,木犀草素组与模型组比较,显著降低血清 ALT、AST,升高 Alb,反映出木犀草素对肝脏有一定的保护作用。Hyp是胶原蛋白所特有的氨基酸,测定Hyp含量可明确胶原总体水平,评定纤维化病变程度。本实验中,模型组Hyp显著升高,而各给药组Hyp明显降低。因为HA、LN与肝纤维化形成关系密切[6-7],本实验检测了血清 HA、LN的含量,结果发现模型组大鼠血清 HA、LN显著升高,而药物组血清 HA、LN浓度较模型组明显减小。提示通过木犀草素干预,能减少胶原的生成,抑制肝纤维化的进程。同时,木犀草素能明显降低肝纤维化大鼠肝组织中的MDA的水平和提高 SOD的活性,说明木犀草素能提高肝组织的抗氧化酶 SOD活性,抑制自由基的产生,促进其清除,并能抑制氧自由基引起的脂质过氧化反应,使 MDA生成减少,从而对肝组织起保护作用,使大鼠肝纤维化减轻,提示抗脂质过氧化作用可能是其抗肝纤维化的作用机理之一。
近年来,抑制HSC的增殖,促进其凋亡是抗肝纤维化研究的热点[8],目前的许多关于抗肝纤维化的研究都是在大鼠及其 HSC上进行的,鉴于人与鼠具有不同的种属特异性,从大鼠身上获得的研究成果并不一定适用于人。Lx-2细胞株保留了人 HSC的主要特征,为将从大鼠 HSC上获得的研究成果应用于人类提供了很好的工具[9]。
抗纤维化治疗,尚缺乏有效或较为理想的药物,目前中医药在抗肝纤维化方面具有相当大的优势,并已证实有抑制与逆转作用[10]。木犀草素对CCl4致大鼠肝纤维化有明确的抑制作用,关于其抗肝纤维化的进一步的机制问题,还有待深入研究。
致谢:感谢华侨大学分子药物学研究所吕颖慧博士提供人肝星状细胞(Lx-2)及对相关实验的大力帮助。
[1]Lamireau T,Des mouliere A,Bioulac-Sage P,et a1.Mechanisms of hepatic fibrogenesis[J].Arch Pediatr,2002,9(4):392-405.
[2]Hougee S,Sanders A,Faber J,etal.Decreased pro-inflammatory cytokine production by LPS-stimulated PBM-C upon in vitro incubation with the flavonoids apigenin,luteolin or chrysin,due to selective elimination of monocytes/macrophages[J].Biochem Pharmacol,2005,69(2):2411.
[3]郑亦文,马东来,陈敏珠.木犀草素对大鼠腹腔巨噬细胞释放H2O2的影响[J].中国药理学报,1990,6(1):56-58.
[4]Shi R X,Ong C,Shen H M.Protein kinase Cinhibition of apoptosis protein degradation contribute to the sensitization effect of luteolin on tumor necrosis factor-related apoptosis-inducingligan D-induced apoptosis in cencer cells[J].Cancer Res,2005,65(17):78-151.
[5]Alcolado R,Arthar M J P,Iredale P.Pathogenesis of liver fibrosis[J].Clin Sci,1997,92:103-112.
[6]强勇刚,廖永华.透明质酸(HA)检测中的某些问题探讨[J].放射免疫学杂志,2001,14(2):87-89.
[7]孔宪涛.肝纤维化诊断指标及评价[J].中华肝脏病杂志,1998,6(4):243-244.
[8]张绪福,吕志平,刘晓燕.以肝星状细胞为靶标的抗肝纤维化治疗进展[J].中国药理学通报,2003,19(6):622-626.
[9]Xu L,Hui AY,Albanis E,etal.Human hepatic stallete cell lines,Lx-1 and Lx-2:new tools for analysis of hepatic fibrosis[J].Gut,2005,54(1):142.
[10]Liver O C.Chinese association of integrative medicine.Guidelines for the diagnosis and treatment of liver fibrosis in integrative medicine practive[J].中华肝脏病杂志,2006,14(11):866-870.

