TTV1与TTV2SYBR-Green I实时荧光PCR检测方法的建立和应用
陈 欣,符 芳,王 伟,李雪松,李海忠,宋淑萍,李 曦*
(1.中国农业科学院哈尔滨兽医研究所猪传染病研究室,黑龙江哈尔滨150001;2.哈尔滨师范大学,黑龙江哈尔滨150001)
输血性传播病毒(Torque Teno virus/Transfusion transm itted virus,TTV)是一种与手术及输血后发生人肝炎病高度相关的病毒[1],通过水平传播和垂直传播两种途径感染,其中输血是TTV传播的重要传播途径之一[2-3,7]。根据ORF1的序列差异,可将TTV分为5个基因群(TTV1~TTV5)[8],其中,仅TTV1和TTV2在猪群中检测到,猪源TTV可以污染猪源疫苗及生物制品,因此受到该行业的重视[5]。相关报道证实,TTV在猪群中广泛存在,并与某些猪病的发生有明显的相关性[16]。MartelliF等对意大利南部179头健康猪的血清进行PCR检测,育肥猪、分娩育肥猪和断乳仔猪TTV阳性率分别为40.1%、11.0%和57.4%[13]。Takacs等对166头成年猪和断乳仔猪的血清样本检测,成年猪TTV阳性率为30%,断乳仔猪为73%[14]。Tuija等对西班牙猪群中仔猪断乳后多系统衰竭综合症(PMWS)阳性猪群、阴性猪群进行TTV调查时发现,PMWS阳性猪群中,TTV的感染率明显高于PMWS阴性猪群[12]。我国7个省份猪群的流行病学调查结果表明,TTV已在我国猪群中普遍存在,成为一个不可忽视的新病原[6]。
本实验采用SYBR-GreenⅠ实时荧光PCR方法,根据TTV1、TTV2的非编码区域(UTR)基因序列的差异,设计2对特异引物,建立了同时检测TTV1和TTV2的SYBR-GreenⅠ实时荧光PCR方法,为猪群TTV病的流行病学调查提供了有效的手段。
1 材料和方法
1.1 病料及病毒株 189份组织脏器、全血样品随机采自黑龙江、吉林不同地区的5个大中型猪场;猪繁殖与呼吸综合征病毒(PRRSV)经典株Ch1-a、高致病株HuN4和猪圆环病毒(PCV)2型PCV2871均由本实验室保存。
1.2 主要试剂 血液/细胞/组织DNA提取试剂盒、琼脂糖凝胶回收试剂盒购自天根生化科技有限公司;AxyPrep总RNA小量制备试剂盒购自爱思进生物技术有限公司;M-MLV和SYBR Prem ix Ex Taq均购自TaKaRa公司。
1.3 病毒核酸的提取 按照DNA提取试剂盒说明书提取病料DNA;按照AxyPrep总RNA小量制备试剂盒说明书提取病毒总RNA,常规方法进行逆转录以获得cDNA。
1.4 引物设计与合成 将GenBank登录的TTV1和TTV2的基因序列进行同源性比较,应用Oligo6.0软件,于UTR区域设计2对特异性引物(表1),引物由上海生工生物工程服务有限公司合成。
1.5 标准品的制备 以病料DNA为模板,进行PCR扩增,100μL体系反应条件为:94℃5m in;94℃30s、50℃30s、72℃30s,30个循环;72℃3m in。PCR产物经试剂盒回收并测序,与pMD18-T载体连接,获得pMD-TTV1和pMD-TTV2阳性质粒作为标准品备用。
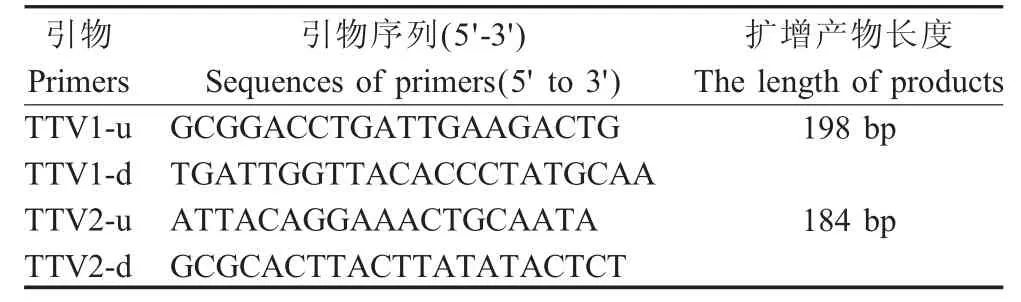
表1 用于扩增TTV1、TTV2特异序列的引物Table 1Sequence of primers for amplification of TTV1and TTV2
1.6 熔解曲线的建立 将pMD-TTV1和pMD-TTV2标准品按照109~100倍比稀释作为模板,通过特异引物进行SYBR GreenⅠ实时荧光PCR反应。反应条件为:95℃ 10s;95℃ 5s、52℃ 25s、72℃20s,40个循环。Rotor-gene3000荧光定量PCR仪收集荧光信号,建立熔解曲线。
1.7 特异性试验 分别以PRRSV的HuN4株、CH-1a株、PCV2871株的cDNA和DNA、pMD-TTV1和pMD-TTV2阳性标准品为模板,同时设置阴性对照,按照1.6方法进行SYBR GreenⅠ实时荧光PCR特异性检测。
1.8 敏感性试验 将TTV1和TTV2标准品按照109~100倍比稀释分别作为模板,进行SYBR Green I实时荧光PCR敏感性检测。
1.9 重复性试验 将同一批次的两个阳性标准品,分别稀释为10copies/μL,进行SYBR GreenⅠ实时荧光PCR,根据其Tm值差异,计算组内重复试验变异系数(CV);将不同批次的两个阳性标准品,分别稀释为 10copies/μL,每间隔 7d进行 SYBR GreenⅠ实时荧光PCR检测,根据其Tm值,计算组间重复试验CV值。
1.10 样品检测 应用建立的SYBR-GreenⅠ实时荧光PCR鉴别TTV1和TV2的检测方法,检测采集自黑龙江、吉林5个大中型猪场猪只的组织脏器、全血样品共计189份,对结果进行统计学分析。
2 结果
2.1 标准曲线的建立 以pMD-TTV1和pMDTTV2标准质粒为模板,进行SYBR GreenⅠ实时荧光PCR。扩增结果显示,当Ct值≤30,阴性对照无扩增,动力学曲线呈现指数扩增时,Tm1在79℃±0.25℃(pMD-TTV2)出现特异的荧光信号,判定其为 TTV2阳性;Tm2在82℃±0.25℃ (pMDTTV1)出现特异性的扩增信号时,判定其为TTV1阳性(图 1)。

2.2 特异性试验 以PRRSV的HuN4株、CH-1a株、PCV2871株的cDNA和DNA、TTV1和TTV2阳性标准品为模板,无模板为阴性对照,SYBR GreenⅠ实时荧光PCR特异性检测结果表明,仅TTV1和TTV2阳性标准品呈阳性,其余样品检测结果均为阴性(图2)。
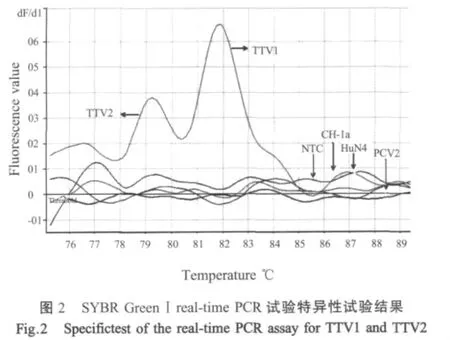
2.3 敏感性试验 将TTV1和TTV2标准品按照109~100倍比稀释作为模板,进行SYBR GreenⅠ实时荧光PCR,最低检出量为10copies/μL(表2)。
2.4 重复性试验 组内重复性试验结果表明,TTV1的Tm1CV值为0.14%,TTV2的Tm2CV值为0.13%(表3);组间重复性试验的结果表明,TTV1的Tm1CV值为0.74%,TTV2的Tm2CV值为 0.13%(表 4)。

表2 SYBR GreenⅠ实时荧光PCR的敏感性试验结果Table 2Sensitivity analysis of the SYBR GreenⅠreal-time PCR assay
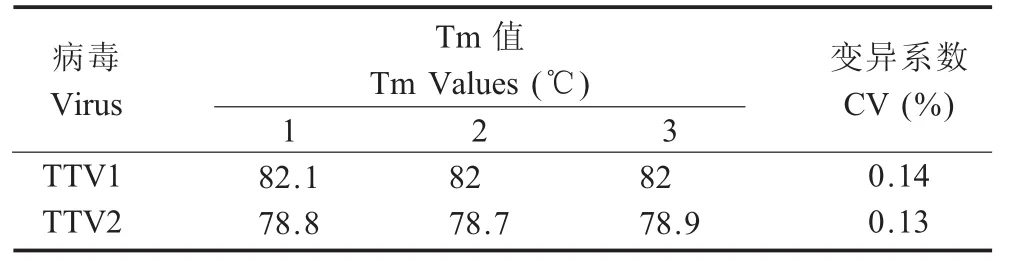
表3 SYBR GreenⅠ实时荧光PCR的组内重复性实验结果Table 3Intra-assay reproducibility test of the SYBR GreenⅠreal-time PCR
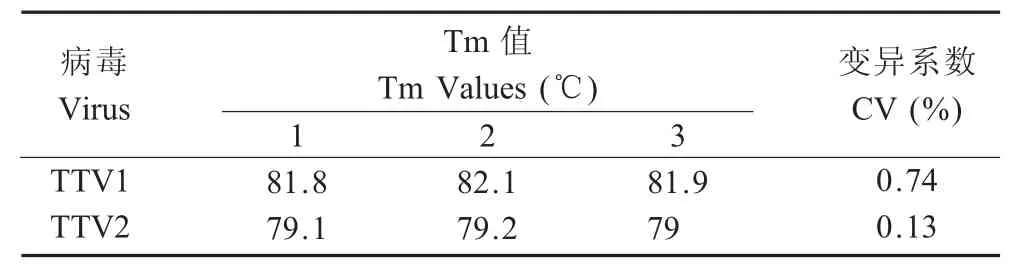
表4 SYBR GreenⅠ实时荧光PCR的组间重复性实验结果Table 4IInter-assay reproducibility test of the SYBR GreenⅠreal-time PCR
2.5 样品检测结果 应用本研究建立的SYBR-GreenⅠ实时荧光PCR鉴别TTV1、TTV2方法,检测采集自黑龙江、吉林5个大中型猪场猪的组织脏器和全血样品共计189份(表5)。

表5 运用本方法进行样品检测的结果Table 5Detection result of samples w ith the SYBR-GreenⅠrealtime-PCR
3 讨 论
目前,主要根据TTV1和TTV2基因组的差异,建立了普通PCR[6]、半套式PCR[10]、套式PCR[12]和滚环扩增[11]等方法检测TTV,相比较而言,普通PCR易出现假阳性结果,敏感性较差;半套式PCR、套式PCR和滚环扩增,耗时较长,自动化程度较低。Andress等根据探针法,建立了Taq Man实时PCR方法,鉴别诊断TTV1和TTV2[15]。该方法敏感性试验结果表明,最低检出量10copies/μL,扩增效率为99%,TTV1的组间和组内CV分别为1.7%和2.1%,TTV2的组间和组内CV分别为12.7%和10.3%。
本研究应用荧光法建立的同时检测TTV1、TTV2的实时荧光PCR方法,通过特异性、敏感性和重复性试验验证,结果表明,不同的Tm值区分判定TTV1和TTV2,经分析结果具有较大的差异(79℃±0.25℃,82℃±0.25℃)。其敏感性及扩增效率等同于已建立的Taq Man法。重复性试验表明,本方法的TTV1组间和组内CV值分别为0.14%和0.74%,TTV2组内和组间变异系数均为0.13%。比较Taq Man法,具有更为良好的稳定性。另外,相对于探针法而言,荧光法成本更加低廉,而且根据其标记原理,并不会由于单个碱基的改变而导致假阴性结果,因此,具有更为优异的可应用性。该方法的建立为猪群TTV病的流行病学调查提供了有效的手段。
[1]Nishizawa T,Okamoto H,Konishi K,et al.A novel DNA virus(TTV)associated w ith elevated transam inase levels in posttransfusion hepatitis of unknown etiology[J].Biochem Biophys Res Commun,1997,241(1):92-97.
[2]Martinez Guino L,Kekarainen T,Segales J.Evidence of torque teno virus(TTV)vertical transm ission in sw ine[J].Theriogenology,2009,71(9):1390-1395.
[3]Pozzuto T,Mueller B,Meehan B,et al.In utero transm ission of porcine torque teno viruses[J].Vet M icrobiol,2009,137(3-4):375-379.
[4]Mushahwar IK,Erker JC,Muerhoff A S,et al.Molecular and biophysical characterization of TT virus:evidence for a new virus fam ily infecting humans[J].Proc Natl Acad Sci USA,1999,96(6):3177-3182.
[5]Kekarainen T,Martinwz G L,Segales J.Sw ine torque teno virusdetection in pig commercial vaccines,enzymes for laboratory use and human drugs containing components of porcine origin[J].JGen Virol,2009,90:648-653.
[6]王礞礞,周艳君,童光志,等.我国猪群中TTV的鉴定及其分子流行病学分析[J].中国预防兽医学报,2009,31(10):751-756.
[7]Brassard J,Gagne M J,Lamoureux L,et al.Molecular detection of bovine and porcine torque teno virus in plasma and feces[J].Vet M icrobiol,2008,126(1-3):271-276.
[8]Devalle S,Niel C.Distribution of TTV genom ic groups 1-5in Brizilian blood donors,HBV carriers,and HIV-1infected patients[J].JMed Virol,2004,72(1):166-173.
[9]Okamoto H,Takahashi M,Nishizawa T,et al.Genom ic characterization of TT viruses(TTVs)in pigs,cats and dogs and their relatedness with species-specific TTVs in primates and tupaias[J].JGen Virol,2002,83:1291-1297.
[10]Segales J,Martinez G L,Cortey M,et al.Retrospective study on swine torqueteno virus genogroups 1and 2infection from 1985to 2005in Spain[J].Vet M icrobiol,2009,134(3-4):199-207.
[11]Niel C,Diniz-Mendes L,Devalle S.Rolling-circle amplification of Torque teno virus(TTV)complete genomes from human and sw ine sera and identification of a novel swine TTV genogroup[J].JGen Virol,2005,86:1343-1347.
[12]Kekarainen T,Sibila M,Segales J.Prevalence of swine torque teno virus in post-weaning multi-systemic wasting syndrome(PMWS)-affected and non-PMWS-affected pigs in Spain[J].J Gen Virol,2006,87:833-837.
[13]Martelli F,Caprioli A,Di B I,et al.Detection of sw ine torque teno virus in Italian pig herds[J].JVet Med B Infect Dis Vet Public Health,2006,53(5):234-238.
[14]Takacs M,Dencs A,Csiszar C,et al.First description of swine torque teno virus(TTV)and detection of a new genogroup in Hungary:short communication[J].Acta Vet Hung,2008,56(4):547-553.
[15]Gallei A,Pesch S,Esking W S,et al.Porcine torque teno virus:Determination of viral genomic loads by genogroup-specific multiplex RT-PCR,detection of frequentmultiple infections w ith genogroups1or2,and establishmentof viral full-length sequences[J].Vet M icrobiol,2009,21.
[16]Ellis J A,A llan G,Krakowka S.Effect of coinfection with genogroup1porcine torque teno virus on porcine circovirus type 2-associated postweaning wasting syndrome in gnotobiotic pigs[J].Am JVet Res,2008,69(12):1608-1614.

