表达猪繁殖与呼吸综合征病毒GP5蛋白基因重组犬2型腺病毒的构建及鉴定
周井祥,薛江东,刘 晔,张守峰,朱 霞,扈荣良*
(1.吉林农业大学动物科技学院,吉林长春130118;2.军事医学科学院军事兽医研究所,吉林长春130062;3.内蒙民族大学动物科技学院,内蒙古通辽028000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS病毒(PRRSV)引起的,以怀孕母猪发生严重繁殖障碍及仔猪与育肥猪出现呼吸道症状为主的传染病[1]。该病的防控以免疫预防为主。目前使用的PRRS常规疫苗(弱毒疫苗及灭活疫苗)因存在安全隐患或免疫效果差等不足,不能够提供理想的免疫保护[2-3],因此急需研制更安全有效的新型疫苗。PRRSV为有囊膜单股正链RNA病毒,基因组大小约15kb,含有7个开放阅读框(ORF),其中ORF1编码PRRSV的复制酶蛋白,ORF2-7编码结构蛋白。ORF5编码的GP5蛋白是PRRSV的重要结构蛋白,能够诱导机体产生中和抗体,研究者针对GP5蛋白制备了多种DNA疫苗及重组疫苗,经小鼠和猪体免疫试验均可检测到相应的中和抗体,并能够提供一定保护力[4-7]。
犬2型腺病毒(Canine adenovirus type 2,CAV-2)是一种良好的重组病毒载体,其E3区为复制非必需区,部分缺失后可以插入一定的外源基因。重组CAV-2在猪体内具有较好的复制能力,并且不会对感染猪产生致病性,对外界环境也无潜在危害[8-10]。
本研究以PRRSV GP5基因为目标基因,构建表达GP5蛋白的重组CAV-2,并对其免疫原性进行研究,为PRRSV重组疫苗的研制提供试验依据。
1 材料和方法
1.1 病毒株与细胞系 PRRSV为本实验室从临床送检猪病料样品中分离的野毒株;Marc-145细胞系、犬肾细胞系(MDCK)由本实验室保存。
1.2 重组质粒、细菌株及主要试剂 重组质粒pPolyⅡ-CAV-2、pMD18T-GP5及 pVAX-E3均为本实验室构建[11-13];E.coli DH10B由本实验室保存;新生犊牛血清购自Hyclone公司;辣根过氧化物酶(HRP)标记的羊抗猪IgG、DAB显色剂购自北京中山生物技术公司;抗PRRSV猪阳性血清购自哈尔滨兽医研究所。
1.3 重组质粒的构建 将含有GP5基因的重组质粒pMD18T-GP5和真核表达载体pEGFP-C1采用EcoRⅤ和Bam HⅠ双酶切,回收相应片段并相连,构建重组质粒pEGFP-GP5。用AseⅠ和MLuⅠ双酶切重组质粒pEGFP-GP5,K lenow补平,回收GP5基因表达盒。用SspⅠ单酶切含有E3区的重组质粒pVAX-E3,缺失CAV-2E3区859bp,回收大片段;与GP5基因表达盒在T4DNA连接酶的作用下连接,得到表达盒与E3区同方向的重组质粒pVAXGP5。用NruⅠ和SalⅠ双酶切pVAX-GP5,与NruⅠ和SalⅠ双酶切并经过CIAP处理的pPolyⅡ-CAV-2连接,得到重组质粒pPoly-Ⅱ-CAV-2-GP5。
1.4 重组病毒的包装 参照文献[9]方法将重组质粒pPoly-Ⅱ-CAV-2-GP5转染至MDCK细胞中。细胞出现腺病毒病变后,收获重组病毒,并命名为rCAV-2-GP5。
1.5 rCAV-2-GP5基因组的提取及酶切鉴定 按照常规方法提取病毒基因组,用不同的限制性内切酶处理,并以亲本病毒CAV-2基因组酶切做对照,鉴定重组病毒。
1.6 rCAV-2-GP5基因转录的检测 提取rCAV-2-GP5的第30代细胞培养物的总RNA,用GP5蛋白基因特异性引物进行RT-PCR扩增,检测GP5基因是否稳定转录。
1.7 目的基因表达盒的克隆测序 采用文献[9]中E3缺失区两侧的引物,以rCAV-2-GP5基因组为模板进行PCR扩增(GP5片段两侧含有E3区部分序列),并由上海联合基因(集团)科技有限公司测序。
1.8 rCAV-2-GP5TCID50的测定 将rCAV-2-GP5和CAV-2分别进行10倍梯度稀释,并接种于长满MDCK细胞单层的96孔细胞培养板,每个稀释度接种8个孔。同时设定仅加入维持液的空白对照。37℃5%CO2培养,逐日观察细胞病变(CPE),按Reed-Muench法计算TCID50。
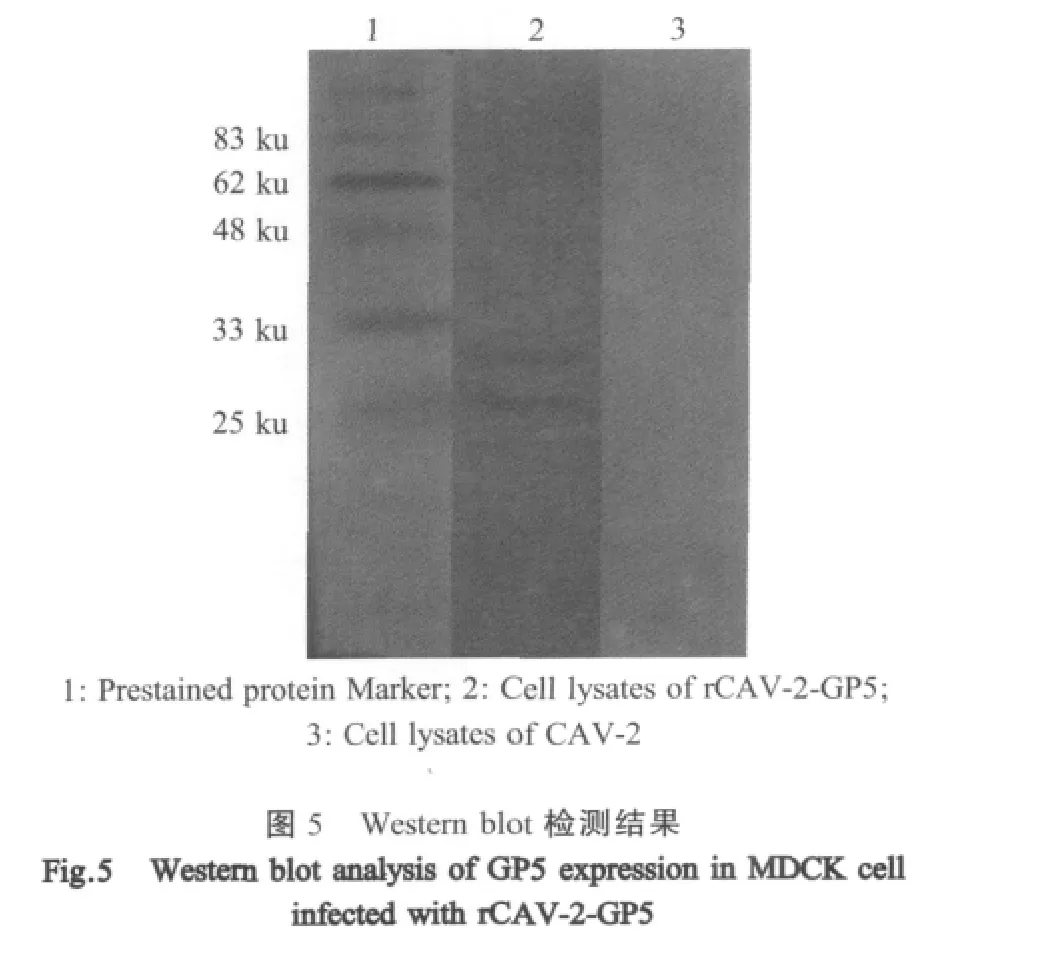
1.9 Western blot鉴定 将rCAV-2-GP5接种MDCK细胞,当80%CPE时,收集细胞上清,以抗PRRSV猪阳性血清为一抗,HRP标记的羊抗猪IgG为二抗,DAB显色,进行western blot检测。
2 结果
2.1 重组质粒的酶切鉴定 经两步连接构建后,将含有PRRSV GP5基因的表达盒插入到缺失E3区的重组质粒 pPolyⅡ-CAV-2中,命名为 pPoly-Ⅱ-CAV-2-P5。分别用Bam HⅠ、XbaⅠ、SacⅠ、Sna BⅠ单酶切以及SalⅠ和NruⅠ双酶切,以重组质粒pPolyⅡ-CAV-2作为阴性对照,结果与预期相符(图 1)。
2.2 重组病毒的鉴定 将pPoly-Ⅱ-CAV-2-GP5用PmeⅠ和AscⅠ双酶切,转染MDCK细胞,并传代培养10d,光学显微镜观察可见典型腺病毒CPE(图2)。收获细胞培养物,提取rCAV-2-GP5核酸,进行酶切鉴定,表明该重组病毒内包含了PRRSV GP5基因(图 3)。
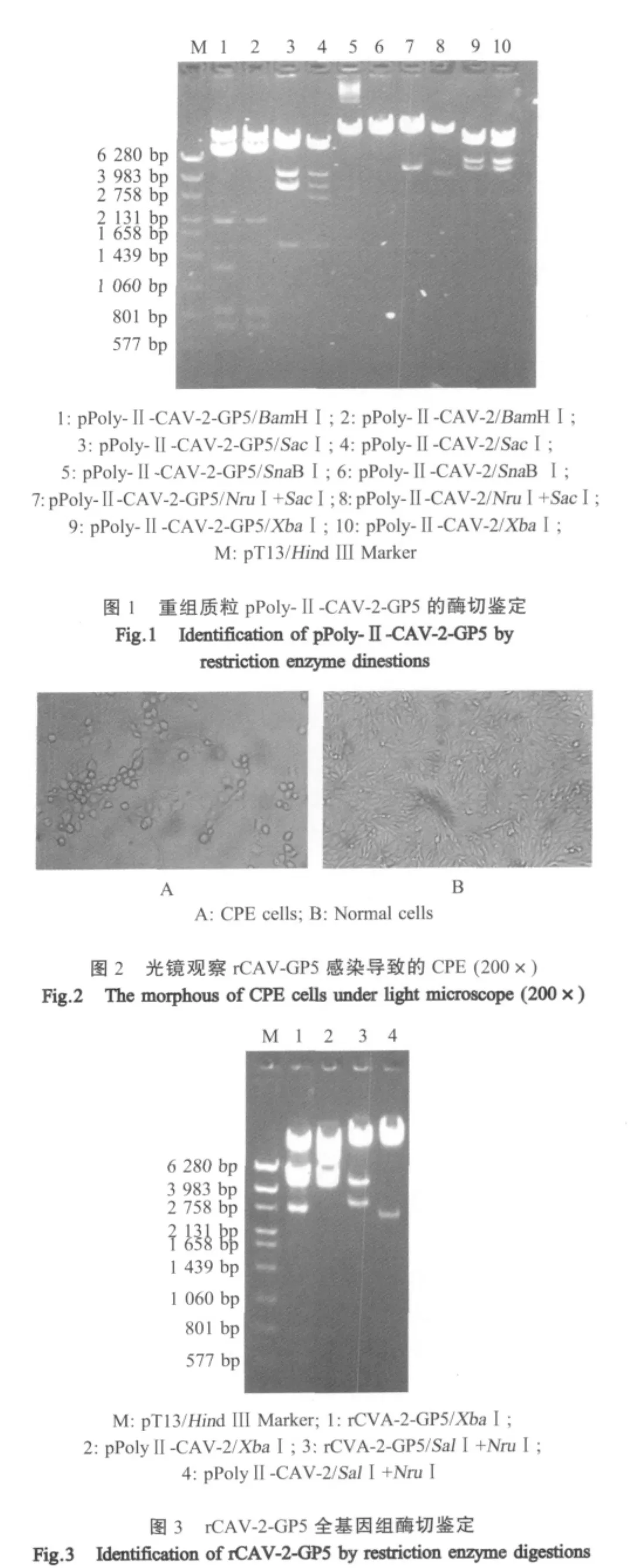
2.3 rCAV-2-GP5中PRRSV GP5基因克隆测序以rCAV-2-GP5基因组为模板,PCR扩增得到与理论值(603bp)相符的片段。序列测定结果与GP5基因的序列一致。
2.4 GP5基因转录的检测 将rCAV-2-GP5的第30代细胞培养物进行RT-PCR扩增,结果显示扩增得到GP5特异的核酸片段,表明rCAV-2-GP5在MDCK细胞内繁殖过程中PRRSV GP5基因能够稳定转录(图 4)。
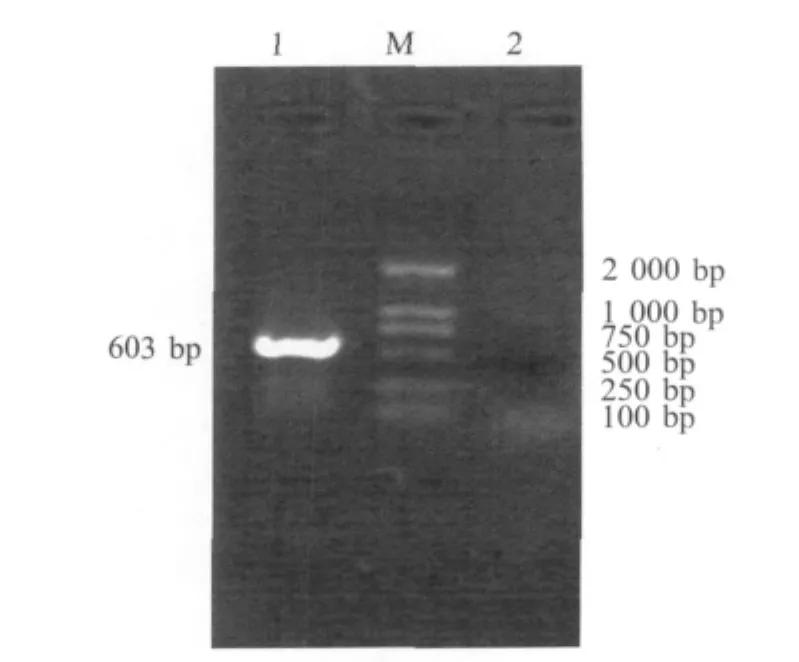
M:DL2000Marker;1:rCAV-2-GP5;2:rCAV-2
2.5 rCAV-2-GP5TCID50测定结果 在相同条件下,rCAV-2-GP5培养物的滴度为1×106TCID50/m L,CAV-2培养物滴度为1×107TCID50/m L,前者比后者低10倍。
2.6 Western blot检测结果 利用western blot检测方法,对感染rCAV-2-GP5的MDCK细胞中表达的GP5蛋白进行检测,结果显示rCAV-2-GP5表达的GP5蛋白可以被多克隆抗体识别,表达蛋白分子量约为25ku,与预期相符(图5)。
3 讨 论
目前,腺病毒作为一种良好的疫苗载体已经被应用于各种动物疫苗的研究中,国内外均有PRRSV GP5重组人腺病毒的报道,但免疫效果均不理想[6-7]。以犬腺病毒作为载体的疫苗是否会产生较强的免疫保护力,仍需进一步评价。
GP5是PRRSV基因工程疫苗的主要候选基因之一。使用单一基因作为疫苗的抗原基因,免疫效力可能较低,而研究者多以不同抗原基因融合表达或各自表达来增强免疫效果[4-7]。本实验选择单一基因,目的是为多基因分别表达或融合表达提供试验依据。
构建重组腺病毒的方法主要有体内同源重组法和体外连接法,而本实验采用的是体外连接法。构建重组CAV-2需要进行克隆后,将外源基因表达盒插入E3区缺失的全基因组重组质粒pPoly-Ⅱ-CAV-2-GP5中,并转染MDCK细胞,出现典型的CPE,由此得到的重组病毒无需纯化。本实验的构建策略比以往的方法更简便和省时省力,因而具有更高的成功率。细胞转染也是获得重组病毒的关键步骤。根据以往经验,一般认为转染受细胞生长状态和密度、脂质体和DNA的浓度、培养液中血清及转染基因片段或质粒大小、纯度等因素的影响。
本研究将GP5基因插入CAV-2载体中获得重组病毒,经过多酶切鉴定、克隆测序,证明重组病毒构建正确;RT-PCR、western blot检测表明rCAV-2-GP5在繁殖过程中能够转录PRRSV GP5基因,并较好表达目的蛋白,具有相应的生物学活性。
[1]Terpstrs C,Wenswoort G,Pol JM A.Experimental reproduction of porcine epidem ic abortion and respiratory syndrome(mystery swine disease)by infection w ith Lelystad virus[J].Vet Q,1991,13:131-136.
[2]Zuckermann F A,Garcia E A,Luque ID,et al.Assessment of the efficacy of commercial porcine reproductive and respiratory syndrome virus(PRRSV)vaccines based on measurement of serologic response,frequency of gamma-IFN-producing cells and virological parameters of protection upon challenge[J].Vet M icrobiol,2007,123:69-85.
[3]Scortti M,Prieto C,Alvarez E,et al.Failure of an inactivated vaccine against porcine reproductive and respiratory syndrome to protect gilts against a heterologous challenge with PRRSV[J].Vet Rec,2007,161(24):809-813.
[4]Jiang Y,Fang L,Xiao S,et al.A suicidal DNA vaccine co-expressing two major membrane-associated proteins of porcine reproductive and respiratory syndrome virus antigens induce protective responses[J].Biotechnol Lett,2009,31(4):509-518.
[5]Li J,Jiang P,Li Y,et al.HSP70fused w ith GP3and GP5of porcine reproductive and respiratory syndrome virus enhanced the immune responses and protective efficacy against virulent PRRSV challenge in pigs[J].Vaccine,2009,27(6):825-832.
[6]Gagnon C A,Lachapelle G,Langelier Y,et al.Adenoviral-expressed GP5of porcine respiratory and reproductive syndrome virus differs in its cellular maturation from the authentic viral protein but maintains known biological functions[J].Arch Virol,2003,148(5):951-972.
[7]Jiang W,Jiang P,Li Y,et al.Recombinant adenovirus expressing GP5and M fusion proteins of porcine reproductive and respiratory syndrome virus induce both humoral and cell-mediated immune responses in mice[J].Vet Immunol Immunopathol,2006,113(1-2):169-180.
[8]Fischer L,Tronel JP,Pardo-David C,et al.Vaccination of puppies born to immune dams with a canine adenovirus-based vaccine protects against a canine distemper virus challenge[J].Vaccine,2002,20(29-30):3485-3497.
[9]Liu Ye,Hu Rong-Liang,Zhang Shou-Feng,et al.Expression of the Foot-and-Mouth Disease virus VP1protein using a replication-competent recombinant canine adenovirus type-2elicits a humoral antibody response in a porcine model[J].Viral Immuno,2006.
[10]Kremer E J,Boutin S,Chillon M,et al.Canine adenovirus vectors:an alternative for adenovirus-mediated gene transfer[J].J Virol,2000,74(1):505-512.
[11]Zhang S F,Hu R L,Niu JQ,et al.Cloning and identification of the full length infectious genome of canine adenovirus type-2[J].Chin,JVet Sci,2002,22:533-535.
[12]周井祥,薛江东,张嘉保,等.猪繁殖与呼吸综合征病毒GP5蛋白基因疫苗的构建及免疫小鼠试验[J].吉林农业大学学报,2007,29(1):91-94.
[13]Hu R,Zhang S,Fooks A R,et al.Prevention of rabies virus infection in dogs by a recombinant canine adenovirus type-2encoding the rabies virus glycoprotein[J].M icrobes Infect,2006,8(4):1090-1097.

