马传染性贫血病毒驴白细胞弱毒疫苗株致弱过程中不同代次病毒LTR的进化分析
王雪峰,杨 彬,韩秀娥,林跃智,姜成刚,吕晓玲,赵利平,周建华*,王凤龙*
(1.内蒙古农业大学动物科学与医学学院,内蒙古呼和浩特010018;2.中国农业科学院哈尔滨兽医研究所兽医生物重点实验室/大动物病研究室,黑龙江哈尔滨150001;3.东北农业大学黑龙江省乳品工业技术开发中心,黑龙江哈尔滨150001)
马传染性贫血病毒(Equine infectious anem ia virus,EIAV)疫苗是唯一大规模使用的慢病毒疫苗,揭示其致弱机理和免疫机制将为其他慢病毒疫苗,特别是人类免疫缺陷病毒疫苗的开发提供重要的参考。EIAV驴白细胞弱毒疫苗株(EIAVDLV121)是由EIAV驴强毒株(EIAVDV117)通过体外培养的驴白细胞连续传代120代后驯化培育的。在传代过程中随着传代次数的增加病毒逐渐适应在驴白细胞内的增殖,而对马和驴的毒力逐渐减弱,在120多代后病毒完全丧失致病力[1]。长末端重复序列(Long term inal repeats,LTR)是反转录病毒前病毒基因组两端共有的非蛋白编码区序列,它对病毒复制和基因表达有重要的调控作用[2]。EIAV在长期适应体外组织培养后LTR的增强子区会发生较高频率的变异,这些变异会导致LTR转录因子结合位点的改变,进而引起病毒的细胞嗜性和致病性变化[3]。研究表明,EIAV的LTR是影响病毒嗜性和毒力的重要因素[4]。
前期研究显示EIAVDLV121的LTR存在多种变异体[5],为详细了解疫苗株LTR多样性形成过程及LTR与病毒细胞嗜性和毒力变化的关系,本研究对EIAVDV117及其在驴白细胞传代过程中的3个中间代次病毒株(第32代次病毒株EIAVDLV32,第62代次病毒株EIAVDLV62和第92代次病毒株EIAVDLV92)的LTR序列进行测定,并与EIAVDLV121比较分析,为进一步探讨EIAV弱毒疫苗致弱机理提供参考。
1 材料和方法
1.1 病毒株 EIAV驴强毒株(EIAVDV116)、驴白细胞弱毒疫苗株(EIAVDLV121)及其经驴白细胞传代致弱过程中第 31代(EIAVDLV31)、61代(EIAVDLV61)和 91代(EIAVDLV91)病毒株均由中国农业科学院哈尔滨兽医研究所慢病毒组保存。
1.2 主要试剂 小量DNA胶回收试剂盒、r Taq DNA Polymerase、pMD18-T载体、限制性内切酶EcoRⅠ和Hin dⅢ等均购自宝生物工程(大连)有限公司;Blood DNA Kit(D3392-01)购自OMEGA公司;无血清巨噬细胞培养液购自GIBCO BRL公司。
1.3 引物设计 根据本实验室测定的EIAV全基因组序列(AF327878)设计扩增完整LTR的引物LTR-L(5'-TGTGGGAATATAAGATTCT-3')和LTR-R(5'-TGT TAGATCTTGAAAACAAGAC-3'),预计扩增片段320 bp,由宝生物工程(大连)有限公司合成。
1.4 病毒制备及核酸的提取 含有EIAVDV116的驴血浆经颈静脉接种健康马,于病毒血症期间采集抗凝血,分离白细胞。按照Blood DNA Kit说明书提取细胞基因组DNA。按文献[6]方法培养原代驴白细胞,分别接种1m LEIAVDLV31、EIAVDLV61和EIAVDLV91驴白细胞,用100%成牛血清37℃培养,待细胞病变时收获细胞,提取细胞基因组DNA。
1.5 PCR扩增与克隆 分别以提取的含有各病毒株前病毒DNA的细胞基因组为模板,采用引物LTR-L和LTR-R进行PCR扩增。PCR反应体系为25μL。反应程序为94℃5m in;94℃30s、56℃30s、72℃ 30s,30个循环;72℃ 5min。将纯化的PCR产物与pMD18-T载体连接,产物转化DH5α感受态细胞。通过EcoRⅠ和Hin dⅢ酶切筛选阳性重组质粒,并由上海生工生物工程技术服务有限公司测序。利用DNAStar、Clustalx和MEGA等生物学软件对各重组质粒的外源片段LTR序列进行对比分析。
2 结 果
2.1 LTR序列变异分析 本研究获得了含有EIAVDV117、EIAVDLV32、EIAVDLV62和 EIAVDLV92LTR 的克隆各19、19、20和21个,LTR序列分别表示为LTRDV、LTR32、LTR62和 LTR92。 与 21个 EIAVDLV121的 LTR[6](LTR121)(EU267907~EU267927)序列进行对比分析,结果显示,在体外传代过程中,EIAV LTR的变异主要集中在U3区和R区,包括点突变、插入突变和缺失突变等多种形式,LTR的长度范围为305bp~339bp,其主要突变位点见图1所示。插入/缺失主要集中在U3区以及243bp处核苷酸A的缺失。根据U3区插入/缺失的不同组合,可大致将LTR分为5种类型:Ⅰ型,即标准型;Ⅱ型,在负调节区有11个核苷酸的缺失;Ⅲ型,在负调节区有17bp重复序列(AGTTGCTGATGCTCTCA)的插入和11个核苷酸的缺失;Ⅳ型,在增强子区有一个16bp重复序列(ATAGTTCCGCTTTTGT)的插入;Ⅴ型,在负调节区有同上17bp重复序列的插入和11个核苷酸的缺失,同时在增强子区有同上16bp重复序列的插入。各种类型的LTR在不同代次病毒株所占比例不同,强毒株LTRDV和LTR32所有序列均属于Ⅰ型;而LTR62以Ⅰ型为主,只有4个克隆属于Ⅱ型;LTR92则以Ⅱ型为主,4个克隆属于Ⅰ型,1个克隆属于Ⅲ型;而LTR121有4个克隆属于Ⅰ型,1个属于Ⅱ型,6个属于Ⅲ型,3个属于Ⅳ型,7个属于Ⅴ型。
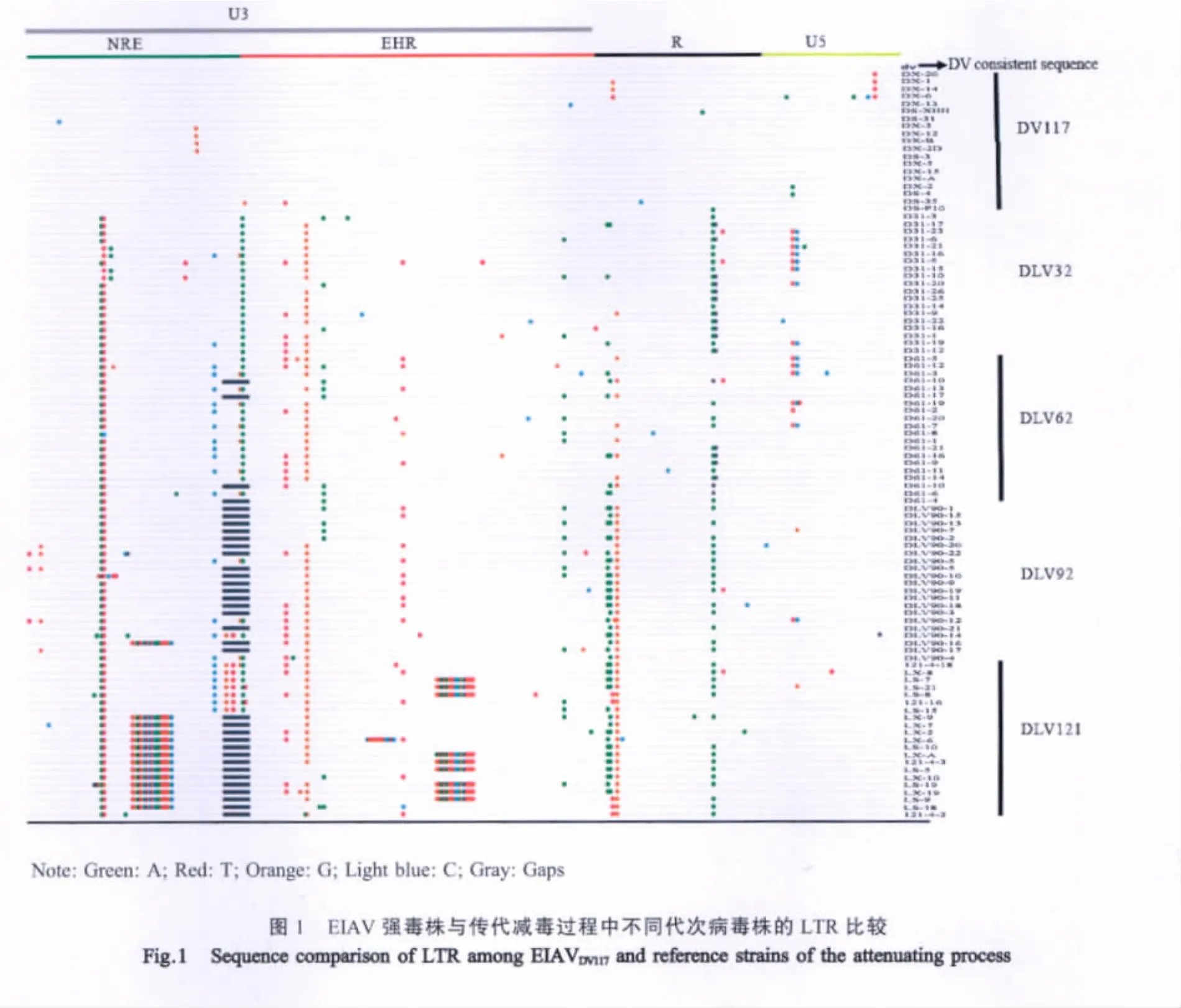
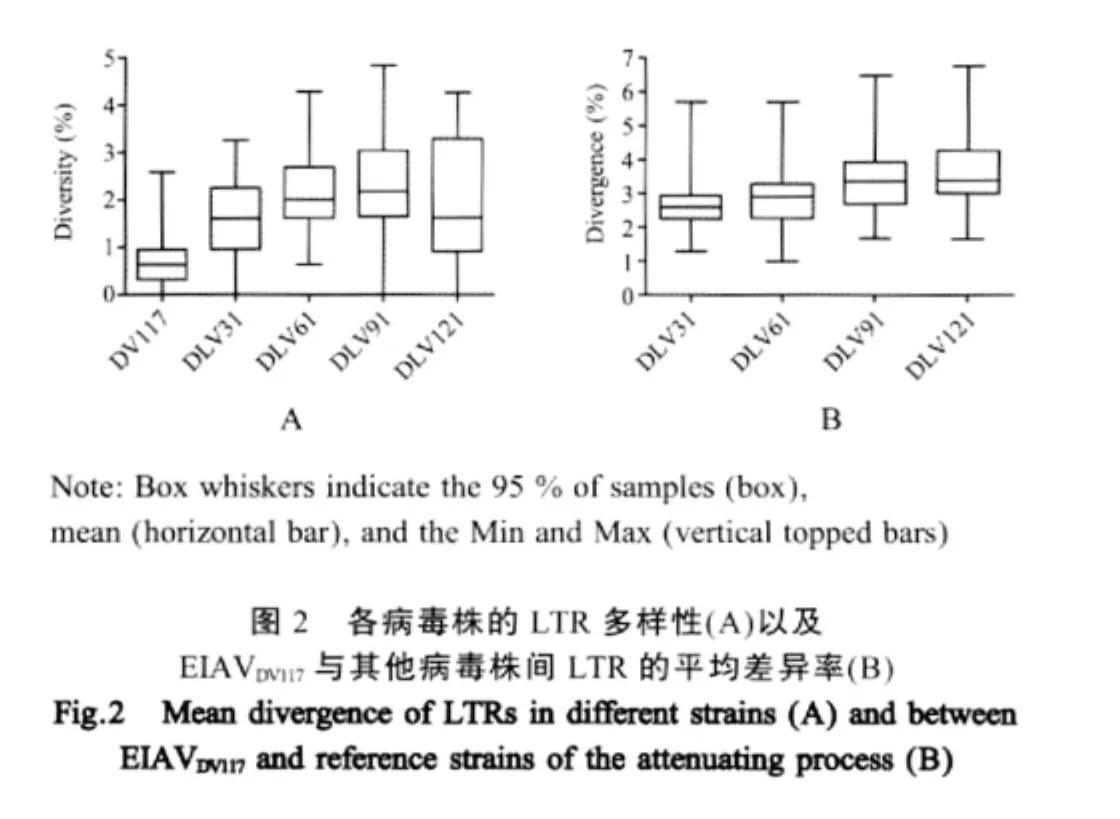
LTRDV长317bp,各克隆间的平均多样性为0.7%(图 2A)。LTR32长 316bp~317bp,各克隆间的平均多样性为1.65%,与LTRDV的差异为1.28%~5.7%,平均为2.72%(图2B)。LTR62长305bp~317bp,各克隆间的平均多样性为2.17%,与LTRDV的差异在0.99%~5.7%之间,平均差异为2.87%。LTR92长305bp~323bp,各克隆间的平均多样性为2.27%,与LTRDV的差异为1.67%~6.49%,平均差异为3.41%。LTR121长306bp~339bp,各克隆间的平均多样性为2.02%,与LTRDV的差异在1.66%~6.77%之间,平均为3.57%。
另外,LTR转录起始位点和Tat激活区(TAR)随传代次数增加而发生明显变异。LTRDV、LTR32和LTR62的转录起始位点主要为GGAC,TAR的起始碱基主要为A;而LTR92和LTR121的转录起始位点以AAAC为主,还包括GAAC、GGTC、GGAC和AGAC等多种形式,TAR的起始碱基全部为G。
2.2 LTR中细胞转录因子结合位点的变化 插入、缺失和点突变使得各病毒株LTR中细胞转录因子结合位点的数量和种类发生改变(表1)。LTRDV在增强子区有3个PU.1基序(GTTCt/cTTCC),2个AP-1基序和1个TBP基序;这些细胞转录因子结合位点在其他病毒株中均稳定存在,而LTR121有10个克隆存在 4个PU.1结合位点。LTRDV在负调节区存在1个GATA基序,体外适应病毒株均丢失了该基序;19个LTRDV克隆中有1个克隆存在MDBP(methylation dependent binding protein)结合位点,体外适应病毒株具有该结合位点的克隆数有所增加,在LTR32、LTR62、LTR92和LTR121分别有5个、8个、8个和7个。同时,体外适应病毒株多数序列在增强子区存在转录调节因子bHLH作用的序列E-box(CANNTG),而LTRDV中未发现该位点。LTR62、LTR92和LTR121在负调节区出现了AP-1结合位点,并有随着传代次数的增加而逐渐增加的趋势,20个LTR62克隆中有4个存在AP-1结合位点;21个LTR92克隆有17个存在AP-1结合位点;21个LTR121克隆中有19个存在AP-1结合位点,还有2个存在2个AP-1结合位点的克隆。
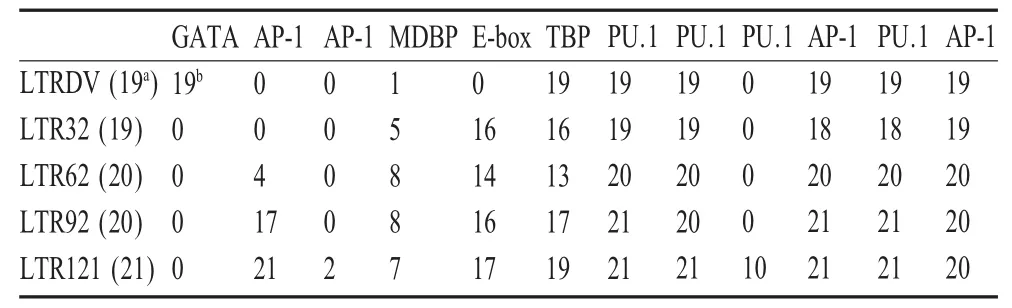
表1 不同代次病毒株LTR中细胞转录因子结合位点的数目*Table 1Transcription factor binding motifs of LTR various strains
2.3 EIAV传代过程中LTR的进化分析 以EIAVDV117、EIAVDLV32、EIAVDLV62、EIAVDLV92和 EIAVDLV121的LTR共100个序列构建进化树(图3)。结果显示:LTRDV与驴白细胞传代病毒株分别处于两个分支上,而各传代病毒株LTR32、LTR62、LTR92和LTR121相互交叉形成不同的分支。其中,来自仍保持强毒致病性的LTR32和LTR62的多数克隆集中在同一个分支内(以黑色符号表示),中间混有LTR92和LTR121的部分克隆序列;而来自丧失了驴体和马体致病性的LTR92和LTR121则更多地集中在另一个分支(以白色符号表示),个别LTR32和LTR62克隆出现在该分支内。
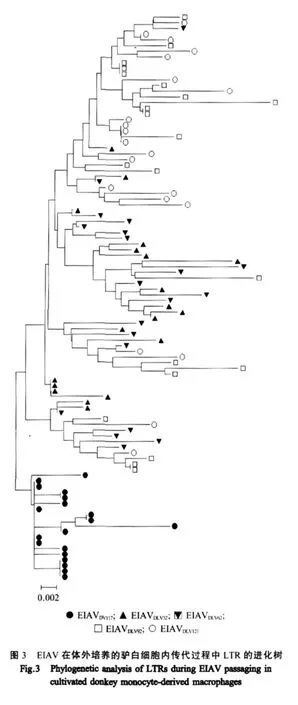
3 讨 论
EIAVDLV121是由EIAVDV117长期在体外培养的驴白细胞(主要是外周血单核细胞来源的巨噬细胞)培养驯化而成的,随着继代代次的增加,EIAVDV117逐渐适应在驴白细胞中增殖[1]。本研究分析了EIAVDLV121在致弱过程中不同代次病毒株LTR的进化特点。由进化树分析可见,EIAVDV117和体外适应株分为两支,这一结果与各病毒株在体外培养的马白细胞中的复制能力一致。序列分析显示,体外适应病毒株在负调节区丢失GATA结合位点,在增强子区出现E-box结合位点,表明这两个位点可能对病毒在体外复制能力有重要影响。Zheng等研究表明,EIAV经长期在体外培养的巨噬细胞中增殖培养后,LTR转录因子结合位点的变化能够提高其体外转录活性[7]。
遗传进化分析显示,体外适应病毒株基因多样性明显高于EIAVDV117,并随着传代次数的增加而逐渐增加,各病毒株与EIAVDV117的差异也逐渐增大。这可能受两个因素的影响:一是巨噬细胞的异质性导致了LTR的异质性[8],巨噬细胞是单核细胞移行进入组织后,受周围环境刺激因素的作用下分化成熟的,巨噬细胞在形态、生物化学、表型和功能等方面具有高度的异质性;二是由于巨噬细胞中dUTPase和dNTP含量较低,病毒在复制过程中更容易发生G→A的突变[9]。而病毒在体外培养过程中缺乏免疫清除功能,所以各种变异体得以保留并在长期体外传代过程中逐渐积累下来。
在EIAVDV117体外驯化过程中,病毒对马、驴的毒力逐渐减弱,在传代到90代以后病毒基本丧失了致病力[1]。序列分析表明:在EIAV毒力减弱过程中各病毒株在LTR负调节区具有AP-1结合基序的克隆所占比例逐渐升高;致病毒株(EIAVDV117、EIAVDLV32和EIAVDLV62)的转录起始位点主要以GGAC为主,弱毒株(EIAVDLV92和EIAVDLV121)存在AAAC等多种形式,仅个别克隆的转录起始位点为GGAC;致病毒株在TAR的起始位点主要为A,而弱毒株主要为G,A→G突变会破坏TAR“茎-环”结构的完整性,这可能影响Tat蛋白与TAR的结合,进而影响反式激活功能。上述变异特点均与病毒毒力的减弱过程相一致,提示这些位点可能与病毒毒力的改变相关。在对猫免疫缺陷病毒的研究中已经发现LTR上细胞转录因子结合位点的变化会改变病毒毒力[10]。多位点的变化也反映了LTR调控机制的复杂性。我们将继续深入研究各细胞转录因子结合位点和转录起始位点及TAR的变化对LTR的体外启动活性的影响,并通过片段替换和点突变检测这些变异对病毒细胞嗜性和病毒毒力变化的作用。
[1]沈荣显,相文华.马传染性贫血病驴白细胞弱毒株的致弱及免疫机理的研究[J].中国兽医学报,2003,23(5):505-510.
[2]Krebs F,Hogan T,Quiterio S,et al.Lentiviral LTR-directed expression,sequence variation,and disease pathogenesis[J].Los Alamos,2001:29-70.
[3]Payne S L,Celle K La,Pei X F,et al.Long terminal repeat sequences of equine infectious anaem ia virus are a major determ inant of cell tropism[J].JGen Virol,1999,80(3):755-759.
[4]Payne S L,Fuller F J.Virulence determ inants of equine infectious anemia virus[J].Curr HIV Res,2010,8(1):66-72.
[5]王雪峰,姜成刚,郭巍,等.马传染性贫血病毒白细胞弱毒疫苗株及其亲本毒驴强毒株前病毒基因组比较分析[J].病毒学报,2008,24(6):443-450.
[6]沈荣显.马传染性贫血病驴白细胞弱毒疫苗的研制与应用[A].国际马传染性贫血病免疫学术讨论会文集,哈尔滨:1983,21-33.
[7]Zheng Y H,Sentsui H,Sugita M,et al.Replication ability in vitro and in vivo of equine infectious anem ia virus avirulent Japanese strain[J].Virology,2000,266(1):129-139.
[8]Gordon S.Macrophage heterogeneity and tissue lipids[J].JClin Invest,2007,117(1):89-93.
[9]Diamond T L,Roshal M,Jamburuthugoda V K,et al.Macrophage tropism of HIV-1depends on efficient cellular dNTP utilization by reverse transcriptase[J].J Biol Chem,2004,279(49):51545-51553.
[10]Bigornia L,Lockridge K M,Sparger E E.Construction and in vitro characterization of attenuated feline immunodeficiency virus long terminal repeat mutant viruses[J].J Virol,2001,75(2):1054-1060.

