基于内质网应激信号通路探讨熄风解痉汤对蛛网膜下腔出血大鼠早期脑损伤保护作用的机制研究
向兴刚 周益凡 依马木·依达依吐拉 赵永 买买江·阿不力孜 林琳

〔摘要〕 目的 观察熄风解痉汤对早期蛛网膜下腔出血(subarachnoid hemorrhage, SAH)大鼠脑组织中内质网应激(endoplasmic reticulum stress,ERS)信号通路相关因子表达的影响,探讨熄风解痉汤对SAH大鼠早期脑损伤(early brain injury, EBI)的保护作用机制。方法 选取成年健康雄性SD大鼠168只,采用血管内穿刺法建立SAH模型,造模成功后按照随机数字表法分为对照组(等体积蒸馏水)、假手术组(等体积蒸馏水)、模型组(等体积蒸馏水)、尼莫地平组[10 mg/(kg·d)]、熄风解痉汤低剂量组[10.8 g/(kg·d)、熄风解痉汤高剂量组[43.2 g/(kg·d)]、尼莫地平[10 mg/(kg·d)]+熄风解痉汤[21.6 g/(kg·d)]组,每组24只,每12 h给药1次,连续用药72 h。采用Garcia神经功能评分评估神经功能受损程度;HE染色观察海马区神经细胞形态;TUNEL染色检测大鼠海马组织细胞凋亡情况;Western blot检测内质网应激相关标志物葡萄糖调节蛋白78(glucose regulatory protein 78, GRP78)、C/EBP同源蛋白(C/EBP homologous protein, CHOP)、胱天蛋白酶-12(cysteine aspartic acid specific protease-12, Caspase-12)蛋白的表达水平;计算脑组织含水量;EB染色检测血脑屏障通透性。结果 与对照组、假手术组比较,模型组海马区组织层次结构不清,各层细胞排列疏松,可见大量凋亡细胞;各时间点的海马区组织神经细胞凋亡比例、脑组织EB含量、脑组织含水量及 GRP78、CHOP、Caspase-12蛋白表达水平升高(P<0.05),Garcia神经功能评分减低(P<0.05)。与模型组比较,熄风解痉汤低、高剂量组大鼠海马区组织结构较模型组清晰,细胞凋亡数量减少;各时间点的海马区组织神经细胞凋亡比例、脑组织含水量及 GRP78、CHOP、Caspase-12蛋白表达水平降低(P<0.05),Garcia神经功能评分、脑组织EB含量升高(P<0.05)。结论 SAH后EBI过程中存在内质网应激反应,熄风解痉汤可降低内质网应激相关蛋白GRP78、CHOP、Caspase-12表达水平,提高EBI过程中大鼠的神经行为学评分,降低脑组织含水量,降低血脑屏障通透性。
〔关键词〕 熄风解痉汤;蛛网膜下腔出血;早期脑损伤;内质网应激信号通路;内质网应激相关蛋白
〔中图分类号〕R256 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.06.001
Mechanism of protective effects of Xifeng Jiejing Decoction on early brain injury in rats with subarachnoid hemorrhage based on endoplasmic reticulum stress signaling pathway
XIANG Xinggang, ZHOU Yifan, YIMAMU Yidayitula, ZHAO Yong, MAIMAIJIANG Abulizi, LIN Lin*
Traditional Chinese Medical Hospital of Xinjiang Uygur Autonomous Region, Urumqi, Xinjiang 830000, China
〔Abstract〕 Objective To observe the effects of Xifeng Jiejing Decoction (XFJJD) on the expression of endoplasmic reticulum stress (ER stress) signaling pathway-related factors in the brain tissue of rats with early subarachnoid hemorrhage (SAH), and to explore the protective mechanism of XFJJD on early brain injury (EBI) in SAH rats. Methods A total of 168 healthy adult male SD rats were selected to establish the SAH model by intravascular puncture. After successful modeling, the rats were divided into control group (an equal volume of distilled water), sham-operated group (an equal volume of distilled water), model group (an equal volume of distilled water), nimodipine group [10 mg/(kg·d)], and low-dose XFJJD [10.8 g/(kg·d)], high-dose XFJJD group [43.2 g/(kg·d)], and nimodipine [10 mg/(kg·d)]+XFJJD group [21.6 g/(kg·d)] by random number table method, with 24 rats in each group. Each group was administered once every 12 h for 72 h continuously. The degree of neurological impairment was assessed by Garcia score; the morphology of hippocampal nerve cells was observed by HE staining; TUNEL staining was performed to determine the apoptosis of hippocampal cells in rats; Western blot was used to check the expression levels of endoplasmic reticulum stress-related markers, including glucose regulatory protein 78 (GRP78), C/EBP homologous protein (CHOP), and cysteine aspartic acid specific protease-12 (cysteine-12); the water content of brain tissue was calculated; EB staining was used to examine the permeability of the blood-brain barrier. Results Compared with the control group and the sham-operated group, the model group exhibited unclear hierarchical structure of the hippocampus, loose arrangement of cells in each layer, and a large number of apoptotic cells; the proportion of apoptosis of hippocampal nerve cells, the EB content and water content of the brain tissue, as well as the protein expression levels of GRP78, CHOP, and Caspase-12 in the hippocampus increased at various time points (P<0.05), while the Garcia score decreased (P<0.05). Compared with the model group, the low- and high-dose XFJJD groups showed clearer hippocampal tissue structure and reduced number of apoptotic cells; the proportion of apoptosis of hippocampal nerve cells, water content of brain tissue, and the protein expression levels of GRP78, CHOP, and Caspase-12 decreased at various time points (P<0.05), while the Garcia score and EB content of brain tissue increased (P<0.05). Conclusion Endoplasmic reticulum stress reaction occurs during the EBI process after SAH. XFJJD can reduce the expression levels of endoplasmic reticulum stress-related proteins including GRP78, CHOP, and Caspase-12, improve neurobehavioral scores of rats during EBI process, lower the water content of brain tissue, and reduce the permeability of blood-brain barrier.
〔Keywords〕 Xifeng Jiejing Decoction; subarachnoid hemorrhage; early brain injury; endoplasmic reticulum stress signaling pathway; endoplasmic reticulum stress-related proteins
蛛网膜下腔出血(subarachnoid hemorrhage, SAH)是指脑底部或脑表面血管破裂后,血液流入蛛网膜下腔引起相应临床症状的一种脑卒中,占所有脑卒中发病的5%~10%,严重危及人类的生命健康[1]。早期脑损伤(early brain injury, EBI)是SAH发病后72 h内大脑发生的一系列变化,包括脑水肿、血脑屏障损伤、炎症反应、氧化应激、神经细胞凋亡等[2-3]。内质网影响细胞内合成和修饰蛋白质,内质网应激(endoplasmic reticulum stress, ERS)在神经退行性疾病、神经炎性疾病的发生和发展过程中起决定性的作用[4]。ERS可造成细胞凋亡[5-6],但其机制尚不明确。葡萄糖调节蛋白78(glucose regulatory protein 78,GRP78)、C/EBP同源蛋白(C/EBP homologous protein,CHOP)、胱天蛋白酶-12(cysteine aspartic acid specific protease-12,Caspase-12)是被公认为内质网应激的标志蛋白,在细胞发生内质网应激时,其表达升高,从而诱导细胞凋亡[7]。
SAH属于中医学“中风”范畴,源于《灵枢·邪气藏府病形》,其病机复杂,以“风、火、痰、瘀、气、虚”为主因,其中以肝肾阴虚为根本,病变涉及心、肝、脾、肾等脏。国医大师沈宝藩教授认为,中风病为肝肾阴亏、肝阳偏亢、气血逆乱所致,治以镇肝息风为主,佐以滋养肝肾为法,在镇肝熄风汤的基础上创制了熄风解痉汤[8]。熄风解痉汤方中怀牛膝引血下行、补益肝肾,为君药;赭石镇肝降逆,龙骨、牡蛎、龟甲、白芍、天麻益阴潜阳、镇肝息风,共为臣药;玄参、天门冬滋阴清热,壮水涵木,肝喜条达而恶抑郁,纯用重镇之品以强制之,影响其条达之性,故用茵陈、川楝子、生麦芽清泄肝热、疏肝理气,川芎行气活血,以利于肝阳的平降镇潜,均为佐药;炙甘草调和诸药,与生麦芽相配,并能和胃调中,防止金石类药物碍胃之弊,为使药。诸药成方,共奏镇肝熄风之效。在前期研究中本课题组发现,熄风解痉汤联合尼莫地平能够有效改善早期SAH患者的脑血流,平衡脑灌注,改善脑血管内皮细胞功能,抑制机体炎症反应,提高患者生活质量,改善预后[9]。
因此,本研究在前期研究的基础上,进一步以内质网应激信号通路及其下游凋亡蛋白为切入点,探讨熄风解痉汤治疗SAH的保护作用机制,为SAH后EBI的治疗提供新思路和靶点。
1 材料与方法
1.1 实验动物
SPF级成年雄性SD大鼠168只,体质量250~300 g,实验动物生产许可证号:SCXK(新)2018-0002,在新疆医科大学动物实验中心饲养2周,严格控制饲养环境,温度(25±1) ℃,湿度保持50%±10%,12 h/12 h循环光照。严格遵守实验室动物保护指导原则进行动物研究,实验设计及流程均经过新疆医科大学实验动物伦理委员会批准,伦理审批号:IACUC-20210725-18。
1.2 主要药物与试剂
熄风解痉汤配伍:怀牛膝30 g、龙骨(先煎)30 g、牡蛎(先煎)30 g、赭石(先煎)20 g、龟甲(先煎) 15 g、白芍15 g、天麻10 g、玄参15 g、天门冬15 g、川楝子9 g、茵陈9 g、生麦芽13 g、川芎10 g、炙甘草9 g。药物均由新疆医科大学附属中医医院制剂室提供,上述药物浸泡1 h,采用自动煎药机煎药,每剂煎煮两次,第一次煎煮30 min,第二次煎煮20 min,滤出合并药液约400 mL,经物理的方法将水煎剂浓缩至含原生药量0.575 g/mL,经120 ℃、400 kPa下消毒25 min,冷却后密封包装,4 ℃保存备用。尼莫地平片(拜耳医药保健有限公司,国药准字H20003010,批号:2109007,规格:30 mg/片)。
TUNEL检测试剂盒(武汉伊莱瑞特生物科技有限公司,批号:E-CK-A331);兔源性Caspase-12抗体、GRP78抗体、CHOP抗体(江苏亲科生物研究中心有限公司,批号:AF51250、AF5366、AF5280);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号:PC0020);HE染色液(湖南艾佳生物科技股份有限公司,批号:P041IR)。
1.3 主要仪器
光学显微镜(德国徕卡仪器有限公司,型号:DM4000);高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H2050R);全自动多功能分析仪[赛默飞世尔科技(中国)有限公司,型号:Triiogy];电泳仪、转膜槽[伯乐生命医学产品(上海)有限公司,型号:1645050、Mini-Trans Blot];PCR仪(杭州朗基科学仪器有限公司,型号:Q2000B);电子天平(上海全福实业有限公司,型号:MS205DU);光凝胶成像分析系统(北京六一生物科技有限公司,型号:WD-9413B)。
1.4 分组、造模及给药
SPF级成年健康雄性SD大鼠168只,适应性饲养2周后按照随机数字表法分为对照组、假手术组、模型组、尼莫地平组、熄风解痉汤低剂量组、熄风解痉汤高剂量组、尼莫地平+熄风解痉汤组,每组24只,并进行编号。除对照组、假手术组外,其余各组进行SAH模型造模。
采用血管内穿刺法建立SAH模型[10]:除对照组外,其余各组通过腹腔注射2.5%戊巴比妥钠溶液麻醉,麻醉成功后仰卧固定至手术板上,75%乙醇消毒颈部皮肤,作颈部正中切口,分离暴露右侧颈部动脉、颈内动脉和颈外动脉,将4-0尼龙线头从颈外动脉残端插入右颈内动脉,直至刺破颈内动脉末端分叉处。假手术组大鼠仅在手术操作过程中将尼龙线头端送至右颈内动脉,但不刺破颈内动脉分叉处[11]。SAH模型肉眼观可见大鼠大脑表面弥散分布积血,其中在脑底动脉环、小脑延髓池及脑干腹侧有大量积血存在;HE染色在蛛网膜下腔见到大量红细胞,以此判定为造模成功[12]。
熄风解痉汤低、高剂量组,尼莫地平+熄风解痉汤组予以不同浓度的熄风解痉汤连续干预3 d,每12 h灌胃1次,给药剂量计算方式参照《中医科研设计与统计学》[13]中实验动物给药方法部分。低剂量组、高剂量组以中剂量组的1/2倍、2倍剂量给药,分别为10.8、43.2 g/(kg·d)[14]。空白组、假手术组、模型组给予等体积蒸馏水灌胃,尼莫地平组予尼莫地平10 mg/(kg·d)灌胃治疗[15],尼莫地平+熄风解痉汤组予尼莫地平10 mg/(kg·d)及熄风解痉汤21.6 g/(kg·d)灌胃治疗实验过程中出现死亡的大鼠予以剔除并根据要求进行补充。
1.5 观察指标
1.5.1 神经功能评分 根据参考文献[6],在造模成功后6、12、24、48、72 h记录各组大鼠Garcia神经功能评分包括自主活动、对称性的四肢活动、前肢伸展活动、攀爬能力、本体感觉、胡须触碰反射。最高18分,最低5分,得分越高,表明大鼠神经功能受损程度越轻。
1.5.2 HE染色观察海马组织形态结构 在造模后72 h,7组大鼠中随机各取1只,麻醉生效后断头、完整取下脑组织。对照组和模型组在10%甲醛溶液中固定至少24 h,组织包埋在石蜡中,切成4 μm的切片,经苏木精初染5 min和伊红复染4 min后,中性树胶封片,行HE染色并在光学显微镜下观察海马组织形态结构。
1.5.3 GRP78、CHOP和Caspase-12蛋白表达水平检测 提取总蛋白,BCA法测定蛋白含量。将裂解物在4 ℃下以12 000 r/min,离心20 min(离心半径8.5 cm),收集上清液,电泳分离蛋白,转膜,按照严格的抗原抗体反应条件,分别添加GRP78、CHOP和Caspase-12一抗,稀释比例分别为1∶1 000、1∶300和1∶300,在4 ℃下孵育过夜。次日,用PBST对PVDF转膜3次、洗涤,孵育,以便在后续的ECL显色反应中能够检测到目标蛋白。
1.5.4 血脑屏障通透性检测 采用EB染色评估血脑屏障在SAH后的通透性变化[14]。将2% Evans染料(4 mL/kg)经右侧股静脉缓慢注射,持续约2 min以上。1 h后用5%水合氯醛(7 mL/kg)将大鼠麻醉,经心脏持续灌注0.9%氯化钠溶液以去除血液中的Evans染料,灌注完成后断头取脑,在PBS缓冲液(pH 7.4)中放入脑组织,制备成匀浆,冷却后以12 000 r/min离心20 min(离心半径8.5 cm)。使用分光光度计测量上清液在620 nm处Evans染料的吸光度值。EB含量越高提示血脑屏障破坏、其通透性增加。
1.5.5 脑组织含水量检测 造模成功后3、6、12、24、48、72 h检测大鼠脑组织含水量。水合氯醛麻醉大鼠,头部切断,取出脑组织,并进行称量以获取湿重数据。每个脑组织样本放置在100 ℃的烘箱中烘干7 h后,再次进行称量,可以得到脑组织样本的干重。最后,计算脑组织的含水量=(湿重-干重)/湿重×100%。
1.5.6 大鼠海马组织细胞凋亡检测 剥离各组大鼠海马组织,生理盐水冲洗,4%多聚甲醛固定,石蜡包埋,切片(厚度5 μm),严格按照TUNEL凋亡试剂盒说明书标记海马组织中的凋亡细胞,在显微镜下观察和收集图像,并为每个切片随机选择5个视野计算神经细胞的凋亡率[16]。
1.6 统计学分析
采用SPSS 26.0统计软件进行统计学分析。符合正态分布的计量资料以“x±s”表示,采用t检验;非正态分布的计量数据,采用Wilcoxon秩和检验;计数资料采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠Garcia神经功能评分比较
与对照组、假手术组比较,其余各组各时间点的Garcia神经功能评分均降低(P<0.05);与模型组比较,用药组各时间点的Garcia神经功能评分均升高(P<0.05);与尼莫地平组比较,熄风解痉汤低、高剂量组在24、48、72 h的Garcia神经功能评分均降低(P<0.05),尼莫地平+熄风解痉汤组在12、24、48、72 h的Garcia神经功能评分均升高(P<0.05);与熄风解痉汤低、高剂量组比较,尼莫地平+熄风解痉汤组12、24、48、72 h的Garcia神经功能评分均升高(P<0.05)。详见表1。
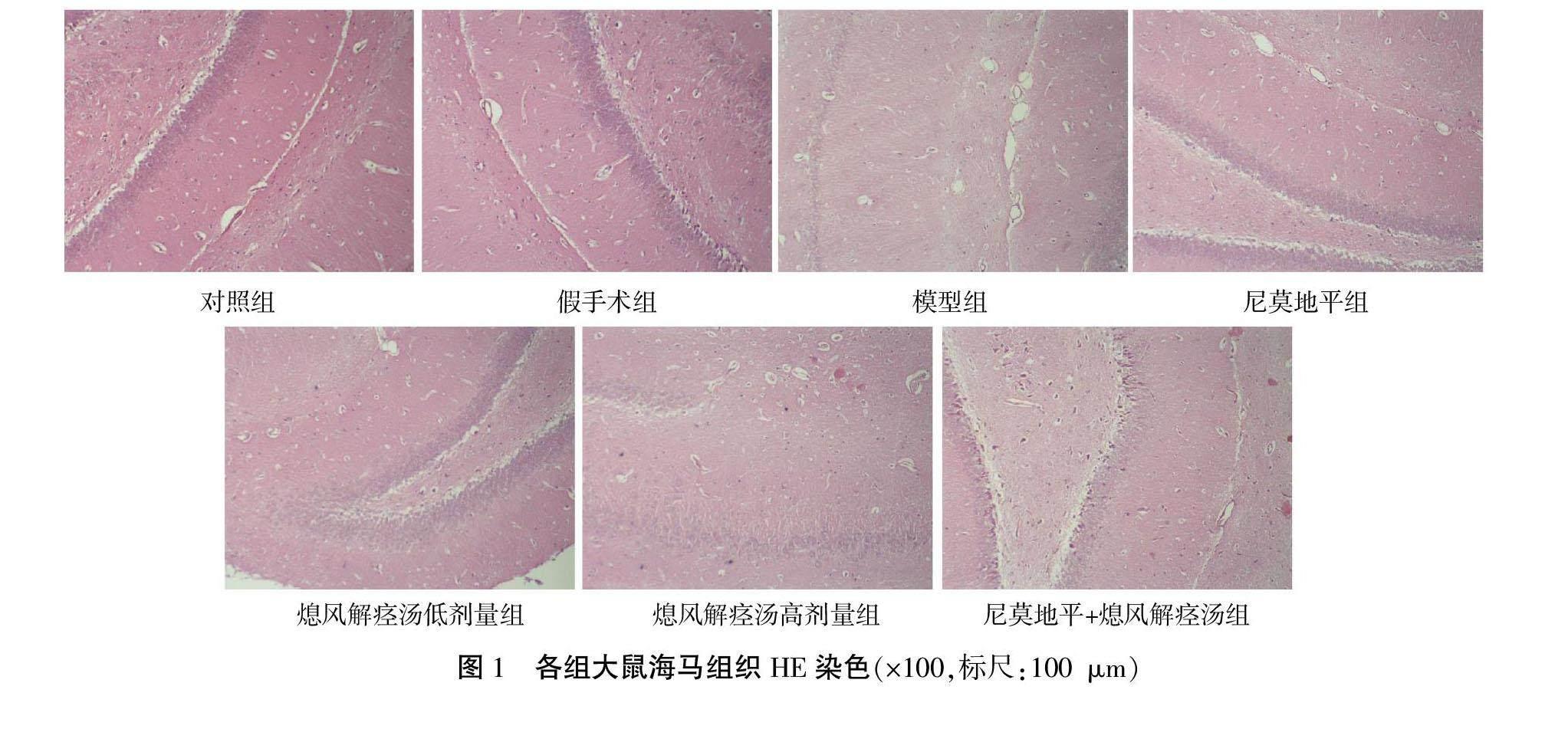
2.2 各组大鼠海马区组织结构比较
对照组、假手术组大鼠海马区组织各层结构清晰,细胞连续,细胞核数量正常;模型组海马区组织各层紊乱变性;尼莫地平组大鼠海马区组织各层结构紊乱,细胞连续性、细胞核数量优于模型组;熄风解痉汤低、高剂量组大鼠海马区组织结构较模型组清晰;尼莫地平+熄风解痉汤组大鼠海马区组织结构较清晰,明显优于模型组、尼莫地平组及熄风解痉汤低、高剂量组。详见图1。
2.3 各组大鼠脑组织细胞中GRP78、CHOP和Caspase-12表达水平比较
与对照组、假手术组比较,模型组、尼莫地平+熄风解痉汤组和熄风解痉汤低、高剂量组在各时间点的GRP78、CHOP蛋白表达水平升高(P<0.05);与对照组、假手术组比较,尼莫地平组在3、6、12、24、48 h时GRP78、CHOP蛋白表达水平升高(P<0.05);72 h时,尼莫地平组GRP78蛋白表达水平高于对照组(P<0.05),低于假手术组(P<0.05),CHOP蛋白表达水平低于对照组(P<0.05),高于假手术组(P<0.05)。与对照组、假手术组比较,模型组、尼莫地平组和熄风解痉汤低、高剂量组在各时间点的Caspase-12蛋白表达水平升高(P<0.05);尼莫地平+熄风解痉汤组在3、6、12 h时Caspase-12蛋白表达水平升高(P<0.05),在24、48、72 h时Caspase-12蛋白表达水平降低(P<0.05)。与模型组比较,用药组各时间点的GRP78、CHOP、Caspase-12蛋白表达水平降低(P<0.05)。与尼莫地平组比较,熄风解痉汤低、高剂量组在6、12、24、48、72 h时GRP78、CHOP、Caspase-12蛋白表达升高(P<0.05);尼莫地平+熄风解痉汤组GRP78、CHOP蛋白在6、12、24、48 h的表达水平降低(P<0.05),72 h时升高(P<0.05),Caspase-12在6、12、24、48、72 h的表达水平降低(P<0.05)。与熄风解痉汤低剂量组比较,熄风解痉汤高剂量组在6、12、24、48 h时Caspase-12蛋白表达水平降低(P<0.05)。与熄风解痉汤低、高剂量组比较,尼莫地平+熄风解痉汤组在6、12、24、48、72 h时GRP78、CHOP、Caspase-12蛋白表达水平降低(P<0.05)。详见表2—4,图4。
2.4 各组大鼠脑组织血脑屏障通透性比较
与对照组比较,其余各组各时间点脑组织EB含量均升高(P<0.05);与假手术组比较,模型组和用药组各时间点脑组织EB含量均升高(P<0.05);与模型组比较,用药组各时间点脑组织EB含量均升高(P<0.05);与尼莫地平组比较,在6、12、24、48、72 h,熄风解痉汤低、高剂量组脑组织EB含量均降低(P<0.05),尼莫地平+熄风解痉汤组脑组织EB含量均升高(P<0.05);与熄风解痉汤低、高剂量组比较,在6、12、24、48、72 h,尼莫地平+熄风解痉汤组脑组织EB含量均升高(P<0.05)。详见表5。
2.5 各组大鼠脑组织含水量比较
与对照组、假手术组比较,模型组、尼莫地平组和熄风解痉汤低、高剂量组在各时间点脑组织含水量均升高(P<0.05);尼莫地平+熄风解痉汤组在3、6 h脑组织含水量升高(P<0.05),24 h脑组织含水量降低(P<0.05)。与对照组比较,尼莫地平+熄风解痉汤组在48、72 h脑组织含水量升高(P<0.05)。与假手术组比较,尼莫地平+熄风解痉汤组在12、48、72 h脑组织含水量降低(P<0.05)。与模型组比较,用药组各时间点脑组织含水量均降低(P<0.05)。与尼莫地平组比较,熄风解痉汤低、高剂量组各时间点脑组织含水量均升高(P<0.05),尼莫地平+熄风解痉汤组在6、12、24、48、72 h时脑组织含水量均降低(P<0.05)。与熄风解痉汤低、高剂量组比较,尼莫地平+熄风解痉汤组各时间点脑组织含水量均降低(P<0.05)。详见表6。
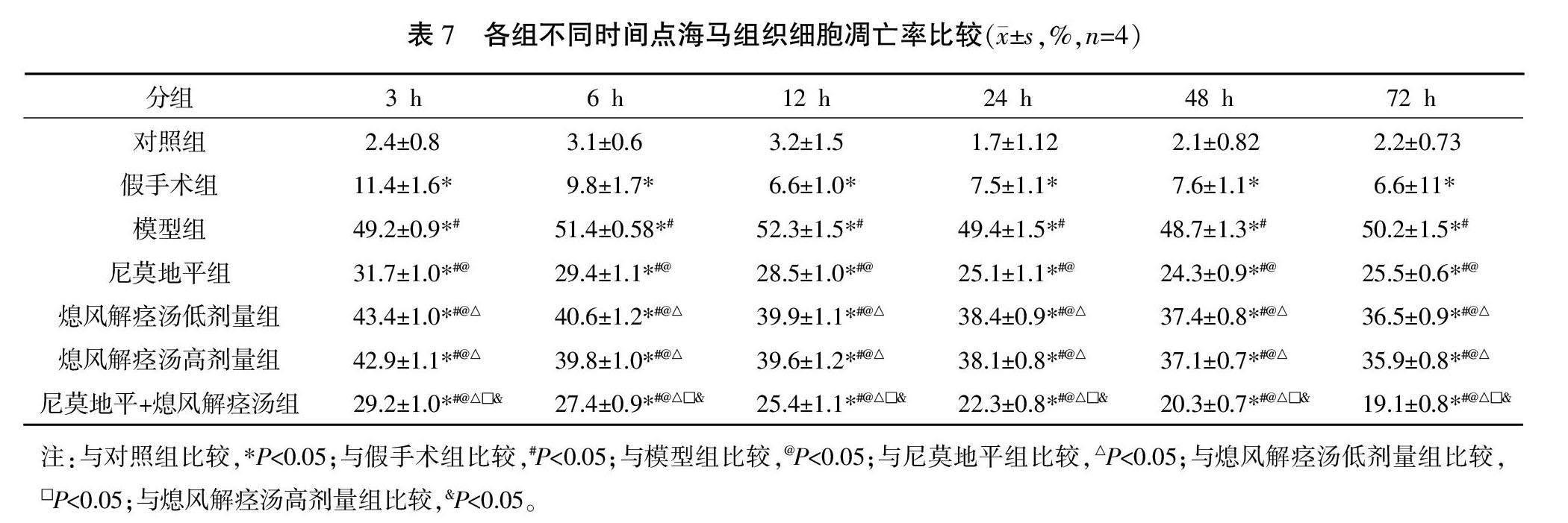
2.6 各组大鼠海马组织细胞凋亡情况比较
对照组、假手术组大鼠海马组织细胞未见凋亡,模型组大鼠海马区组织细胞可见大量细胞凋亡,呈棕褐色;尼莫地平组及熄风解痉汤低、高剂量组大鼠海马区组织细胞凋亡数高于对照组,较模型组有所减少;尼莫地平+熄风解痉汤组大鼠海马区神经细胞凋亡数较模型组明显减少。详见图3。
与对照组比较,其余各组各时间点海马组织细胞凋亡率均升高(P<0.05);与假手术组比较,模型组与用药组各时间点海马组织细胞凋亡率均升高(P<0.05);与模型组比较,用药组各时间点海马组织细胞凋亡率均降低(P<0.05);与尼莫地平组比较,熄风解痉汤低、高剂量组各时间点海马组织细胞凋亡率均升高(P<0.05),尼莫地平+熄风解痉汤组各时间点海马组织细胞凋亡率均降低(P<0.05);与熄风解痉汤低、高剂量组比较,尼莫地平+熄风解痉汤组各时间点海马组织细胞凋亡率均降低(P<0.05)。详见表7。
3 讨论
SAH是神经外科常见病、多发病,具有致死率高、致残率高、患者预后差等特点,影响SAH预后的主要原因是脑血管痉挛和EBI。临床研究表明,EBI是影响SAH患者预后的主要原因,临床特点是缺氧缺血性脑损伤,病理生理学过程包括炎症、线粒体功能障碍、细胞调亡等[17],而细胞主要启动ERS。研究发现,ERS涉及多个信号通路的激活,包括未折叠蛋白反应、内质网反应超负荷以及Caspase-12和CHOP介导的细胞凋亡通路[18]。ERS诱导GRP78、GRP94等内质网因子表达上调,增强内质网的蛋白折叠能力,产生保护细胞的能力[19]。当应激持续存在或过于强烈时,ERS也能触发内源性细胞凋亡机制,通过激活特定的凋亡通路,如Caspase-12和CHOP通路,来诱导细胞凋亡[20]。研究发现,当ERS发生时,GRP78、CHOP、Caspase-12作为ERS的标志蛋白,均有明显增加的趋势[21]。
本研究结果显示,与模型组比较,尼莫地平组、熄风解痉汤低剂量组、熄风解痉汤高剂量组、尼莫地平+熄风解痉汤组各组脑组织含水量下降,EB含量均升高。Evans蓝进入血管后与蛋白结合,正常状态下不透过血脑屏障,当血脑屏障通透性升高时EB含量升高[22]。脑水肿发生的主要原因是血脑屏障破坏。本研究结果显示,模型组血脑屏障破坏,通透性增加,造成脑水肿,提示尼莫地平和熄风解痉汤可以保护血脑屏障的完整,可减轻脑损伤,这可能为SAH的治疗提供方向。血脑屏障主要由内皮细胞、星形胶质细胞、基底膜等组成,是脑内毛细血管内皮细胞彼此紧密连接,同时与周围的周细胞、星形胶质细胞等相互作用而形成的屏障系统,其中内皮细胞及其紧密连接是决定血脑屏障通透性的关键屏障,当内皮细胞紧密连接遭到破坏后会导致血脑屏障破坏,进而损伤中枢神经系统[23]。以往相关研究证实,SAH后会引起脑细胞凋亡,造成血脑屏障破坏[24]。本研究TUNEL染色结果显示,模型组海马组织细胞大量凋亡,而经尼莫地平+熄风解痉汤组干预后海马组织细胞凋亡率降低,表明尼莫地平+熄风解痉汤组可降低海马组织细胞凋亡率,进而保护脑组织。根据本次研究结果,模型组大鼠海马组织内质网应激相关蛋白CHOP、GRP78、Caspase-12表达升高,而熄风解痉汤低、高剂量组以及尼莫地平+熄风解痉汤组大鼠海马组织内质网应激相关蛋白表达降低,说明熄风解痉汤可通过抑制内质网应激诱导的神经元凋亡,从而改善EBI。
综上所述,SAH后大鼠存在ER介导的细胞凋亡,熄风解痉汤能显著减少ERS的发生,从而减少ER介导的细胞凋亡,降低SAH后大鼠血脑屏障通透性,降低脑组织含水量和海马组织细胞凋亡,改善SAH后大鼠的神经功能评分和预后。为SAH后EBI的治疗提供新思路和靶点,有利于开展临床转化研究。
参考文献
[1] HOH B L, KO N U, AMIN-HANJANI S, et al. 2023 guideline for the management of patients with aneurysmal subarachnoid hemorrhage: A guideline from the American heart association/american stroke association[J]. Stroke, 2023, 54(7): e314-e370.
[2] QI M, JIANG L D, XU Y Q, et al. Risk factors for prognosis in elderly patients with severe aneurysmal subarachnoid hemor?鄄rhage: A retrospective study[J]. Advances in Therapy, 2021, 38(1): 249-257.
[3] CHEN Y, LIAN B Q, PENG L, et al. Neutrophil to lymphocyte ratio is a prognosis factor for post-operative pneumonia in aneurysmal subarachnoid hemorrhage patients[J]. Chinese Medical Journal, 2020, 134(6): 682-689.
[4] 韩雨薇, 梁国标, 李晓明. 虎杖苷通过抑制内质网应激改善蛛网膜下腔出血后早期脑损伤[J]. 中华实验外科杂志, 2023, 40(9): 1720-1722.
[5] 何天目, 陈 宽, 熊丽娟, 等. 内质网应激、自噬与凋亡在斑蝥素致大鼠肝毒性中的作用[J]. 中国现代应用药学, 2024, 41(2): 156-165.
[6] 韩雨薇, 陈立刚, 李晓明, 等. 冬凌草素对蛛网膜下腔出血后早期脑损伤作用机制研究[J]. 临床军医杂志, 2022, 50(1): 5-8, 13.
[7] 刘 胜, 李明昌. 蛛网膜下腔出血的脑损伤机制及相关生物标志物研究进展[J]. 国际神经病学神经外科学杂志, 2023, 50(3): 51-59.
[8] 方邦江, 安冬青, 沈桢巍. 国医大师沈宝藩治疗疑难危急重症经验集[M]. 北京: 中国中医药出版社, 2022: 144-150.
[9] 向兴刚, 依马木·依达依吐拉, 周益凡, 等. 中西医结合治疗动脉瘤性蛛网膜下腔出血后早期脑损伤的临床疗效[J]. 中西医结合心脑血管病杂志, 2021, 19(8): 1395-1398.
[10] 张贵强, 许文锋, 杨和平. DKK-1抑制剂对大鼠蛛网膜下腔出血后脑水肿影响的研究[J]. 系统医学, 2023, 8(15): 38-41.
[11] 王楠斐, 胡 圆, 陈飞军, 等. 百合总皂苷对大鼠蛛网膜下腔出血后早期脑损伤的保护作用及PPARγ/NF-κB通路的影响[J]. 中国老年学杂志, 2023, 43(11): 2758-2762.
[12] 魏艳娜, 王锋存, 马香莲, 等. 基于磷脂酰肌醇-3激酶/蛋白激酶B/核因子κB通路探讨高原缺氧对大鼠蛛网膜下腔出血后血脑屏障的作用[J]. 解剖学报, 2023, 54(2): 156-164.
[13] 贺石林, 王 键, 王净净. 中医科研设计与统计学[M]. 长沙: 湖南科学技术出版社, 2005: 48-49.
[14] 崔昕龙, 张恒海, 田首元. 基于NF-κB/ICAM-1信号通路探究miR-223-3p对大鼠蛛网膜下腔出血早期脑损伤的影响[J]. 卒中与神经疾病, 2023, 30(5): 497-505.
[15] 姜燕强, 段国华, 陈利平, 等. 穿心莲内酯通过Nrf2/HO-1通路对脑出血大鼠血-脑脊液屏障的保护作用[J]. 医学研究杂志, 2023, 52(7): 92-96.
[16] 熊 建, 屈战利, 任 瑜, 等. 灵仙新苷对脑缺血再灌注损伤大鼠脑组织氧化应激和炎症反应的调控及神经细胞凋亡的影响[J]. 湖南中医药大学学报, 2024, 44(4): 551-556.
[17] 李亚鹏, 李 琴, 李 莉, 等. 水苏碱调节Hippo-YAP信号通路对新生大鼠缺氧缺血性脑损伤的神经保护作用[J]. 湖南中医药大学学报, 2024, 44(2): 213-219.
[18] XIA H F, GE Y Y, WANG F Q, et al. Protectin DX ameliorates inflammation in sepsis-induced acute lung injury through mediating PPARγ/NF-κB pathway[J]. Immunologic Research, 2020, 68(5): 280-288.
[19] 张兴海, 左 楠, 周 南, 等. β-羟丁酸介导PERK/eIF2/ATF4信号通路抑制内质网应激保护大鼠蛛网膜下腔出血后早期脑损伤[J]. 解剖科学进展, 2022, 28(2): 132-135, 140.
[20] 韩雨薇, 王晨辰, 梁国标, 等. Galectin-3对蛛网膜下腔出血后早期脑损伤的影响[J]. 转化医学杂志, 2022, 11(4): 214-217.
[21] 韩雨薇, 王晨辰, 梁国标, 等. 柚皮苷通过抑制氧化应激和细胞凋亡减轻蛛网膜下腔出血大鼠早期脑损伤的研究[J]. 中华实验外科杂志, 2022, 39(4): 669-671.
[22] 廖忆思, 黄加尚, 谢延风, 等. 蛛网膜下腔出血后早期脑损伤中ROS和PDGFR活化的研究[J]. 陆军军医大学学报, 2022, 44(12): 1243-1248.
[23] 雷华娟, 田丰铭, 易 健, 等. 养阴宁神方对去势小鼠海马神经元突触的可塑性调节[J]. 湖南中医药大学学报, 2024, 44(1): 30-37.
[24] 艾奇渊, 王 勇, 徐瑞春, 等. 苦荞黄酮提取物通过抑制NF-κB信号通路减轻蛛网膜下腔出血模型大鼠神经炎症和氧化应激[J]. 中国免疫学杂志, 2023, 39(10): 2132-2137.

