基于转录组学探讨当归芍药散对db/db小鼠肾脏保护作用的潜在机制
黄秋晴 黎柳 李鸿 谭丹妮 喻嵘

〔摘要〕 目的 基于转录组学和实验验证探究当归芍药散对db/db糖尿病肾病小鼠肾脏的保护机制。方法 25只8周龄造模成功的db/db小鼠按体质量随机均分为模型组(20 mL/kg蒸馏水)、达格列净组(1.3 mg/kg)、当归芍药散低剂量组(8.39 g/kg)、当归芍药散中剂量组(16.77 g/kg)、当归芍药散高剂量组(33.54 g/kg),每组5只;另选5只同龄db/m小鼠作为空白组(20 mL/kg蒸馏水)。每组灌胃1次/d,连续6周。给药结束后,检测各组小鼠体质量、空腹血糖(fasting blood glucose, FBG)、口服糖耐量试验(oral glucose tolerance test, OGTT)的曲线下面积(area under thecurve, AUC);采用全自动生化分析仪检测尿白蛋白肌酐比值(urea albumin creatinine ratio, UACR)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC);采用肌酐比色法检测血肌酐(serum creatinine, Scr);采用尿素比色法检测小鼠血尿素氮(blood urea nitrogen, BUN);采用HE染色观察肾脏组织病理形态;采用转录组学芯片技术检测小鼠肾组织差异基因,并对当归芍药散中剂量组差异基因进行KEGG富集分析;采用RT-PCR法检测表达量TPM>10的核心基因在肾脏组织中的mRNA表达水平。结果 与空白组比较,模型组小鼠体质量、OGTT-AUC、FBG、UACR、Scr、BUN、TG、TC显著升高(P<0.01)。与模型组相比,达格列净组、当归芍药散各剂量组小鼠体质量、OGTT-AUC、FBG、UACR、Scr、BUN、TG、TC均降低(P<0.05,P<0.01)。与空白组相比,模型组共筛选出1 129个差异基因,其中上调差异基因337个、下调差异基因792个。与模型组相比,当归芍药散共筛选出271个差异基因,其中上调差异基因195个、下调差异基因76个。空白组、模型组、当归芍药散中剂量组三组差异共表达基因57个,其中TPM>10的核心基因共12个,包括Gsta2、Cyp4a12a、Slc8a1、Abcc4、Cpeb4、Serpina1b、Npl、Aacs、Kap、Slc5a10、Tmem252、Ifi27l2a。12个核心基因的mRNA表达水平与转录组测序趋势相同。与模型组比较,当归芍药散中剂量组小鼠Gsta2、Abcc4、Slc8a1、NPL mRNA表达水平升高(P<0.05,P<0.01),Slc5a10、Tmem252 mRNA表达水平下降(P<0.05)。当归芍药散中剂量组差异基因富集于药物代谢-细胞色素P450、谷胱甘肽代谢、活性氧等相关通路。结论 当归芍药散具有改善糖尿病肾病预后的作用,其机制可能与调控Gsta2、Slc5a10、Abcc4、Slc8a1、Tmem252、Npl等基因表达,调控细胞色素P450、谷胱甘肽代谢、活性氧等信号通路相关。
〔关键词〕 当归芍药散;db/db小鼠;糖尿病肾病;转录组学;差异表达基因;活血利水
〔中图分类号〕R256.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.06.006
Potential mechanism of Danggui Shaoyao Powder on renal protection in
db/db mice based on transcriptomics
HUANG Qiuqing, LI Liu, LI Hong, TAN Danni, YU Rong*
Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To explore the renal protective mechanism of Danggui Shaoyao Powder (DGSYP) on diabetic nephropathy in db/db mice through transcriptomics and experimental verification. Methods A total of 25 eight-week-old db/db mice were randomized into model group (20 mL/kg distilled water), dapagliflozin group (1.3 mg/kg), low-dose DGSYP group (8.39 g/kg), medium-dose DGSYP group (16.77 g/kg), and high-dose DGSYP group (33.54 g/kg), with five mice in each group. Another five db/m mice of the same age were set as blank group (20 mL/kg distilled water), and each group was intragastrically administered once a day for six consecutive weeks. After administration, the body weight, fasting blood glucose (FBG), and area under the curve (AUC) of the oral glucose tolerance test (OGTT) were measured. Urine albumin creatinine ratio (UACR), triglyceride (TG), and total cholesterol (TC) were determined by automatic biochemical analyzer. Serum creatinine (Scr) was examined by creatinine colorimetry. The blood urea nitrogen (BUN) was checked by urea colorimetry. HE staining was used to observe the pathological morphology of renal tissue. The differential genes in mouse renal tissue were determined by transcriptome chip technology, and the differential genes of mice in DGSYP group were analyzed by KEGG enrichment analysis. The mRNA expression levels of core genes with TPM>10 in renal tissue were determined by RT-PCR. Results Compared with the blank group, the model group showed significant increases in body weight, OGTT-AUC, FBG, UACR, Scr, BUN, TG, and TC (P<0.01). Compared with the model group, the dapagliflozin group and DGSYP groups showed decreases in body weight, OGTT-AUC, FBG, UACR, Scr, BUN, TG, and TC (P<0.05, P<0.01). Compared with the blank group, a total of 1 129 differential genes were screened out in the model group, including 337 up-regulated differential genes and 792 down-regulated differential genes. Compared with the model group, a total of 271 differential genes were screened out in medium-dose DGSYP group, including 195 up-regulated differential genes and 76 down-regulated differential genes. There were 57 differentially expressed genes in the blank group, model group, and the medium-dose DGSYP group, among which there were 12 core genes with TPM>10, including Gsta2, Cyp4a12a, Slc8a1, Abcc4, Cpeb4, Serpina1b, Npl, Aacs, Kap, Slc5a10, Tmem252, and Ifi27l2a. The mRNA expression levels of the 12 core genes were consistent with the transcriptome sequencing trend. Compared with the model group, the mRNA expression levels of Gsta2, Abcc4, Slc8a1, and NPL in the medium-dose DGSYP group increased (P<0.05, P<0.01), while the mRNA expression levels of Slc5a10 and Tmem252 decreased (P<0.05). The differential genes in the medium-dose DGSYP group were enriched in drug metabolism-cytochrome P450, glutathione metabolism, and reactive oxygen species, and other related pathways. Conclusion DGSYP can improve the prognosis of diabetic nephropathy, and its mechanism may be related to regulating Gsta2, Slc5a10, Abcc4, Slc8a1, Tmem252, Npl, and other gene expressions as well as modulating cytochrome P450, glutathione metabolism, reactive oxygen species, and other signaling pathways.
〔Keywords〕 Danggui Shaoyao Powder; db/db mice; diabetic nephropathy; transcriptomics; differentially expressed genes; circulating blood and promoting urination
糖尿病肾病(diabetic nephropathy,DN)是最常见的慢性肾脏病(chronic kidney disease,CKD)。根据中国慢性病及危险因素检测中心在2018—2019年开展的CKD患病率调查显示,我国估计有8 200万人患有CKD[1]。虽然,与之前的全国调查相比,CKD总体患病率呈下降趋势,但与糖尿病相关的CKD患病率由1.2%上升至2.6%[1]。DN是导致全球终末期肾病(end-stage renal disease,ESRD)的主要原因[2]。虽然血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻滞剂、钠-葡萄糖协同转运蛋白2抑制剂和盐皮质激素受体拮抗剂等药物在一定程度上能改善DN的预后,但其临床疗效仍然有限[3-4]。因此,进一步探索DN的发病机制,寻找新的治疗靶点,开发预防及延缓DN进展的新策略十分必要。
DN归属于中医学“水肿”“关格”范畴,其关键病机以脾肾亏虚为本,瘀血、痰湿为标,治以培补脾肾、通络化痰、活血化瘀[5]。当归芍药散出自《金匮要略·妇人妊娠病脉证并治第二十》,方中以当归、芍药为君,养血活血敛阴,川芎、泽泻为臣,川芎活血行滞,泽泻淡渗利湿消肿;白术补脾,恢复脾胃运化功能,茯苓渗湿,泻其水邪,共为佐药。本方川芎、当归、白芍活血而不竣猛,补血而不滞血;白术、茯苓、泽泻健脾而不碍湿,利水而不伤脾,以通为主,以补为辅[6],全方合奏活血利水补虚之功。研究发现,当归芍药散可以显著改善高糖诱导的足细胞损伤,提示当归芍药散具有治疗DN的潜力[7]。然而,当归芍药散治疗DN的分子生物学机制仍未阐明,尚未明确其调控的潜在基因和靶点。因此,本研究拟采用转录组学结合分子生物学手段探究与验证当归芍药散对db/db小鼠的保护机制,以期为当归芍药散治疗DN的临床应用、探索新的药理作用提供新的实验证据。
1 材料
1.1 动物
25只6周龄的db/db小鼠和5只6周龄的db/m小鼠均购自江苏华创信诺医药科技有限公司,动物许可证号:SYXK(湘)2019-0009,动物合格证编号:202317695。所有动物饲养于湖南中医药大学SPF级实验动物中心,置于12 h/12 h明暗交替,温度(24±2) ℃,相对湿度50%±10%的环境中,提供相应的水和食物,自主食用。本研究经湖南中医药大学伦理委员会批准(伦理批准号:LL2023042602)。
1.2 主要药物及试剂
当归芍药散由当归、白芍、茯苓、白术、泽泻、川芎组成。上述中药饮片均购于湖南中医药大学第一附属医院中药房(批号:TH22101801、TH22082301、CK22102401、2022083104、HY22092803、GW23031?鄄
301),经湖南中医药大学药学院吴勇军副教授鉴定为正品。达格列净(阿斯利康公司,国药准字:HJ2017?鄄0119,规格:10 mg/粒);葡萄糖注射液(中国大冢制药有限公司,批号:2H93J5);肌酐比色法测试盒、尿素比色法测试盒(伊莱瑞特生物科技股份有限公司,批号:E-BC-K188-M、E-BC-K183-M);4%多聚甲醛组织固定液(兰杰柯科技有限公司,批号:BL539A)。
1.3 主要仪器
血糖仪(三诺生物传感股份有限公司,型号:GA-3);冷冻离心机[奥豪斯仪器(上海)有限公司,型号:5515R];台式离心机、超微量分光光度计(赛默飞世尔科技公司,型号:CR4i、NanoDrop 8000);荧光定量PCR仪(美国应用生物系统公司,型号:QuantStudioTM 5 Real-Time PCR System);电泳仪(北京六一生物科技有限公司,型号:DYY-6C);旋转蒸发器(上海力辰邦西仪器科技有限公司,型号:LC-RE-301);Spark多功能酶标仪(瑞士帝肯公司,型号:30086376)。
2 方法
2.1 药物制备
当归芍药散出自《金匮要略·妇人妊娠病脉证并治第二十》,根据《方剂学》[8]中经方的临床等效剂量,当归芍药散以当归9 g、白芍48 g、川芎24 g、茯苓12 g、白术12 g、泽泻24 g为比例进行配制。于8倍的蒸馏水中浸泡30 min后,煎煮30 min,倒出药液,再加入6倍的蒸馏水,煎煮25 min,合并2次煎煮的药液用纱布过滤,使用旋转蒸发仪将过滤后的药液浓缩至含生药量2 g/mL,置于4 ℃冰箱贮存备用。
2.2 分组及给药方法
将25只6周龄的db/db模型小鼠和5只6周龄的db/m小鼠适应性喂养2周后。测量db/db模型小鼠空腹血糖(fasting blood glucose, FBG),以FBG≥11.1 mmol/L、尿白蛋白肌酐比值(urea albumin creatinine ratio,UACR)≥30 mg/g判定为造模成功[9-10]。根据随机数字表法将造模成功的25只db/db小鼠分为模型组、当归芍药散低剂量组、当归芍药散中剂量组、当归芍药散高剂量组、达格列净组,每组5只;另选5只db/m小鼠为空白组。
参照人和动物体表面积[11]的等效剂量系数折算法,选用70 kg成人药物用量换算,依据低、中、高剂量比例1∶2∶4,当归芍药散低、中、高剂量组用药分别为8.39、16.77、33.54 g/kg,达格列净组1.3 mg/kg予以灌胃[12],空白组、模型组以20 mL/kg蒸馏水灌胃,每组灌胃1次/d,持续6周。
2.3 样本采集
末次给药后,各组小鼠禁食不禁水12 h过夜,称取各组小鼠体质量后,使用乙醚进行麻醉。将干燥的棉球平铺于麻醉缸内,倒入乙醚,待乙醚挥发约1 min左右,逐个放入实验小鼠,待小鼠麻醉后立即取出。使用摘取眼球取血法收集血液样本,放入4 ℃冷冻离心机,以3 000 r/min离心15 min(离心半径6 cm),提取上清液得到血清;迅速打开腹腔取双侧肾脏,去包膜。左肾取部分肾组织放入4%多聚甲醛固定液中常温保存。剩余肾组织迅速保存于-80 ℃用于转录组学和分子生物学检测。
2.4 观察指标
2.4.1 基础指标检测 灌胃6周后测量小鼠的体质量,并用快速血糖仪检测小鼠FBG[13]。
2.4.2 口服糖耐量试验的曲线下面积 禁食不禁水12 h后,给予每只小鼠10 mL/kg的20%葡萄糖溶液灌胃。取小鼠尾静脉血液,用血糖试纸分别检测并记录小鼠灌胃前及灌胃后30、60、120 min的血糖值,根据不同时间点的血糖值计算口服糖耐量试验(oral glucose tolerance test,OGTT)的曲线下面积(area under thecurve,AUC)[14]。
2.4.3 尿液及血清生化指标检测 尿液指标:将小鼠置于代谢笼自由饮水和进食。使用代谢笼前先清洗,防止尿液被不明因素污染,每个代谢笼仅放1只老鼠,收集小鼠24 h尿液,尿液标本统一送湖南中医药大学第一附属医院检验科用全自动生化分析仪检测UACR。
血清指标:全自动生化仪检测各组小鼠血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC);肌酐比色法测试盒检测小鼠血肌酐(serum creatinine, Scr);尿素比色法测试盒检测小鼠血尿素氮(blood urea nitrogen, BUN)。
2.4.4 病理学观察肾组织病理变化 取肾组织于4%多聚甲醛中固定,乙醇梯度脱水,石蜡包埋制成蜡块,4 μm切片,进行HE染色,于光学显微镜下观察并拍照。
2.4.5 肾脏mRNA测序及分析 提取小鼠肾脏组织总RNA后,进行RNA的质量检测。待样品质检合格后,构建转录组文库,使用Nova-seq 6000进行高通量测序,文库构建及测序工作由广州基迪奥生物技术股份有限公司完成。采用该公司提供的云平台进行差异基因分析,差异基因筛选条件为|log2FC|≥1.5且FDR<0.05,筛选出空白组vs模型组、模型组vs当归芍药散中剂量组之间的差异表达基因(differentially expressed gene, DEG)。使用基迪奥生物平台网站(https://www.omicsmart.com/#/)对当归芍药散筛选出的差异基因进行KEGG通路富集分析。
2.4.6 韦恩图构建共同基因 通过创建韦恩图确定当归芍药散中剂量组vs模型组与模型组vs空白组的共同基因。韦恩图在基迪奥生信云工具上完成,将两组数据集导入网站上的韦恩图工具中,绘制韦恩图并获得交集。以P<0.05,且表达值TPM>10鉴定为核心基因。
2.4.7 核心基因的RT-PCR验证 对核心DEGs的mRNA表达通过RT-PCR得到证实,将转录组测序提取的总RNA剩余样品逆转录为cDNA模板,并按照说明书进行PCR扩增。根据各组的Ct值,选用β-actin作为内参基因,通过2-△△Ct法计算各组样品mRNA的相对表达量,引物由广州基迪奥生物科技有限公司合成,引物序列详见表1。
2.5 统计学分析
实验所得数据经GraphPad Prism 10.0软件进行统计分析。计量资料结果以“x±s”表示。满足正态性者,多组间比较采用单因素方差分析,两两比较用最小明显性差异法检验;不满足正态性资料用Kruskal-Wallis秩和检验。以P<0.05表示差异有统计学意义。
3 结果
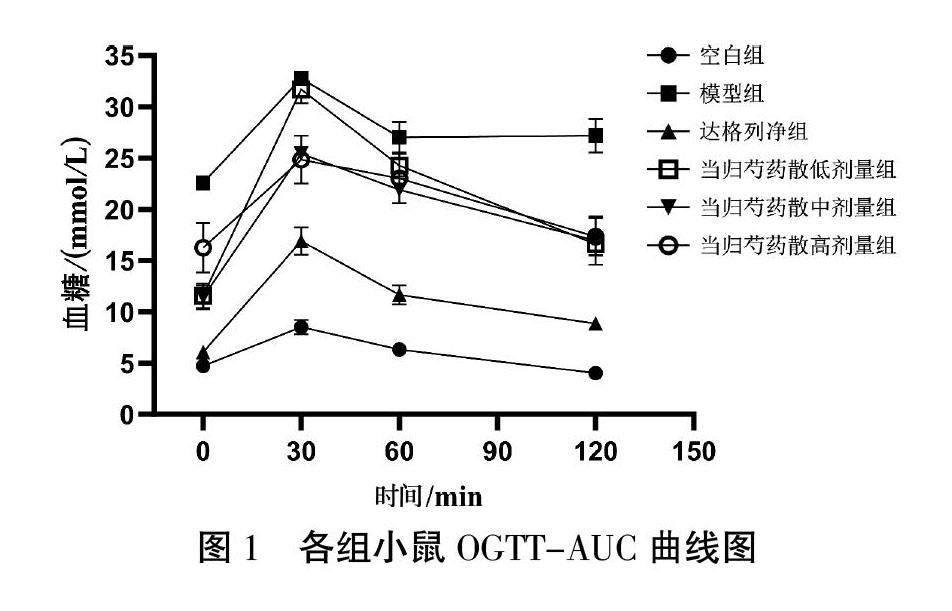
3.1 各组小鼠体质量、FBG、OGTT-AUC的比较
与空白组相比,其余各组体质量、FBG、OGTT-AUC显著升高(P<0.01);与模型组比较,用药组的体质量、FBG、OGTT-AUC降低(P<0.05,P<0.01);与达格列净组相比,当归芍药散低剂量组FBG、OGTT-AUC显著增加(P<0.01),当归芍药散中、高剂量组OGTT-AUC显著升高(P<0.01);与当归芍药散低剂量组相比,当归芍药散中剂量组FBG下降(P<0.05)。详见表2、图1。
3.2 各组小鼠尿液及血清生化指标比较
与空白组相比,模型组TG、TC、UACR、Scr、BUN水平明显升高(P<0.01),当归芍药散低、高剂量组和达格列净组TC水平升高(P<0.05,P<0.01),当归芍药散低剂量组UACR水平升高(P<0.05);与模型组比较,达格列净组和当归芍药散各剂量组TG、TC、UACR、Scr、BUN水平降低(P<0.05,P<0.01)。详见表3。
3.3 各组小鼠肾组织病理变化的比较
空白组小鼠肾小球形态正常,肾小管排列整齐,肾间质未见异常,未见炎性细胞浸润。与空白组小鼠相比,模型组小鼠肾脏皮质与髓质边界较为清晰,皮质区肾小体结构完整清晰,肾小管结构较为完整,可见蛋白管型和白细胞管型,系膜细胞增生明显,间质内可见炎性细胞浸润,亦可见纤维组织增生。与模型组比较,达格列净组和中药各剂量组血管球系膜细胞轻度增生,肾小管上皮结构正常,间质未见炎性细胞浸润及纤维增生。详见图2。
3.4 小鼠转录组测序数据的质量评估
Pearson相关系数检验结果显示,空白组、模型组和当归芍药散中剂量组不同样本之间均具有较高的相关性。主成分分析显示,与空白组相比,模型组及当归芍药散中剂量组样本能够显著分离,表明各组间的基因存在显著性差异。详见图3。
3.5 小鼠转录组DEG分析
与空白组比较,模型组鉴定出1 129个DEG,其中337个DEG上调、792个DEG下调;与模型组比较,当归芍药散中剂量组鉴定出271个DEG,其中195个DEG上调、76个DEG下调。聚类分析表明,这些差异表达的mRNA可以很好区分空白组与模型组、当归芍药散中剂量组与模型组。详见图4。
3.6 小鼠转录组重叠的核心基因表达
创建模型组vs空白组和当归芍药散中剂量组vs模型组差异基因的韦恩图,两个数据集共有57个重叠的DEG,详见图5。以P<0.05,且表达值TPM>10为核心基因,共识别出12个基因,即:Gsta2、Cyp4a12a、Slc8a1、Abcc4、Cpeb4、Serpina1b、Npl、Aacs、Kap、Slc5?鄄a10、Tmem252、Ifi27l2a。
3.7 小鼠肾组织核心基因mRNA表达水平比较
经检测,各组Gsta2、Cyp4a12a、Slc8a1、Abcc4、Cpeb4、Serpina1b、Npl、Aacs、Kap、Slc5a10、Tmem252、Ifi27l2a mRNA表达与转录组测序趋势一致。与空白组比较,模型组Slc8a1、Abcc4、NPL、Slc5a10、Tmem252 mRNA表达水平升高(P<0.05,P<0.01),Cyp4a12a、Kap mRNA表达水平下降(P<0.01);当归芍药散中剂量Gsta2、Slc8a1、Abcc4、NPL mRNA表达水平升高(P<0.01),Aacs、Kap mRNA表达水平下降(P<0.01)。与模型组比较,当归芍药散中剂量组Gsta2、Abcc4、Slc8a1、NPL mRNA表达水平升高(P<0.05,P<0.01),Slc5a10、Tmem252 mRNA表达水平下降(P<0.05)。详见图6。
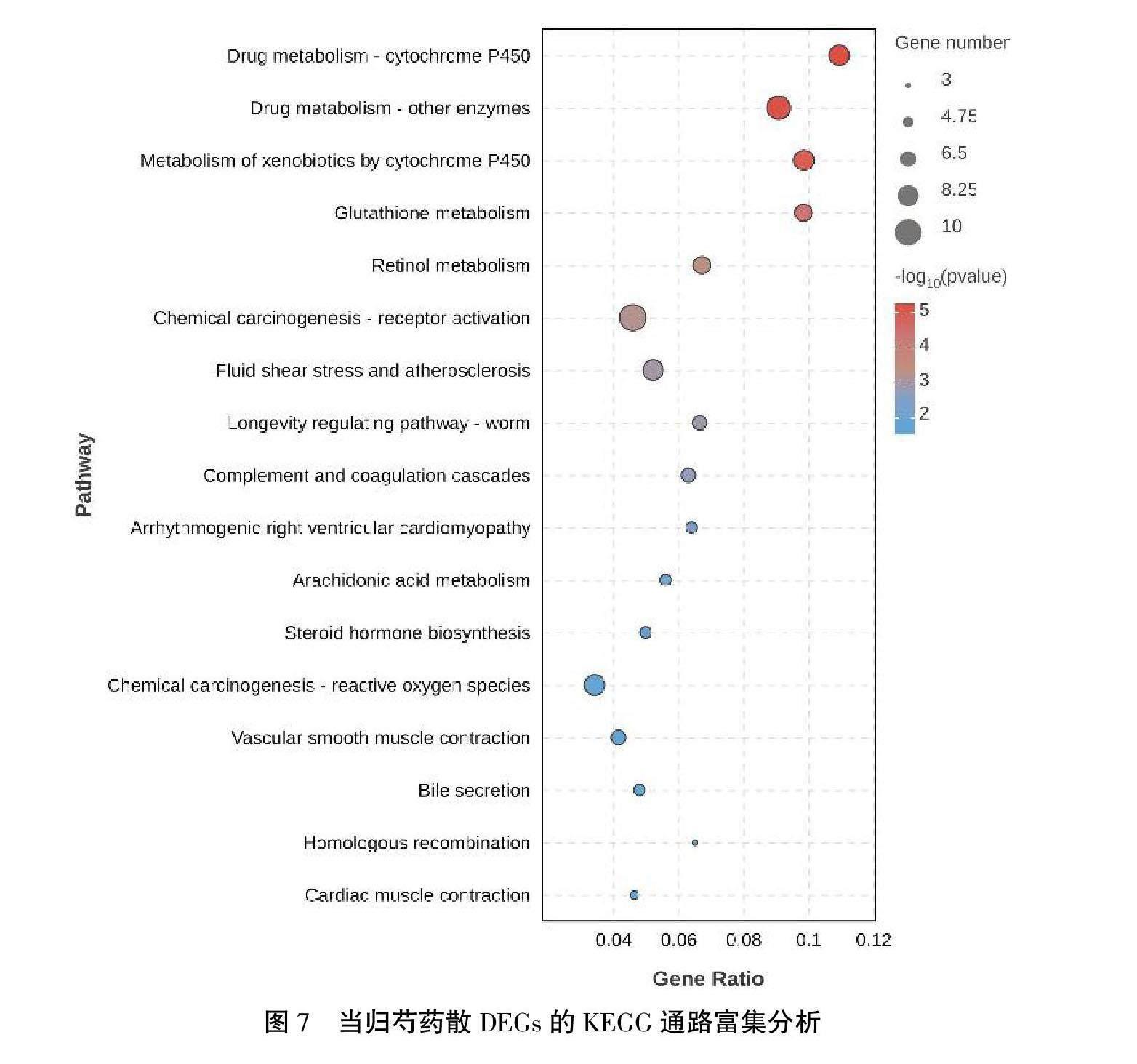
3.8 当归芍药散DEG的KEGG通路富集分析
当归芍药散调节的DEG显著富集于药物代谢-细胞色素P450、谷胱甘肽代谢、活性氧等相关通路。详见图7。
4 讨论
为深入了解当归芍药散治疗DN的作用机制,本研究采用db/db小鼠作为实验对象,db/db小鼠具有自发血糖增高、尿蛋白的特点,且肾损伤随着年龄的增长而恶化,是理想的研究DN的小鼠模型[15]。本次实验结果表明,与模型组相比,达格列净组及当归芍药散各剂量组空腹血糖、体质量、OGTT-AUC、TG、TC、UACR、Scr、BUN等各项指标均下降,说明当归芍药散对DN小鼠具有肾脏保护作用。
Gsta2是编码谷胱甘肽S-转移酶α类的基因,谷胱甘肽转移酶通过催化活性氧(reactive oxygen species, ROS)等内源性产物与谷胱甘肽(glutathione, GSH)的巯基结合,使其更溶于水从而有利于机体消除,从而在细胞解毒中发挥关键作用[16]。Slc5a10是编码SGLT-5的基因,研究表明,阻断SGLT-5可使果糖排泄增加,减轻果糖导致的胰岛素抵抗和肝脂肪变性,对糖尿病早期体征产生有益影响[17]。多种尿毒症毒素的滞留和积累是CKD的标志之一,促进Abcc4基因编码的转运蛋白表达有助于多种有毒代谢物的肾脏排泄[18-19]。炎症和感染会导致细胞外高Na+水平,触发Slc8a1基因编码的Na+/Ca2+交换器的激活使Na+内流、Ca2+外流,同时伴随活化T细胞核因子5(nuclear factor of activated T-cell 5, NFAT5)的积累触发自噬,减弱高渗应激诱导的细胞死亡[20-21]。目前,对于Tmem252基因的研究较少,但是在一项关于P78-PEDF治疗DN的转录组学研究中,Tmem252同样作为重要的靶基因,本课题组推测这个基因可能参与DN的发生发展[22]。
KEGG通路富集分析结果显示,当归芍药散调控的DEG主要富集于细胞色素P450、谷胱甘肽代谢、活性氧等多个信号通路。细胞色素P450可将花生四烯酸代谢为20-羟基二十碳四烯酸,从而参与肾脏炎症的发生,抑制细胞色素P450通路延缓肾小管炎症和纤维化[23]。GSH是目前研究最多的细胞抗氧化剂之一,可防止氧化应激引起的细胞损伤,2型糖尿病和DN患者的GSH水平降低,处于全身氧化应激状态,促进GSH代谢通路,可延缓糖尿病并发症的进展[24]。机体高糖状态可通过多元醇等途径导致ROS的产生增加,激活核因子-κB、磷酸肌醇3-激酶蛋白/丝氨酸/苏氨酸蛋白激酶等相关通路,诱导内皮细胞凋亡、炎症、纤维化,导致肾损伤,故抑制ROS相关通路是治疗DN的重要方案[25]。
综上所述,当归芍药散能够降低DN相关的生化指标,改善DN小鼠的肾脏病理损伤,可能通过调控Gsta2、Slc5a10、Abcc4、Slc8a1、Tmem252、Npl等关键基因表达,调控谷胱甘肽代谢、细胞色素P450、ROS等相关信号通路,抑制小鼠氧化应激水平,发挥DN的肾脏保护作用。转录组学作为单一的组学研究方法对于机制的探究存在一定的局限性,后续可联合多组学方法对当归芍药散的治疗机制进行深入分析。本研究为当归芍药散干预DN的作用机制提供了新的实验证据。
参考文献
[1] WANG L M, XU X, ZHANG M, et al. Prevalence of chronic kidney disease in China: Results from the sixth China chronic disease and risk factor surveillance[J]. JAMA Internal Medicine, 2023, 183(4): 298-310.
[2] SAGOO M K, GNUDI L. Diabetic nephropathy: An overview[J]. Methods in Molecular Biology, 2020, 2067: 3-7.
[3] GUPTA S, DOMINGUEZ M, GOLESTANEH L. Diabetic kidney disease: An update[J]. The Medical Clinics of North America, 2023, 107(4): 689-705.
[4] WATANABE K, SATO E, MISHIMA E, et al. What's new in the molecular mechanisms of diabetic kidney disease: Recent advances[J]. International Journal of Molecular Sciences, 2022, 24(1): 570.
[5] 赵碧莲, 霍晶晶, 于世家. 基于“痰瘀互结”理论论治糖尿病肾病[J]. 中医药临床杂志, 2024, 36(1): 19-22.
[6] 陈潮祖. 中医治法与方剂[M]. 5版. 北京: 人民卫生出版社, 2009, 802.
[7] 王子明, 项 琼, 梅莎莎, 等. 当归芍药散对高糖诱导的足细胞损伤的保护作用研究[J/OL]. 时珍国医国药, 1-5[2024-05-20]. http://kns.cnki.net/kcms/detail/42.1436.R.20240227.1757.002.html.
[8] 李 冀, 左铮云. 方剂学[M]. 新世纪第5版. 北京:中国中医药出版社, 2021, 67.
[9] 张 彬, 张雪涟, 张晨阳, 等. 冠心丹参方调控Nrf2信号通路治疗糖尿病肾病的作用研究[J]. 中国中药杂志, 2020, 45(11): 2595-2600.
[10] 贾懿劼, 薛耀明. 《中国糖尿病肾脏病防治指南》(2021年版)解读[J]. 临床内科杂志, 2022, 39(5): 303-306.
[11] 徐叔云, 卞如濂. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2005: 62.
[12] 范晓霞, 姚勇利, 胡耀嘉, 等. 超重和肥胖2型糖尿病伴微量白蛋白尿患者使用达格列净或沙格列汀控制血糖疗效和安全性的观察[J]. 中国糖尿病杂志, 2020, 28(2): 85-88.
[13] 陈昱彤, 喻 嵘, 吴玉芩, 等. 白虎加人参汤对MKR糖尿病鼠肝脏PI3K/Akt信号通路的影响[J]. 中国实验方剂学杂志, 2023, 29(5): 114-121.
[14] 李 梅. 复方绿柳颗粒改善2型糖尿病ZDF大鼠胰岛素抵抗作用及机制研究[D]. 北京: 北京中医药大学, 2020.
[15] MAEKAWA M, MAEKAWA T, SASASE T, et al. Pathophysiological analysis of uninephrectomized db/db mice as a model of severe diabetic kidney disease[J]. Physiological Research, 2022, 71(2): 209-217.
[16] SOBHA S P, EBENEZAR K. Susceptibility of glutathione-S-transferase polymorphism to CVD develo-pment in type 2 diabetes mellitus-A review[J]. Endocrine, Metabolic & Immune Disorders-Drug Targets, 2022, 22(2): 225-234.
[17] GREMPLER R, AUGUSTIN R, FROEHNER S, et al. Functional characterisation of human SGLT-5 as a novel kidney-specific sodium-dependent sugar transporter[J]. FEBS Letters, 2012, 586(3): 248-253.
[18] MUTSAERS H A, CAETANO-PINTO P, SEEGERS A E, et al. Proximal tubular efflux transporters involved in renal excretion of p-cresyl sulfate and p-cresyl glucuronide: Implications for chronic kidney disease pathophysiology[J]. Toxicology in Vitro: an International Journal Published in Association with BIBRA, 2015, 29(7): 1868-1877.
[19] RUSSEL F G M, KOENDERINK J B, MASEREEUW R. Multidrug resistance protein 4 (MRP4/ABCC4): A versatile efflux transporter for drugs and signalling molecules[J]. Trends in Pharmacological Sciences, 2008, 29(4): 200-207.
[20] NEUBERT P, HOMANN A, WENDELBORN D, et al. NCX1 represents an ionic Na+ sensing mechanism in macrophages[J]. PLoS Biology, 2020, 18(6): e3000722.
[21] ZHU H, CAO W, ZHAO P, et al. Hyperosmotic stress stimulates autophagy via the NFAT5/mTOR pathway in cardiomyocytes[J]. International Journal of Molecular Medicine, 2018, 42(6): 3459-3466.
[22] RUBIN, SALZBERG A C, IMAMURA Y, et al. Identification of novel targets of diabetic nephropathy and PEDF peptide treatment using RNA-seq[J]. BMC Genomics, 2016, 17(1): 936.
[23] WANG T Q, FU X J, CHEN Q F, et al. Arachidonic acid metabolism and kidney inflammation[J]. International Journal of Molecular Sciences, 2019, 20(15): 3683.
[24] MANSOOR G, TAHIR M, MAQBOOL T, et al. Increased expression of circulating stress markers, inflammatory cytokines and decreased antioxidant level in diabetic nephropathy[J]. Medicina, 2022, 58(11): 1604.
[25] MA X J, MA J R, LENG T, et al. Advances in oxidative stress in pathogenesis of diabetic kidney disease and efficacy of TCM intervention[J]. Renal Failure, 2023, 45(1): 2146512.

