直推督脉对孤独症谱系障碍模型鼠PVN区催产素神经元及认知功能的影响
智慧 冯祥 张宇星 李武 艾坤 黄文韬 李江山
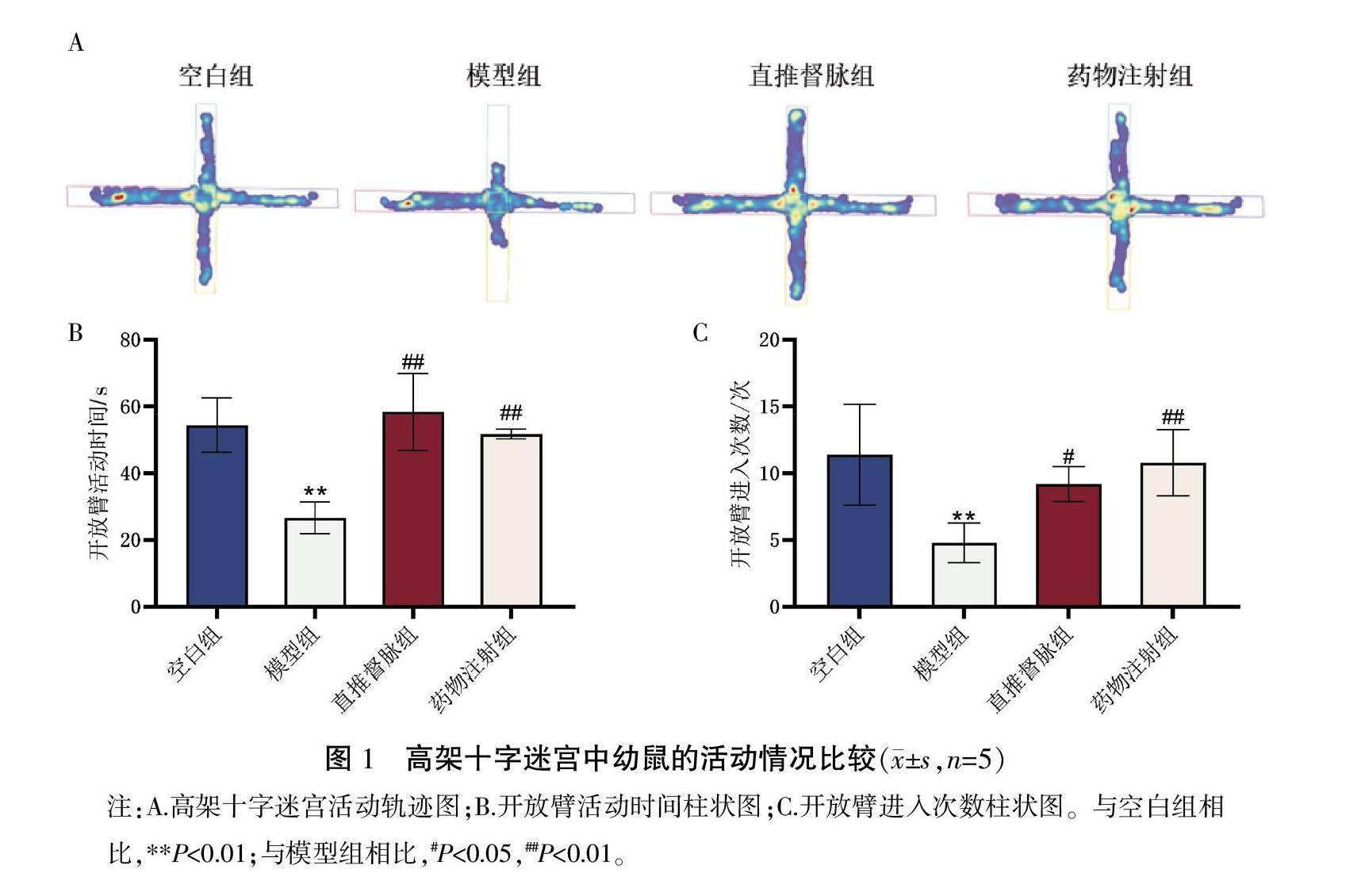

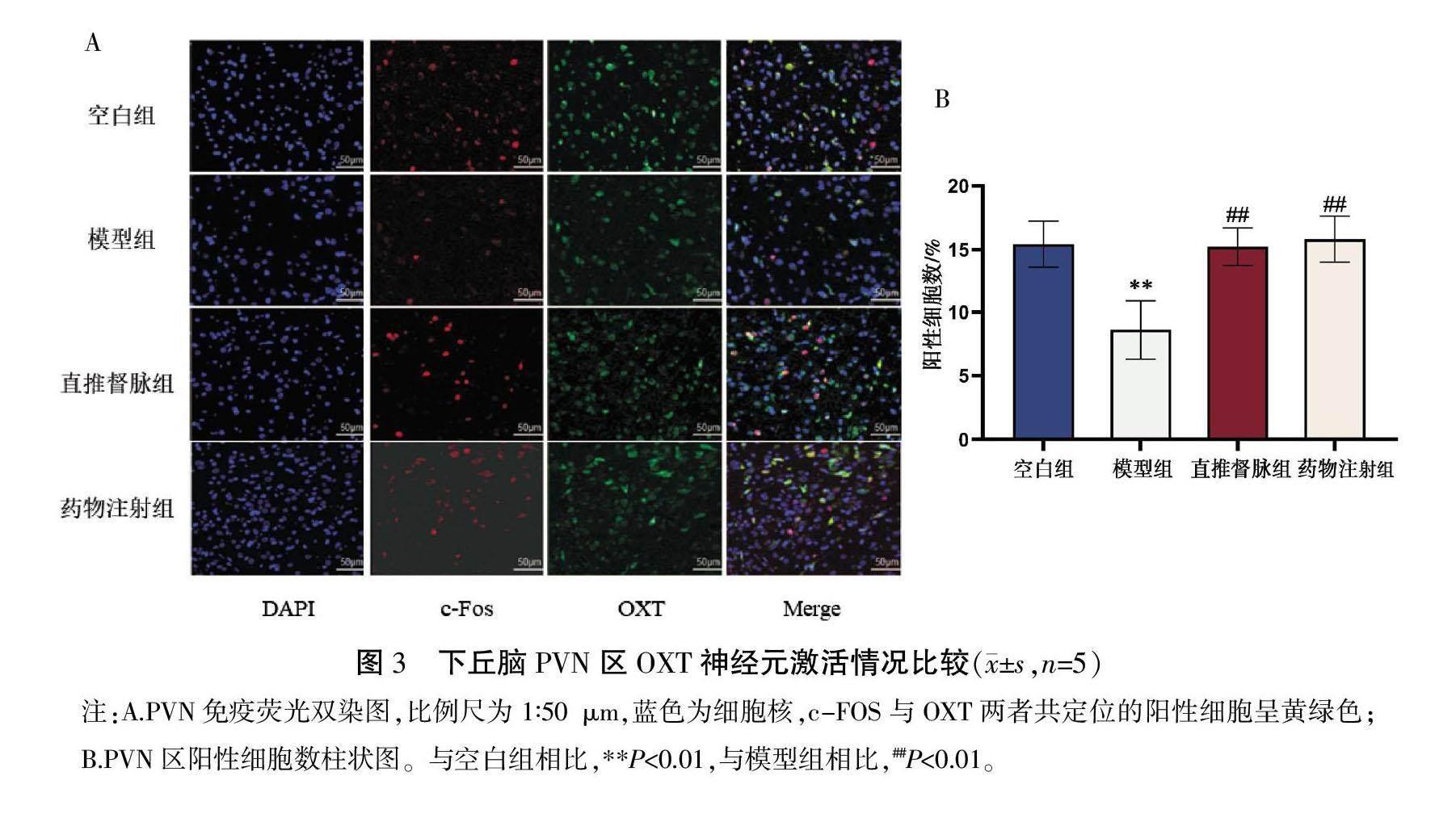
〔摘要〕 目的 观察直推督脉对孤独症谱系障碍(autism spectrum disorder, ASD)模型鼠室旁核(paraventricular nucleus, PVN)区催产素(oxytocin, OXT)神经元活性及认知功能的影响,探讨直推督脉对ASD的作用及潜在机制。方法 采用腹腔注射丙戊酸钠的方法构建ASD模型。随机取7只孕12.5 d的SD大鼠腹腔注射丙戊酸钠,3只腹腔注射生理盐水。孕鼠产仔后第21天,剔除雌性幼鼠,将剩余雄性幼鼠分为空白组、模型组、直推督脉组、药物注射组,每组5只。空白组、模型组给予腹腔注射同等剂量生理盐水;直推督脉组予以直推督脉的干预方式,20 min/次,一日2次,并予以腹腔注射同等剂量生理盐水;药物注射组以每日0.1 mg/kg的剂量腹腔注射OXT,以上干预均连续14 d。第35天进行高架十字迷宫实验、Morris水迷宫实验以判断其焦虑情绪和认知能力;通过免疫荧光染色法标记PVN区OXT与c-Fos蛋白、海马区OXT与催产素受体(oxytocin receptor, OXTR);Western blot法检测海马区OXTR蛋白表达水平;ELISA法检测幼鼠海马区与下丘脑中的OXT含量。结果 与空白组相比,模型组开放臂活动时间缩短、开放臂进入次数减少(P<0.01);逃避潜伏期增加、平台所在区域活动路程减少(P<0.05,P<0.01);PVN区OXT神经元与c-Fos阳性表达、海马区OXT与OXTR结合的阳性表达、海马区OXTR蛋白表达均减少(P<0.01);下丘脑与海马区OXT含量下降(P<0.01)。与模型组相比,直推督脉组、药物注射组的开放臂活动时间增长、开放臂进入次数增加(P<0.05,P<0.01);逃避潜伏期缩短、平台所在区域活动路程增加(P<0.05,P<0.01);PVN区OXT神经元与c-Fos阳性表达、海马区OXT与OXTR结合的阳性表达、海马区OXTR的蛋白表达水平均增加(P<0.01);下丘脑、海马区OXT含量上升(P<0.01)。结论 直推督脉可以改善ASD模型鼠的认知功能,其机制可能与PVN区OXT神经元被激活,OXT水平升高,从而增加其与海马区OXTR结合相关。
〔关键词〕 孤独症谱系障碍;推拿;督脉;认知功能;催产素神经元
〔中图分类号〕R244.1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.06.014
Effects of straight pushing the Du meridian on the oxytocin
neurons in the PVN region and the cognitive function of
autism spectrum disorder model rats
ZHI Hui1, FENG Xiang1, ZHANG Yuxing1, LI Wu1, AI Kun1, HUANG Wentao2*, LI Jiangshan1*
1. College of Acupuncture, Tuina, and Rehabilitation, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China;
2. The Second Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410005, China
〔Abstract〕 Objective To observe the effects of straight pushing the Du meridian (SPDM) on the activity of oxytocin (OXT) neurons in the paraventricular nucleus (PVN) region and the cognitive function of autism spectrum disorder (ASD) model rats, and to explore the effects and potential mechanism of SPDM on ASD. Methods The ASD model was established by intraperitoneal injection of sodium valproate. Seven SD rats at 12.5 days of pregnancy were randomly selected and sodium valproate was then injected into the abdominal cavity, while three other rats were injected with physiological saline into the abdominal cavity. On the 21st day after birth, female young rats were excluded and the remaining male young rats were divided into blank group, model group, SPDM group, and drug injection group, with five rats in each group. The blank group and model group were given intraperitoneal injection of the same dose of physiological saline; the SPDM group was intervened by SPDM for 20 minutes per time, twice a day, and the same dose of physiological saline was injected into the abdominal cavity; the drug injection group received intraperitoneal injection of OXT at a daily dose of 0.1 mg/kg, and the above interventions were continuous for 14 d. On the 35th day, elevated cross maze and Morris water maze experiments were conducted to assess the rats' anxiety and cognitive abilities; immunofluorescence staining was used to label OXT and c-Fos proteins in the PVN region, as well as OXT and oxytocin receptor (OXTR) in the hippocampus; Western blot was used to check the expression levels of OXTR protein in the hippocampus; ELISA method was used to determine the content of OXT in the hippocampus and hypothalamus of young rats. Results Compared with the blank group, the model group had shorter open arm activity time and fewer open arm entry times (P<0.01); increased escape latency (P<0.05) and decreased distance of the platform's quadrant (P<0.01); reduced positive expressions of OXT neurons and c-Fos in the PVN region, the positive expressions of OXT and OXTR binding in the hippocampus, and the OXTR protein expressions in the hippocampus (P<0.01); and the lower OXT content in the hypothalamus and hippocampus regions (P<0.01). Compared with those of model group, the open arm range of activity increased and the number of open arm entries increased in SPDM group and drug injection group (P<0.05, P<0.01), while the escape latency shortened and the range of activity in the quadrant where the platform was located increased (P<0.05, P<0.01); the positive expressions of OXT neurons and c-Fos in the PVN region, the positive expressions of OXT and OXTR binding in the hippocampus, and the expressions of OXTR in the hippocampus all increased (P<0.01); the OXT content in the hypothalamus and hippocampus increased (P<0.01). Conclusion SPDM can improve cognitive function of ASD model rats, and its mechanism may be related to the activation of OXT neurons in the PVN region, which in turn increases OXT levels and thus strengthens their binding with hippocampal OXTR.
〔Keywords〕 autism spectrum disorder; Tuina; the Du meridian; cognitive function; oxytocin neuron
孤独症谱系障碍(autism spectrum disorder, ASD),又称自闭症,属于神经发育障碍类疾病之一,常表现为社交障碍、认知困难、刻板行为以及兴趣狭隘等一系列症状[1]。目前,在全球范围内ASD已呈现出逐年增长的发病趋势[2],严重影响患者的生存质量并加重家庭经济负担[3]。然而,ASD的发病原因至今尚未明确,导致暂未形成针对病因的治疗方案。尽管美国食品药品监督管理局批准两种可用于治疗儿童ASD的药物,即阿立哌唑与利培酮,但二者均存在严重不良反应,如体质量增加、睡眠问题、自伤行为等[4]。因此,当前多以康复干预、针灸、推拿等辅助疗法改善其临床症状。
催产素(oxytocin, OXT)作为一种肽类激素,在室旁核(paraventricular nucleus, PVN)和视上核(supr?鄄aoptic nucleus,SON)中合成,并通过垂体储存、释放进入血液,发挥外周效应[5]。除刺激泌乳和收缩子宫的功能外,OXT还通过神经投射与其受体结合的方式产生中枢效应,在介导社会认知、社会交流等方面具有重要作用[6]。近年来,OXT被认为可能是参与ASD发病的因素之一。诸多研究表明[7-8],ASD患者体内的OXT含量异于正常健康人,可表现为OXT水平低下、催产素受体(oxytocin receptor, OXTR)结合异常等。体内实验表明[9],敲除小鼠脑中的OXTR基因后,小鼠表现出低社会识别能力等ASD样行为。而经外源补充或者内源刺激可提升ASD患者的认知能力,并改善ASD患者的社交缺陷、面部表情识别困难等症状[10-11]。故提升OXT水平可能是改善ASD患者认知障碍的一种有效干预方式。
推拿作为中医学中外治法的重要组成部分,具有无痛、无不良反应的特点。现已证明,推拿可以促进OXT的释放[12],这可能与推拿可激活C类触觉传入纤维有关[13]。MT等[14]对20名4~7岁的ASD患儿进行长达2年的推拿干预发现,ASD患儿对面部表情的反应能力得到提升,并有26%的患儿经诊断已无ASD的核心症状。ASD患儿在接受推拿之后,其唾液中的OXT水平增加的同时,社交能力也有所改善[15-16]。中医学认为,ASD的病位在脑,《灵枢·邪气脏腑病形》中提到“病变在脑,首取督脉”,督脉素有“阳脉之海”之称,通过调节督脉之经气可达到调控体内阳气的目的。督脉入属于脑,脑为髓海,阳气充盛则髓海得养,从而推动脑的生理功能正常运转。目前,研究人员以针刺或推拿为施术方法,以督脉为切入点建立的干预方案可有效缓解ASD患者的认知、社交障碍和焦虑情绪,提高语言交流能力以及眼神接触能力[17-18]。但直推督脉能否通过促进OXT的释放并对认知功能产生影响尚未可知。因此,本研究以ASD模型鼠为研究对象,以直推督脉为施术方式,探究直推督脉对ASD模型鼠OXT水平及认知功能的影响,为临床干预提供科学证据。
1 材料与方法
1.1 动物来源与模型制备
实验动物为SPF级SD孕鼠10只,孕12.5 d,购于湖南斯莱克景达实验动物有限公司,动物许可证编号:SYXK(湘)2019-0004,单笼饲养于湖南中医药大学实验动物中心。饲养温度为24~26 ℃,湿度为50%~70%,昼夜各半。本次实验方案已通过湖南中医药大学实验动物伦理委员会审批(伦理编号:LL202201180002)。本研究将10只孕鼠随机分成两组,7只以600 mg/kg的剂量腹腔注射丙戊酸钠,以构建ASD模型[19],根据幼鼠行为学检测(高架十字迷宫、Morris水迷宫实验)结果,以存在焦虑情绪和认知障碍作为造模成功的标准[20]。3只孕鼠腹腔注射同等剂量生理盐水,作为ASD对照组。在幼鼠出生后的第21天从ASD对照组产下的子代雄鼠中,随机选取5只为空白组;剔除ASD模型产下的子代雌鼠,剩余子代雄鼠15只,随机分为模型组、直推督脉组、药物注射组,每组5只。
1.2 主要仪器与试剂
高架十字迷宫实验视频分析系统(北京众实迪创科技发展有限责任公司,型号:ZS-DSG);Morris水迷宫(上海欣软信息技术有限公司,型号:XR-XM101);正置荧光显微镜、成像系统(日本尼康仪器有限公司,型号:NikonEclipseC1、NikonDS-U3);推法刺激器(自制研发,专利号:ZL202121852010.X)。
丙戊酸钠、OXT(美国MedChem express公司,批号:HY-10585A、HY-17571A);OXTR抗兔抗体(成都正能生物技术有限责任公司,批号:R389033);OXT神经毒素1、c-Fos多克隆抗体(6A3)(湖南艾方生物科技有限公司,批号:AF02963、AF11092)。
1.3 实验方法
直推督脉组的幼鼠予以推法刺激器顺督脉循行方向进行直推的操作。督脉定位参照2014年版《实验动物针灸手册》[21],操作范围为尾根沿后正中线上至百会穴,施术宽度为0.8 cm。将直推督脉组的幼鼠俯卧位放置,推法频率100次/min,压力100 g,操作距离100 mm,操作20 min,每日2次,分别于上午10:00与下午4:00时进行操作,并给予腹腔注射同等剂量生理盐水,每日1次,连续14 d。药物注射组每日以0.1 mg/kg的剂量腹腔注射OXT,每日1次,共14 d,空白组、模型组幼鼠均正常饲养,并给予腹腔注射同等剂量生理盐水,每日1次,共14 d。。
1.4 行为学检测
1.4.1 高架十字迷宫实验 高架十字迷宫实验[22]是针对实验对象焦虑状态的检测。分别由两个开放臂、闭合臂交叉组成,臂长50 cm、臂宽10 cm、臂高30 cm,两者重合区域为中心区。实验开始之前将幼鼠放置于迷宫之中,使其熟悉环境。实验正式开始时,以中心区作为起始点,将幼鼠放至中心区后计时10 min,观察其在设定时间内,在高架十字迷宫中的运动轨迹,以及在开放臂的运动时间和路程。一次实验结束后,用75%乙醇擦拭开放臂、闭合臂以消除气味,待仪器干燥后放入下一只待测幼鼠。
1.4.2 Morris水迷宫实验 Morris水迷宫[23]是检测认知能力的经典实验之一,主要检测实验动物的学习能力和空间记忆能力。迷宫由直径1 200 cm的圆柱形水池及可固定平台组成。将水池平分成4个象限,分别记为Ⅰ、Ⅱ、Ⅲ、Ⅳ象限。将平台固定放置于某一象限,并放水没过平台。实验连续进行6 d。第1、2天为训练期,将幼鼠从Ⅰ、Ⅱ、Ⅲ、Ⅳ象限放入水中,记录其在120 s内到达平台的时间。若120 s未找到平台,在计时结束之后,将幼鼠引导至平台并停留20 s。分别记录第3、4、5天从Ⅰ~Ⅳ象限入水的平均逃避潜伏期,即120 s内幼鼠从入水到登上平台的时间,以观察其学习认知能力,如未登上平台则记为120 s。第6天将平台撤去,将4组幼鼠从Ⅱ象限放入水中,记录幼鼠在原平台所在象限的路程,检测空间记忆能力。
1.5 样本采集
14 d干预结束并进行动物行为学检测之后,将各组幼鼠以戊巴比妥钠进行麻醉,充分暴露心脏,剪去心耳,进行灌注。使用高温灭菌手术器械将一侧脑组织的海马取出,放至液氮中,后转运至-80 ℃冰箱,用以Western blot检测;另一侧取脑组织放入4%多聚甲醛中固定48 h,以进行免疫荧光染色。
1.6 免疫荧光双标染色观察PVN区OXT、c-Fos和海马区OXT、OXTR共表达情况
将包含海马区、下丘脑的脑组织固定48 h,梯度乙醇脱水后,进行石蜡包埋。随后以4 μm的厚度连续切片。石蜡切片在经过脱蜡、抗原修复后加入自发荧光淬灭剂。处理完成后滴加BSA孵育,孵育结束后分别滴加一抗、二抗,并用DAPI复染细胞核,最终封片、镜检拍照。
1.7 Western blot检测海马区OXTR表达量
将海马区放入离心管中,加入裂解液与蛋白酶抑制剂后,充分匀浆。4 ℃,5 000 r/min,离心15 min(离心半径9.81 cm),收集上清液。利用BCA蛋白测定法检测蛋白浓度。使用蛋白上样缓冲液将蛋白定量为4 μg/mL,放于-20 ℃冰箱保存。使用10%的SDS-PAGE分离胶、5%的浓缩胶,经过电泳之后,将PVDF膜覆盖于凝胶上,利用湿转法进行转膜。脱脂牛奶封闭2 h后,TBST冲洗3次,每次10 min。将一抗OXTR抗兔抗体(1∶1 000)倒入孵育盒中,以覆盖PVDF膜为准,4 ℃过夜。第二天TSBT洗膜3次,孵育二抗(1∶10 000)1 h后再次将PVDF膜冲洗3次,曝光显影。最终结果以目的蛋白灰度值与内参蛋白灰度值的比值呈现。
1.8 ELISA法检测下丘脑、海马区OXT浓度
使用PBS将下丘脑、海马区的残留血液冲洗干净后进行称重,并将其充分剪碎。按照1∶9的比例将剪碎的组织与PBS放入离心管中,每管分别加入蛋白酶抑制剂。将离心管置于提前预冷的高速研磨机中使其充分研磨。将离心管取出,放入4 ℃的离心机中,5 300 r/min离心5 min(离心半径9.81 cm),提取上清液,用ELISA试剂盒检测其OXT含量。
1.9 统计学分析
利用SPSS 26.0进行统计学分析。实验数据以“x±s”表示。满足正态性和方差齐性则用单因素方差分析并结合LSD检验进行两两比较;当方差不齐时则用韦尔奇方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 高架十字迷宫实验结果
与空白组相比,模型组幼鼠在开放臂的活动时间缩短、进入开放臂的次数减少(P<0.01)。与模型组相比,直推督脉组、药物注射组在开放臂的活动时间均延长(P<0.01),开放臂进入的次数增加(P<0.05,P<0.01)。详见图1。
2.2 Morris水迷宫实验结果
与空白组相比,模型组幼鼠的平均逃避潜伏期延长(P<0.01),平台所在区域的活动路程缩短(P<0.05)。与模型组相比,直推督脉组和药物注射组幼鼠的平均逃避潜伏期缩短(P<0.01),平台区域活动路程增长(P<0.01)。详见图2。
2.3 下丘脑PVN区OXT神经元表达结果
与空白组相比,模型组共定位的阳性细胞数量占比减少(P<0.01)。与模型组相比,直推督脉组与药物注射组共定位的阳性细胞数量占比增加(P<0.01)。详见图3。
2.4 海马区OXT与OXTR荧光染色结果比较
与空白组相比,模型组海马区OXT与OXTR双染的阳性细胞数量占比减少(P<0.01)。与模型组相比,直推督脉组与药物注射组OXT与OXTR双染的阳性细胞数量占比增多(P<0.01)。详见图4。
2.5 海马区OXTR蛋白表达结果比较
与空白组相比,模型组的OXTR的表达量下降(P<0.01)。与模型组相比,直推督脉组与药物注射组的OXTR表达水平升高(P<0.01)。详见图5。
2.6 下丘脑、海马区OXT表达水平比较
与空白组相比,模型组下丘脑、海马区OXT水平均降低(P<0.01)。与模型组相比,直推督脉组和药物注射组下丘脑、海马区OXT水平均升高(P<0.01)。详见图6。
3 讨论
中医学并无关于ASD的名称记载,但其中所描述的“语迟”“胎弱”“童昏”的症状与ASD发育迟缓、认知缺陷、表情淡漠等临床表现相似,均由生长发育和精神思维异常导致,属神之病变[24]。中医学认为本病的病位在脑,脑为元神之府,主宰人体的生命活动,元神神机失养则出现发育迟缓、认知异常、语言混乱的表现[25]。从中医的经络理论出发,脑与督脉密切联系[26]。“督脉者,起于下极之俞……入属于脑”,说明督脉通过循行以入脑,从而参与调节脑的生理功能[27]。督脉为“阳脉之海”,手足三阳经均通过大椎穴汇入督脉而入脑。督脉阳气不足,无力上充脑窍将导致ASD患者出现沉默不语、反应迟缓或自言自语的症状。现代研究表明,督脉是交感神经与副交感神经中枢所在之处,其循行范围、作用与皮质脊髓束的走向和功能大致相同,可以维持大脑正常的生理功能[28]。前期研究发现,以督脉为核心制定的推拿方案可有效改善ASD患儿的社交障碍、刻板行为以及缩短与他人眼神接触的反映时间等[29-30]。因而,治疗ASD可从督脉入手。本研究结果显示,干预后,直推督脉组、药物注射组开放臂的活动时间与进入次数、水迷宫平台所在象限的活动路程均增加,平均逃避潜伏期缩短。表明通过直推督脉,可改善ASD幼鼠的焦虑和认知情况,而焦虑情况的缓解有利于认知能力的提升,两者之间存在相互影响的关系[31]。
OXT在促进社会交流、社会认知以及共情能力等方面发挥着重要的作用[32-33]。OXT在下丘脑PVN区分泌,并通过神经纤维投射等方式传递至海马区、杏仁核、前额叶等相关脑区,与其中的OXTR结合以发挥作用[34]。下丘脑PVN区的OXT系统受损,将会影响OXT的分泌[35]。研究人员发现,ASD患者下丘脑分泌OXT的能力不及正常健康人[36]。因此,提高ASD患者下丘脑OXT神经元的兴奋性,促进OXT的分泌是改善ASD患者临床症状的潜在干预方式。c-Fos蛋白是PVN区OXT神经元激活的标志,轻柔体表刺激可激发大鼠PVN区OXT神经元c-Fos蛋白的表达[37-38]。本研究通过免疫荧光双标染色法对4组幼鼠PVN区OXT神经元与c-Fos蛋白共同标记,结果显示模型组幼鼠PVN区共定位的阳性细胞占比均少于空白组、直推督脉组、药物注射组。下丘脑的OXT含量检测发现,模型组OXT含量明显低于其余3组,说明直推督脉可激活ASD模型鼠PVN区OXT神经元,刺激OXT含量的升高,为其投射至远隔脑区提供了基础。
下丘脑PVN区OXT神经元以神经投射的方式传递至广泛的脑区,其中包括海马区[39-40]。海马区为调控机体认知、学习功能的关键脑区。有证据表明,OXT可以调控海马CA2区神经元的放电模式以调控海马区内部的信息传递,且海马CA2区正是影响社会记忆与认知的重要结构[41]。海马区OXTR的表达在调控学习认知功能方面发挥了重要作用[42]。因此,上述研究共同表明OXT、OXTR两者相互协作共同参与海马区调控认知的功能。研究证实,ASD患者的海马区功能受损,且通过功能磁共振成像发现,ASD患者海马区中与调控情景记忆的网络连接减弱[43]。然而,有证据显示,通过补充OXT可以改善ASD小鼠的社会功能并重塑海马回路,提升学习记忆能力[44]。长期鼻饲OXT可部分改变ASD模型鼠海马区中与ASD样行为相关的分子途径,下调差异基因[45]。本研究结果发现,直推督脉组、药物注射组海马区OXT的含量均高于模型组,提示直推督脉可以升高海马区OXT的含量;模型组海马区的OXTR蛋白表达水平明显下调,而直推督脉组幼鼠的OXTR蛋白表达水平上调;模型组海马区OXT与OXTR共表达的阳性细胞占比少于直推督脉组、药物注射组。因而推断直推督脉可以改善ASD模型鼠OXT神经元的投射异常,增加海马区OXT与OXTR的结合,改善ASD模型鼠的认知能力。
综上所述,直推督脉能够改善ASD模型鼠的认知功能,其机制可能与PVN区OXT神经元被激活,从而促进OXT分泌并使其与海马区OXTR结合相关。
参考文献
[1] HIROTA T, KING B H. Autism spectrum disorder: A review[J]. JAMA, 2023, 329(2): 157-168.
[2] ZEIDAN J N, FOMBONNE E, SCORAH J, et al. Global preva?鄄lence of autism: A systematic review update[J]. Autism Research, 2022, 15(5): 778-790.
[3] 湖南省中医药和中西医结合学会儿科专业委员会. 儿童孤独症谱系障碍中西医结合干预专家共识[J]. 湖南中医药大学学报, 2024, 44(2): 169-175.
[4] 李圆圆, 黄明欣, 于 情, 等. 孤独症谱系障碍患者攻击行为发生危险因素、病情评估及治疗方法的应用研究进展[J]. 山东医药, 2024, 64(6): 105-108.
[5] 王淑敏, 贾 鹏, 任淑婷, 等. 糖尿病诱导的小鼠室旁核催产素和加压素阳性神经元FOS表达[J]. 神经解剖学杂志, 2024, 40(1): 35-42.
[6] FROEMKE R C, YOUNG L J. Oxytocin, neural plasticity, and social behavior[J]. Annual Review of Neuroscience, 2021, 44: 359-381.
[7] MAROTTA R, RISOLEO M C, MESSINA G, et al. The neurochemistry of autism[J]. Brain Sciences, 2020, 10(3): 163.
[8] PE?譙AGARIKANO O, L?魣ZARO M T, LU X H, et al. Exogenous and evoked oxytocin restores social behavior in the Cntnap2 mouse model of autism[J]. Science Translational Medicine, 2015, 7(271): 271ra8.
[9] FERGUSON J N, YOUNG L J, HEARN E F, et al. Social amnesia in mice lacking the oxytocin gene[J]. Nature Genetics, 2000, 25(3): 284-288.
[10] DEMAYO M M, YOUNG L J, HICKIE I B, et al. Circuits for social learning: A unified model and application to Autism Spectrum Disorder[J]. Neuroscience and Biobehavioral Reviews, 2019, 107: 388-398.
[11] ZHANG H F, DAI Y C, WU J, et al. Plasma oxytocin and arginine-vasopressin levels in children with autism spectrum disorder in China: Associations with symptoms[J]. Neuroscience Bulletin, 2016, 32(5): 423-432.
[12] RAPAPORT M H, SCHETTLER P, BRESEE C. A preliminary study of the effects of repeated massage on hypothalamic-pituitary-adrenal and immune function in healthy individuals: A study of mechanisms of action and dosage[J]. Journal of Alternative and Complementary Medicine, 2012, 18(8): 789-797.
[13] 郑 宇, 朱清广, 孔令军, 等. 推拿相关C类触觉传入纤维的研究进展[J]. 中华中医药杂志, 2021, 36(9): 5380-5383.
[14] MT SILVA L, SCHALOCK M. One- and two-year outcomes of treating preschool children with autism with a Qigong massage protocol: An observational follow-along study[J]. Alternative & Integrative Medicine, 2016, 5(2): 6-15.
[15] JERGER K K, LUNDEGARD L, PIEPMEIER A, et al. Neural mechanisms of Qigong sensory training massage for children with autism spectrum disorder: A feasibility study[J]. Global Advances in Health and Medicine, 2018, 7: 1-10.
[16] SILVA L M, SCHALOCK M, GABRIELSEN K R, et al. Early intervention with a parent-delivered massage protocol directed at tactile abnormalities decreases severity of autism and improves child-to-parent interactions: A replication study[J]. Autism Research and Treatment, 2015, 2015: 904585.
[17] 李予欣, 党伟利, 马丙祥, 等. 磁共振弥散张量成像评估针刺治疗儿童孤独症的疗效价值研究[J]. 磁共振成像, 2024, 15(1): 61-69.
[18] 龚梦华, 吴倩雯, 李一纯, 等. 捏脊疗法对自闭症模型大鼠焦虑样行为及NF-κB通路的影响[J]. 云南中医中药杂志, 2023, 44(4): 81-85.
[19] SCHNEIDER T, PRZEW?覵OCKI R. Behavioral alterations in rats prenatally exposed to valproic acid: Animal model of autism[J]. Neuropsychopharmacology, 2005, 30(1): 80-89.
[20] 蓝婉婷. 运动对孤独症大鼠行为及海马神经炎症的影响[D]. 广州: 广州体育学院, 2023.
[21] 胡元亮. 实用动物针灸手册[M]. 2版. 北京: 中国农业出版社, 2014: 388.
[22] PELLOW S, CHOPIN P, FILE SE, et al. Validation of open: Closed arm entries in an elevated plus-maze as a measure of anxiety in the rat[J]. Journal of Neuroscience Methods, 1985, 14(3): 149-167.
[23] OTHMAN MZ, HASSAN Z, CHE HAS AT. Morris water maze: A versatile and pertinent tool for assessing spatial learning and memory[J]. Experimental Animals, 2022, 71(3): 264-280.
[24] 智 慧, 冯 祥, 曾 理, 等. 催产素与孤独症谱系障碍的发病关系及推拿干预效应的理论探索[J]. 湖南中医药大学学报, 2024, 44(4): 617-622.
[25] 崔月华, 韩 斐. 基于“肾怯失音”论治儿童孤独症[J]. 北京中医药大学学报, 2023, 46(11): 1587-1591.
[26] 祝鹏宇, 万 方, 陈 东. 针灸调节小胶质细胞对缺氧诱导认知障碍的作用研究[J]. 中华中医药杂志, 2024, 39(4): 1941-1945.
[27] 张家豪, 迟 程, 范梦月, 等. “通督调神”理论治疗精神疾病的研究进展[J]. 世界科学技术: 中医药现代化, 2024, 26(1): 61-68.
[28] 张 晨, 冷 军, 房晓磊, 等. 隔姜蒜督灸治疗脑卒中后尿失禁疗效观察[J]. 山东中医杂志, 2022, 41(7): 753-758.
[29] 冯 祥, 蒋全睿, 危 威, 等. 通督推拿法干预孤独症谱系障碍儿童1例[J]. 湖南中医杂志, 2020, 36(4): 96-97.
[30] 冯 祥. 基于“五脏相通”理论探讨推拿干预孤独症谱系障碍患儿的临床观察[D]. 长沙: 湖南中医药大学, 2020.
[31] 史晓茹, 杨 姝, 崔 鹏. 老年抑郁焦虑状态与发生认知功能障碍的相关性[J]. 中国老年学杂志, 2023, 43(16): 3945-3947.
[32] GUASTELLA A J, BOULTON K A, WHITEHOUSE A J O, et al. The effect of oxytocin nasal spray on social interaction in young children with autism: A randomized clinical trial[J]. Molecular Psychiatry, 2023, 28(2): 834-842.
[33] 叶洪佳, 王 军. 孤独症谱系障碍治疗的研究进展[J]. 生命科学, 2023, 35(7): 861-869.
[34] 李丽旋, 肖礼祖, 蒋昌宇. 催产素与催产素受体系统的镇痛作用及机制研究进展[J]. 中国疼痛医学杂志, 2023, 29(4): 288-297.
[35] 王 宇. 断奶后社会隔离可以调节下丘脑室旁核社会接触诱导下的催产素的中央释放以及社会识别行为[C]//中华医学会神经病学分会. 中华医学会第十七次全国神经病学学术会议论文汇编(下). 厦门: [出版者不详], 2014: 458.
[36] MODAHL C, GREEN L, FEIN D, et al. Plasma oxytocin levels in autistic children[J]. Biological Psychiatry, 1998, 43(4): 270-277.
[37] OKABE S, YOSHIDA M, TAKAYANAGI Y, et al. Activation of hypothalamic oxytocin neurons following tactile stimuli in rats[J]. Neuroscience Letters, 2015, 600: 22-27.
[38] LIU Y, SHAN L, LIU T E, et al. Molecular and cellular mechanisms of the first social relationship: A conserved role of 5-HT from mice to monkeys, upstream of oxytocin[J]. Neuron, 2023, 111(9): 1468-1485.
[39] GRINEVICH V, KNOBLOCH-BOLLMANN H S, ELIAVA M, et al. Assembling the puzzle: Pathways of oxytocin signaling in the brain[J]. Biological Psychiatry, 2016, 79(3): 155-164.
[40] BARIBEAU D A, ANAGNOSTOU E. Oxytocin and vasopressin: Linking pituitary neuropeptides and their receptors to social neurocircuits[J]. Frontiers in Neuroscience, 2015, 9: 335.
[41] TIRKO N N, EYRING K W, CARCEA I, et al. Oxytocin transforms firing mode of CA2 hippocampal neurons[J]. Neuron, 2018, 100(3): 593-608.
[42] RAAM T, MCAVOY K M, BESNARD A, et al. Hippocampal oxy?鄄tocin receptors are necessary for discrimination of social stimuli[J]. Nature Communications, 2017, 8(1): 2001.
[43] COOPER R A, RICHTER F R, BAYS P M, et al. Reduced hippocampal functional connectivity during episodic memory retrieval in autism[J]. Cerebral Cortex, 2017, 27(2): 888-902.
[44] BERTONI A, SCHALLER F, TYZIO R, et al. Oxytocin administration in neonates shapes hippocampal circuitry and restores social behavior in a mouse model of autism[J]. Molecular Psychiatry, 2021, 26(12): 7582-7595.
[45] MATSUO K, SHINODA Y, ABOLHASSANI N, et al. Transcriptome analysis in hippocampus of rats prenatally exposed to valproic acid and effects of intranasal treatment of oxytocin[J]. Frontiers in Psychiatry, 2022, 13: 859198.

