土牛膝总皂苷的提取、成分鉴定及抗炎活性研究
曾琼丽 王玉凤 张恒 肖炜婷 杨蒂 韩越 王雄龙 李顺祥 欧阳文

〔摘要〕 目的 对土牛膝总皂苷进行体内外抗炎活性与分离鉴定研究,为其治疗炎症提供实验依据。方法 采用十八烷基硅烷键合硅胶-AQ柱色谱法(ODS-AQ)纯化制备土牛膝总皂苷;建立氨水诱导的急性咽炎大鼠模型,灌胃给药评价粗毛牛膝提取物及总皂苷抗炎活性;采用柱层析、核磁共振谱、质谱等技术对土牛膝总皂苷中的主要化合物进行分离、纯化和结构鉴定;建立脂多糖诱导的巨噬细胞炎症模型,评价各皂苷单体化合物的抗炎活性。结果 制备的粗毛牛膝总皂苷含量达到81.8%;在急性咽炎大鼠模型中,粗毛牛膝总皂苷及水煎液具有良好抗炎疗效,能显著降低血清IL-6、IL-1β、TNF-α细胞因子水平;总皂苷中鉴定出6个齐墩果烷型三萜皂苷,分别为竹节参皂苷Ⅳa(1)、竹节参皂苷Ⅳa丁酯(2)、金盏花皂苷E(3)、金盏花皂苷E丁酯(4)、竹节参皂苷I(5)、竹节参皂苷Ⅴ(6);体外炎症模型表明,分离得到的三萜皂苷类单体化合物均有不同程度的抗炎作用。结论 首次系统证明了皂苷类成分是粗毛牛膝发挥抗炎活性的药效物质基础;从牛膝属植物中首次分离得到化合物2和4,并证实其具有抗炎作用。
〔关键词〕 粗毛牛膝;抗炎;咽炎;三萜皂苷;化学成分;分离鉴定
〔中图分类号〕R284.2;R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.06.011
Extraction, composition identification, and anti-inflammatory activity of total saponins from Achyranthes aspera L.
ZENG Qiongli1,2, WANG Yufeng1,2, ZHANG Heng1,2, XIAO Weiting1,2, YANG Di4, HAN Yue1,2,
WANG Xionglong4, LI Shunxiang1*, OUYANG Wen1,3,5*
1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Key Laboratory of Modern Research of TCM, Education Department of Hunan Province, Changsha, Hunan 410208, China; 3. The Second Integrated Chinese and Western Medicine Hospital of Hunan University of Chinese Medicine, Liuyang, Hunan 410300, China; 4. Hunan Time Sun Pharmaceutical Co. Ltd., Yongzhou, Hunan 410116, China; 5. Liuyang Hospital of Chinese Medicine, Liuyang, Hunan 410300, China
〔Abstract〕 Objective To study the in vivo and in vitro anti-inflammatory activity, as well as isolation and identification of total saponins from Achyranthes aspera L., providing experimental evidence for its treatment of inflammation. Methods The total saponins of Achyranthes aspera L. were purified and prepared by ODS-AQ; after modeling of ammonia-induced acute pharyngitis, rats were treated with corresponding drugs by gavage to evaluate the anti-inflammatory activities of the extract and total saponins of Achyranthes aspera L.; column chromatography, nuclear magnetic resonance spectroscopy (NMR), mass spectrometry (MS), and other techniques were used to isolate, purify, and identify the main compounds in the total saponins of Achyranthes aspera L.; a lipopolysaccharide-induced macrophage inflammation model was established to evaluate the anti-inflammatory activity of various saponin monomers. Results The prepared total saponins of Achyranthes aspera L. reached a content of 81.8%; in the acute pharyngitis rat model, the total saponins and aqueous extract of Achyranthes aspera L. showed good anti-inflammatory effects, significantly reducing the serum levels of IL-6, IL-1β, and TNF-α; six oleanane-type triterpenoid saponins were identified as chikusetsusaponin Ⅳa (1), chikusetsusaponin Ⅳa butyl ester (2), calendulaside E (3), calendulaside E butyl ester (4), chikusetsusaponin I (5), and chikusetsusaponin Ⅴ (6). In vitro inflammation model indicated that the isolated triterpenoid saponin monomers all exhibited varying degrees of anti-inflammatory effects. Conclusion This paper systematically demonstrates for the first time that saponin components are the pharmacological material basis for the anti-inflammatory activity of Achyranthes aspera L.. Compounds 2 and 4 with anti-inflammatory effects are ester first isolated from Achyranthes plants
〔Keywords〕 Achyranthes aspera L.; antiinflammation; pharyngitis; triterpenoid saponin; chemical composition; isolation and identification
土牛膝是临床上常见的特色民族药材之一,其植物基源主要包括苋科植物粗毛牛膝(Achyranthes aspera Line)、柳叶牛膝(Achyranthes longifolia Makino)及野生牛膝(Achyranthes bidentata Blume)的干燥根及根茎[1-2],具有活血祛瘀、泻火解毒、利尿通淋的功效,常用于治疗跌打损伤、风湿关节痛、痢疾、白喉、咽喉肿痛等[3-4]。
现代药理研究表明,土牛膝具有显著的抗炎活性,其水提液对巴豆油致炎剂引起的小鼠肿胀、鸡蛋清诱导大鼠足跖肿胀、小鼠耳郭肿胀等多种急性炎症模型均表现出较强的抗炎和镇痛活性,以及单味鲜土牛膝根汁液对流行性腮腺炎、巴豆油引起的家兔咽炎具有明显减轻炎症表现的作用[5-6]。关于土牛膝主要的化学成分报道较多,主要为糖类、甾酮类和三萜皂苷类等物质,而其活性物质的基础研究相对较少,且未见系统研究数据[7-8]。课题组前期初步研究证实,β-蜕皮甾酮是土牛膝抗炎的主要活性成分之一,而关于其他含量高的皂苷类物质有待进一步深入研究[9]。鉴于以上背景,为进一步明确土牛膝所含主要皂苷类成分的抗炎作用,本课题组对粗毛牛膝总皂苷进行制备,在体内、外模型上研究粗毛牛膝总皂苷及其主要化合物的抗炎作用及化学结构,明确皂苷类物质的抗炎活性,为土牛膝药材进一步研究及开发利用提供实验依据,研究内容及结果如下。
1 材料
1.1 细胞与动物
细胞株:小鼠单核巨噬细胞RAW264.7细胞株,购自中国科学院昆明动物研究所细胞库。SPF级SD大鼠:体质量180~220 g、雌雄各半(共70只),购自湖南斯莱克景达实验动物有限公司,动物许可证编号:SCXK湘2019-0004。实验经湖南中医药大学伦理委员会批准(伦理编号:LL2021111704)。
1.2 药物与主要试剂
粗毛牛膝采自湖南永州马鞍岭瑶家寨湖南时代阳光药业股份有限公司种植基地,由湖南中医药大学药用植物学教研室王智老师鉴定为正品,标本保存在湖南中医药大学中药活性物质筛选工程技术研究中心。纯水仪(上海和泰仪器有限公司);香草醛、地塞米松、氨水(批号:C15518844、C12912459、C15383490,上海麦克林生化科技有限公司);高氯酸(批号:20220626,湖南汇虹试剂有限公司);竹节参皂苷Ⅳa、竹节参皂苷Ⅴ对照品(批号:PS010730、PS010731,成都普思生物公司);IL-6、IL-1β、TNF-α检测试剂盒(货号:G0132W,北京四正柏公司);RAW264.7细胞专用培养基(货号:CM-0190,武汉普诺赛公司);脂多糖、CCK-8试剂(批号:1031Q003、20150715,北京索莱宝公司);一氧化氮比色法试剂盒(货号:E-BC-K035-M,武汉伊莱瑞特生物公司);色谱级乙腈、甲醇、反相硅胶板(批号:22095277、23035102、HX87091648,德国默克公司);ODS-A(octadecysilyl-A)、ODS-AQ(50 μm)(型号:AAG12S50、OCG20S21,日本YMC公司);柱层析硅胶(80-100目和200-300目)、薄层色谱板(批号:14081318、020200518,青岛海洋公司);常规提取分离用试剂甲醇、乙醇、乙酸乙酯等均为分析纯试剂(天津致远化学试剂有限公司)。
1.3 主要仪器
AL104型万分之一电子天平(梅特勒-托利多公司);5425型高速冷冻离心机(德国Eppendorf公司);T2602FC型紫外仪(上海佑科仪器仪表有限公司);Pack Pro型C18色谱柱(日本YMC公司);LC-20A型高效液相色谱仪;LC-20AT型半制备液相色谱仪(日本岛津公司);iMark型酶标仪(美国Bio-Rad公司);CJ-2D型超净工作台(天津泰斯特仪器公司);CLM-170B-8CN型二氧化氮培养箱(美国Thermo公司);CKX53型倒置显微镜(日本Olympus公司);G2-XSQTof型超高效液相-质谱联用仪(美国Waters公司);INOVA-600MHz型高分辨超导核磁共振谱仪(瑞士Bruker公司)。
2 实验方法
2.1 粗毛牛膝总皂苷的制备及含量测定
取粗毛牛膝(A. aspera L.)1.17 kg,阴干过20目筛,12 L甲醇回流提取3次,每次2 h,提取液浓缩并干燥得浸膏130 g。浸膏与117.5 g ODS-AQ全亲水性反相硅胶搅拌,60 ℃水浴挥干溶剂。经ODS柱层析(4 cm×10 cm),利用甲醇-水(0∶1、1∶9、3∶7、1∶1、7∶3、9∶1、1∶0)和丙酮分别洗脱2 L,收集50%~70%甲醇洗脱液干燥即得粗毛牛膝总皂苷。
参考文献[10]的方法,分别称取适量竹节参皂苷Ⅳa和粗毛牛膝总皂苷,加入甲醇,制成0.204 mg/mL竹节参皂苷Ⅳa对照品溶液和0.4 mg/mL粗毛牛膝总皂苷供试品溶液。取100、300、500、700、900、1 100 μL竹节参皂苷Ⅳa对照品溶液和300 μL粗毛牛膝总皂苷供试品溶液置于试管中,于60 ℃水浴挥干后精密加入5%香草醛-冰乙酸0.2 mL和高氯酸0.8 mL,密塞,摇匀,置60 ℃恒温水浴中加热15 min,取出放入冰水浴中冷却10 min,加冰乙酸5 mL,摇匀,在紫外-可见分光光度计547 nm处测量吸光度A值。
2.2 粗毛牛膝总皂苷体内抗炎活性研究
2.2.1 溶液的配制 地塞米松溶液:精密称取100 mg地塞米松溶于100 μL二甲基亚砜溶液中,待地塞米松完全溶解后加入100 mL生理盐水,配制成浓度为1 mg/mL的溶液,分装后置于4 ℃冰箱备用。
粗毛牛膝总皂苷溶液:精密称取2.1项下粗毛牛膝总皂苷3 g,加入100 mL纯水,混合均匀,配制成0.03 g/mL的粗毛牛膝皂苷药液,分装后置于4 ℃冰箱备用。
粗毛牛膝水煎液:称取粗毛牛膝根及根茎粉末150 g,分别加入三倍量的水100 ℃煎煮4次,每次煎煮1 h。过滤、合并滤液,浓缩至300 mL左右,配制为每毫升含0.5 g原药材的药液,分装后置于4 ℃冰箱备用。
2.2.2 实验动物模型的建造 参照《中医药动物实验方法学》以及参考文献[11]中的急性咽炎大鼠模型的建立方法,采用15%氨水点涂法进行造模。先用10%水合氯醛麻醉大鼠(按体重0.3 mL/100 g腹腔注射),待大鼠疼痛反射消失后,向下牵引大鼠下颌骨,暴露出咽部组织。除正常组外,其余组的大鼠用浸泡于15%氨水中的棉签定点涂抹大鼠咽部约10 s,正常组大鼠用同样的方法涂抹生理盐水约10 s,连续涂抹3 d,大鼠出现挠抓口部以及咽部出现充血、肿胀即为造模成功。
2.2.3 分组给药 70只SPF级SD大鼠经过适应性喂养1周后,随机分为7组,分别为空白组、模型组、地塞米松组、粗毛牛膝水煎液高剂量组、粗毛牛膝水煎液低剂量组、粗毛牛膝总皂苷高剂量组、粗毛牛膝总皂苷低剂量组,每组10只。
每只大鼠灌胃给予相应的药物治疗5 d,空白组和模型组每只大鼠予灌胃等体积量生理盐水,根据参考文献[12],地塞米松组给药剂量为5 mg/kg;根据《湖南省中药饮片炮制规范》土牛膝日服剂量,实验剂量按照体表面积折算的等效剂量比值来计算,大鼠的等效剂量相当于人体的6.3倍,粗毛牛膝水煎液低剂量组大鼠给药剂量为2.5 g/kg,高剂量组大鼠给药剂量为5 g/kg。根据自制的粗毛牛膝总皂苷获得率折算,粗毛牛膝总皂苷低剂量给药剂量为75 mg/kg,高剂量组给药剂量为150 mg/kg。
2.2.4 HE染色观察咽部组织病理学改变 采用HE染色观察大鼠咽部组织病理学变化。
2.2.5 ELISA检测血清中炎症因子水平变化 采用ELISA检测各组大鼠血清样本中TNF-α、IL-1β、IL-6水平,具体操作按照ELISA检测试剂盒说明书进行。
2.2.6 统计学分析 实验结果采用SPSS 22.0统计软件进行统计学分析,实验数据均用“x±s”表示,两组间比较采用t检验,P<0.05为差异具有统计学意义。
2.3 粗毛牛膝总皂苷主要化合物的分离及鉴定
2.3.1 粗毛牛膝总皂苷主要化合物的分离 将2.1项下自制的粗毛牛膝总皂苷(3.6 g)经硅胶柱(2 cm×30 cm)分离,以二氯甲烷-乙酸乙酯-甲酸(88%)-水溶剂系统梯度洗脱,得到5个流分Fr.A~E。
Fr.B(0.75 g)进一步经硅胶柱(2 cm×20 cm)分离,以二氯甲烷-乙酸乙酯-甲酸(≥88%)-水溶剂系统梯度洗脱,得到7个流分Fr.B1~Fr.B7。Fr.B2经硅胶柱(2 cm×10 cm)反复分离,以二氯甲烷∶乙酸乙酯(5∶2)溶剂洗脱得到化合物4(8.2 mg)。Fr.B4经硅胶柱(2 cm×10 cm)反复分离,以二氯甲烷∶乙酸乙酯(1∶2)溶剂洗脱得到化合物2(7.9 mg)。Fr.B7经硅胶柱(2 cm×10 cm)反复分离,分别以乙酸乙酯∶甲酸(300∶1)溶剂洗脱得到化合物3(14.3 mg),以乙酸乙酯∶甲酸(200∶1)溶剂洗脱得到化合物5(9.5 mg)。Fr.C(1.28 g)进一步经硅胶柱(2 cm×20 cm)分离,以乙酸乙酯∶甲酸∶水(500∶20∶0.5)溶剂洗脱得到化合物1(42.6 mg),以乙酸乙酯∶甲醇∶甲酸(500∶50∶40)溶剂洗脱得到化合物6(10.4 mg)。
2.3.2 粗毛牛膝总皂苷主要化合物的结构鉴定 通过分析理化性质,采用现代波谱技术(1H NMR、13C NMR)及MS方法解析,并结合对照品分析比较鉴定化合物结构。
2.4 粗毛牛膝总皂苷及其主要化合物体外抗炎活性研究
2.4.1 细胞培养 参照文献[13],将RAW264.7细胞(货号:CL-0190,武汉普诺赛公司)培养于新鲜RAW264.7细胞专用培养基中,在37 ℃、5% CO2恒温培养箱中进行孵育,隔日传代。
2.4.2 细胞存活率检测 参照文献[10],随机分为空白组、正常组和给药组,分别设6个复孔,空白组不接种细胞,正常组和给药组以每孔1×105密度接种细胞24 h,换用含LPS(1 μg/mL)的DMEM高糖培养基90 μL继续培养24 h,加入不同浓度的粗毛牛膝总皂苷和单体化合物各10 μL继续培养24 h,吸出原培养基,将CCK-8溶液与完全培养基以1∶9的比例配制混匀后,以每孔100 μL加入到培养板中,继续培养2 h,用酶标仪于450 nm处测OD值,计算细胞存活率,计算公式如下:
细胞存活率=×100%
2.4.3 细胞上清液中NO释放量检测 根据细胞存活率结果,在对细胞无毒性作用的安全浓度范围内设置给药浓度。实验设置分组为正常组、模型组(含LPS 1 μg/mL)、地塞米松组(200 μg/mL)、粗毛牛膝总皂苷提取物(100、200、500 μg/mL)、竹节参皂苷Ⅳa(25、50、100 μmol/L)、竹节参皂苷Ⅴ(25、50、100 μmol/L)、金盏花皂苷E(25、50、100 μmol/L)、金盏花皂苷E丁酯(25、50、100 μmol/L)、竹节参皂苷Ⅳa丁酯(10、25、50 μmol/L)。各组加入含药或空白培养基后,继续孵育24 h,取上清液100 μL,加入100 μL griess试剂,于酶标仪570 nm 处测定吸光值,代入标准曲线,计算NO释放量。
2.4.4 统计学分析 实验数据均用“x±s”表示,采用SPSS 22.0统计软件对数据进行统计学分析,两组间比较采用t检验,P<0.05为差异具有统计学意义。
3 实验结果
3.1 UV法测定粗毛牛膝总皂苷含量
以竹节参皂苷Ⅳa的质量(μg)为横坐标,吸光度A值为纵坐标,绘制标准曲线,得到线性回归方程Y=0.004 16X+0.002 6(R2=0.999 7),将粗毛牛膝总皂苷样品的吸光度A值0.336代入线形回归曲线中,通过计算得到粗毛牛膝总皂苷百分含量为81.8%。
3.2 粗毛牛膝总皂苷体内抗炎活性
3.2.1 各组大鼠的咽部组织状态 各组大鼠的咽部组织状况如图1所示,与空白组相比,模型组大鼠咽部红肿,两侧扁桃体肿大,硬腭黏膜有明显的损伤,舌头有明显的溃疡;与模型组相比,其余各组大鼠咽部红肿明显好转,但舌头溃疡无明显变化。
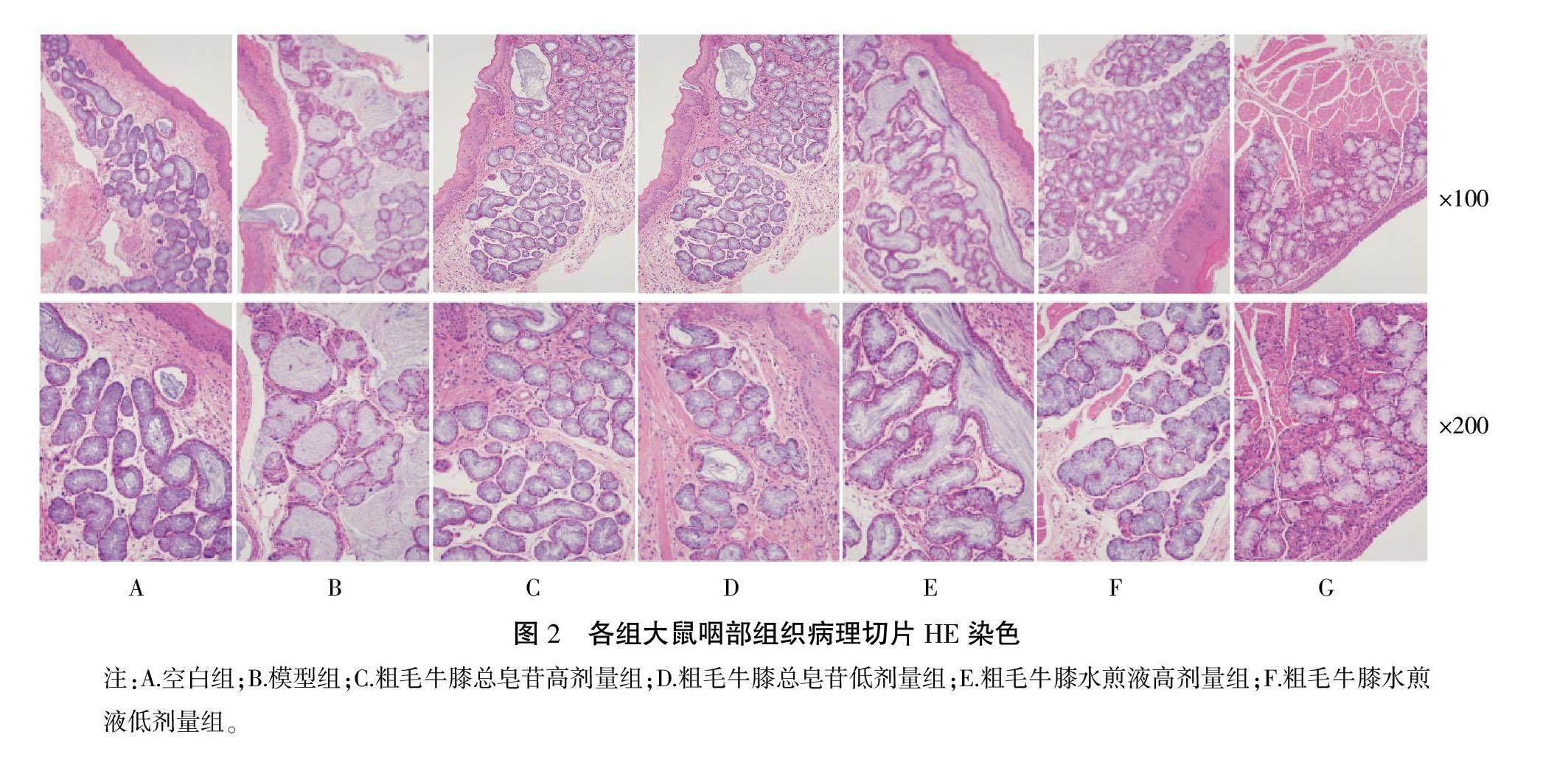
3.2.2 各组大鼠咽部病理形态学变化 各组大鼠咽部组织HE染色结果如图2所示。观察染色结果显示,空白组咽部组织上皮分层清晰,黏膜上皮细胞完好,未见增生。模型组分层不清楚,上皮层明显增厚,固有层炎性细胞浸润现象明显,腺体肥大,形态不规则。粗毛牛膝水煎液高、低剂量组、总皂苷提取物高、低剂量组相较于模型组,炎性细胞浸润明显减少,腺体形态结构恢复正常,组织形态有明显向正常方向转变。从大鼠咽部组织病理学变化角度观察,表明粗毛牛膝水煎液和总皂苷有明显的组织修复作用,可减轻氨水刺激的咽部组织中炎性细胞浸润,促进咽部组织黏膜和腺体修复。
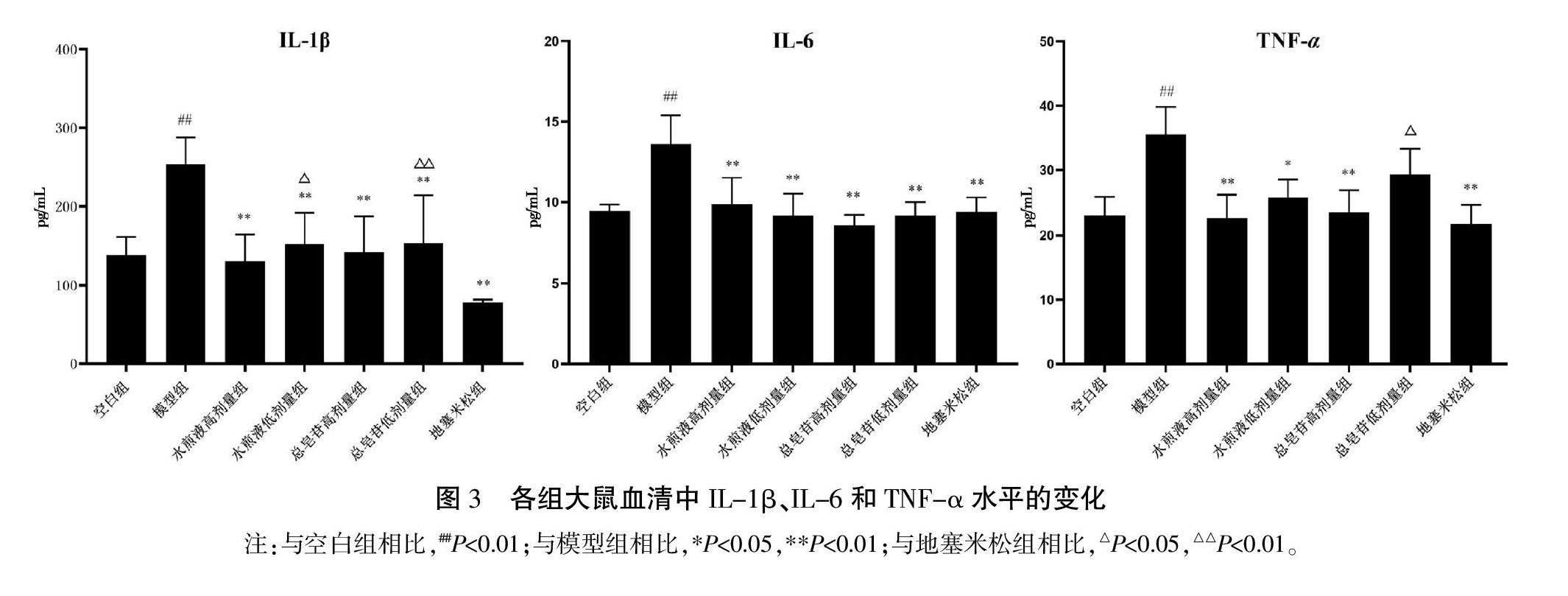
3.2.3 各组大鼠血清中炎症因子TNF-α、IL-6、IL-1β的表达水平 模型组大鼠血清中炎症因子IL-1β、IL-6、TNF-α含量较空白组显著升高(P<0.01)。与模型组比较,各组大鼠血清中IL-1β、IL-6含量显著降低(P<0.01),粗毛牛膝水煎液各剂量组TNF-α含量显著降低(P<0.05或P<0.01),而总皂苷低剂量组TNF-α无统计学意义(P>0.05)。与地塞米松组比较,粗毛牛膝水煎液低剂量组IL-1β及总皂苷低剂量组TNF-α的含量较高(P<0.05),总皂苷低剂量组IL-1β的含量具有显著性差异(P<0.01),而粗毛牛膝水煎液高、低剂量和总皂苷高剂量组IL-6、TNF-α含量差异无统计学意义(P>0.05)。此外,粗毛牛膝水煎液及总皂苷不同剂量组之间的炎症因子含量差异无统计学意义(P>0.05)。详见图3。
3.3 结构鉴定
化合物1:白色粉末。ESI-MS m/z:793.4426[M-H]-。1H NMR (600 MHz, Pyridine-d5) δ 6.22(1H, d, J=8.0 HZ, Glc-H-1), 5.42 (1H, brs, H-12), 4.98(1H, d, J=7.4 Hz, GlcA-H-1), 1.29(3H, s, H-27), 1.05(3H, s, H-26), 0.97(3H, s, H-24), 0.93(3H, s, H-23), 0.90(3H, s, H-29), 0.82(3H, s, H-25)。13C NMR(150 Hz, Pyridine-d5) δ: 38.6(C-1), 26.5(C-2), 89.0(C-3), 39.4(C-4), 55.7(C-5), 18.4(C-6), 33.0(C-7), 39.8(C-8), 47.9(C-9), 36.8(C-10), 23.3(C-11), 122.7(C-12), 144.0(C-13), 42.0(C-14), 28.0(C-15), 23.7(C-16), 46.9(C-17), 41.6(C-18), 46.1(C-19), 30.7(C-20), 33.9(C-21), 32.4(C-22), 28.1(C-23), 16.9(C-24), 15.5(C-25), 17.3(C-26), 26.1(C-27), 176.5(C-28), 33.1(C-29), 23.6(C-30), 107.1(GlcA-C-1), 75.2(GluA-C-2), 77.6(GlcA-C-3), 73.2(GlcA-C-4), 77.8(GlcA-C-5), 172.8(GlcA-C-6), 95.5(Glc-C-1), 73.8(Glc-C-2), 78.6(Glc-C-3), 70.9(Glc-C-4), 79.0(Glc-C-5), 62.0(Glc-C-6)。以上数据与文献[14]一致,故鉴定为竹节参皂苷Ⅳa。
化合物2:白色针状结晶。1H NMR (600 MHz, Pyridine-d5) δ: 6.30(1H, d, J=8.2 Hz, Glc-H-1), 5.40 (1H, brs, H-12), 4.97(1H, d, J=7.5 Hz, GlcA-H-1), 1.26, 1.24, 1.06, 0.94, 0.88, 0.86, 0.81(each 3H, s)。 13C NMR (150 Hz, Pyridine-d5) δ: 38.4(C-1), 26.4(C-2), 88.8(C-3), 39.2(C-4), 55.5(C-5), 18.2(C-6), 32.9(C-7), 39.6(C-8), 47.7(C-9), 36.7(C-10), 23.1(C-11), 122.6(C-12), 143.9(C-13), 41.8(C-14), 28.0(C-15), 23.5(C-16), 46.7(C-17), 41.5(C-18), 45.9(C-19), 30.6(C-20), 33.7(C-21), 32.3(C-22), 27.9(C-23), 16.6(C-24), 15.3(C-25), 17.2(C-26), 25.8(C-27), 176.2(C-28), 32.9(C-29), 23.4(C-30), 107.1(GlcA-C-1), 75.1(GlcA-C-2), 77.7(GlcA-C-3), 72.8(GlcA-C-4), 77.7(GlcA-C-5), 170.1(GlcA-C-6), 95.5(Glc-C-1), 73.9(Glc-C-2), 78.6(Glc-C-3), 70.8(Glc-C-4), 79.1(Glc-C-5), 61.9(Glc-C-6), 64.7(-COOCH2), 30.5(-CH2), 19.0(-CH2), 13.5(-CH3)。以上数据与文献[14]一致,故鉴定为竹节参皂苷Ⅳa丁酯。
化合物3:白色粉末。1H NMR (600 MHz, Pyridine-d5) δ 5.01(1H, d, J=7.7 Hz, GlcA-H-1), 1.30, 1.30, 0.99, 0.97, 0.96, 0.94, 0.79(each 3H, s)。13C NMR(150 MHz, Pyridine-d5) δ: 38.3(C-1), 26.3(C-2), 88.8 (C-3), 39.2(C-4), 55.5(C-5), 18.2(C-6), 32.9(C-7), 39.4(C-8), 47.7(C-9), 36.7(C-10), 23.4(C-11), 122.3(C-12), 144.5(C-13), 41.9(C-14), 28.0(C-15), 23.5(C-16), 46.4(C-17), 41.7(C-18), 46.2(C-19), 30.7(C-20), 33.9(C-21), 32.9(C-22), 27.9(C-23), 16.7(C-24), 15.2(C-25), 17.1(C-26), 25.9(C-27), 180.0(C-28), 33.0(C-29), 23.5(C-30), 106.9(GlcA-C-1), 75.2(GlcA-C-2), 77.4(GlcA-C-3), 73.2(GlcA-C-4), 77.9(GlcA-C-5), 173.0(GlcA-C-6)。以上数据与文献[15]一致,故鉴定为金盏花皂苷E。
化合物4:1H NMR (600 MHz, Pyridine-d5) δ 5.46 (1H, brs, H-12), 4.98(1H, d, J=7.7 Hz, GlcA-H-1); 1.30, 1.29, 0.99, 0.97, 0.95, 0.94, 0.80(each 3H, s); 0.76(3H, t, J=7.2 Hz, butyl-CH3) 13C NMR (150 MHz, Pyridine-d5) δ: 38.4(C-1), 26.4(C-2), 88.8(C-3), 39.2(C-4), 55.5(C-5), 18.2(C-6), 32.9(C-7), 39.4(C-8), 47.7(C-9), 36.7(C-10), 23.4(C-11), 122.2(C-12), 144.6(C-13), 41.9(C-14), 28.0(C-15), 23.5(C-16), 46.4(C-17), 41.7(C-18), 46.2(C-19), 30.7(C-20), 33.9(C-21), 32.9(C-22), 27.9(C-23), 16.6(C-24), 15.2(C-25), 17.1(C-26), 25.9(C-27), 180.0(C-28), 33.0(C-29), 23.5(C-30), 107.1(GlcA-C-1), 75.1(GlcA-C-2), 77.0(GlcA-C-3), 72.8(GlcA-C-4), 77.7(GlcA-C-5), 170.1 (GlcA-C-6), 64.7(-COOCH2), 30.6(-CH2), 19.0(-CH2), 13.5(-CH3)。以上数据与文献[14]一致,故鉴定为金盏花皂苷E丁酯。
化合物5:白色粉末。1H NMR (500 MHz, CD3OD),
δ: 5.40 (1H, d, J=8.2 Hz, H-1′), 5.27 (1H, t, J=3.6 Hz, H-12), 1.18(3H, s, H-27), 0.99(3H, s, H-23), 0.97(3H, s, H-30), 0.95(3H, s, H-24), 0.93(3H, s, H-29), 0.83(3H, s, H-26), 0.79(3H, s, H-25)。13C NMR (125 Hz, CD3OD), δ: 38.4(C-1), 27.5(C-2), 76.9(C-3), 38.5(C-4), 55.4(C-5), 18.1(C-6), 32.1(C-7), 39.3(C-8), 47.9(C-9), 36.7(C-10), 22.6(C-11), 122.4(C-12), 143.5(C-13), 41.5(C-14), 26.5(C-15), 23.1(C-16), 46.6(C-17), 41.2(C-18), 45.8(C-19), 30.1(C-20), 33.5(C-21), 31.7(C-22), 27.3(C-23), 14.9(C-24), 14.6(C-25), 16.3(C-26), 24.9(C-27), 176.7(C-28), 32.5(C-29), 22.5(C-30), 94.3(Glc-C-1), 72.6(Glc-C-2), 77.3(Glc-C-3), 69.8(Glc-C-4), 78.3(Glc-C-5), 61.0(Glc-C-6)。以上数据与文献[14]一致,故鉴定为竹节参皂苷Ⅰ。
化合物6:白色粉末。ESI-MS m/z:955.36[M-H]-。经薄层色谱与标准品对比Rf值鉴定为竹节参皂苷Ⅴ。
3.4 粗毛牛膝总皂苷及主要化合物体外抗炎活性
3.4.1 粗毛牛膝总皂苷及主要化合物对RAW264.7细胞中细胞活力的影响 粗毛牛膝总皂苷在100~500 μg/mL浓度范围内无细胞毒性(P>0.05),750~2 000 μg/mL浓度时,细胞存活率明显下降(P<0.01)。竹节参皂苷Ⅳa(1)、金盏花皂苷E丁酯(4)、竹节参皂苷Ⅴ(6)在10~100 μmol/L浓度范围内无明显细胞毒性(P>0.05);竹节参皂苷Ⅳa丁酯在10~50 μmol/L浓度范围内无明显细胞毒性(P>0.05);金盏花皂苷E在10~150 μmol/L浓度范围内无明显细胞毒性,50~100 μmol/L浓度时细胞存活率呈上升趋势(P<0.05)。因此,根据其结果选择安全范围内的给药浓度进行后续实验。详见图4。
3.4.2 NO释放量测定 与正常组相比,模型组细胞上清液中NO含量显著升高(P<0.01)。与模型组相比,地塞米松(200 μg/mL)组、粗毛牛膝总皂苷提取物(100、250、500 μg/mL)组、金盏花皂苷E、金盏花皂苷E丁酯(25、50、100 μmol/L)组NO含量均显著降低(P<0.01)。与地塞米松组相比,竹节参苷Ⅳa丁酯10 μmol/L剂量组中NO含量更高(P<0.01),竹节参苷Ⅴ50 μmol/L剂量组中NO含量相对较高(P<0.05),均无明显的NO抑制作用。在50 μmol/L浓度下,各化合物抑制上清液中NO释放的顺序为金盏花皂苷E丁酯>金盏花皂苷E>竹节参苷Ⅳa丁酯>竹节参苷Ⅳa>竹节参苷Ⅴ。详见图5。
4 讨论
土牛膝作为我国西南地带一味常见的中药,沿用历史悠久,民间多用于治疗白喉等炎症疾病。因其根茎、叶、花、种子均可药用,药用价值较高,在瑶族、傣族、白族、苗族等多个少数民族也有药用记载。瑶药“五虎九牛十八钻七十二风”中的牛膝风即土牛膝,用于肾炎水肿、下肢关节肿痛、石淋等症的治疗。傣医称其为“怀哦囡”,常熟用以调补水血,强健筋骨。在白族中被称之为“尺光子”,为治骨伤的奇效三味白族药之一。而在苗族中名为“酒嗓咯咯额牛”,常被临床配伍治疗鹤膝风、跌打损伤、痢疾、红崩等,使用较为普遍。此外,现代应用中,以土牛膝为主药研制出的喉咽清口服液、喉咽清颗粒、复方土牛膝糖浆、复方无花果含片等现代中药制剂广泛应用于临床治疗急慢性咽炎、口腔溃疡、扁桃体炎等疾病,疗效突出且安全性高[16-19]。土牛膝资源丰富、分布广泛、功效多样,且具有良好的应用基础,结合传统应用对其进行深入研究与开发利用具有重要意义。通过文献研究发现,近年对牛膝属植物药效成分的报道主要集中于三萜皂苷类物质。牛膝总皂苷通过抑制IL-1β和TNF-α等促炎因子,从而抑制软骨基质降解、软骨细胞凋亡及增殖等来治疗膝骨关节炎[20]。牛膝茎叶总皂苷经抑制肾脏尿酸盐转运蛋白URAT1、GLUT9对尿酸的重吸收,促进OAT1蛋白分泌尿酸入尿等呈现出良好的降尿酸作用,对大鼠高尿酸血症的治疗效果显著[21]。川牛膝皂苷类化合物通过降低血液、血浆黏度和IL-6、NO、TNF-α、COX-2等炎症因子水平,对大鼠急性血瘀具有明显的改善作用[22]。
本文拟对粗毛牛膝总皂苷进行系统成分研究及抗炎活性研究,发现其对急性咽炎大鼠模型有显著治疗作用,作用机制与降低大鼠血清中TNF-α、IL-6、IL-1β等炎症因子的释放有关,竹节参皂苷Ⅳa、竹节参皂苷Ⅳa丁酯、金盏花皂苷E、金盏花皂苷E丁酯、竹节参皂苷Ⅴ为其主要活性物质基础。其中,竹节参皂苷Ⅳa和竹节参皂苷Ⅴ为土牛膝药材中含量较高、研究较多的皂苷类物质,具有抗炎、抗氧化、抗肿瘤等多种药理活性[23-26]。竹节参皂苷Ⅳa通过抑制微小RNA-155、增加糖原合成酶激酶(GSK)-3β表达和抑制NF-κB信号通路来改善LPS诱导的RAW264.7细胞的炎症反应[25]。竹节参皂苷Ⅴ可通过NF-κB和MAPK信号通路抑制细胞炎症反应[27]。另有研究表明,金盏花皂苷E可通过抑制JAK-stat3信号通路的激活来抑制LPS诱导的巨噬细胞炎症反应[28],上调大鼠Kruppel样因子2的表达抑制糖酵解介导的巨噬细胞极化来减轻动脉粥样硬化[29]。竹节参皂苷Ⅳa丁酯通过抑制辅助性T细胞17分化来改善小鼠关节炎,是一种天然的IL-6受体拮抗剂[30]。关于金盏花皂苷E丁酯的抗炎活性研究较少,其确切机制还需进一步深入研究。本研究通过挖掘土牛膝的抗炎物质基础,探索其作用机制,为土牛膝及相关复方的进一步研究奠定实验基础。
参考文献
[1] 国家中药管理局《中华本草》编委会. 中华本草: 第二册[M]. 上海: 上海科学技术出版社, 1999: 836.
[2] 国家药典委员会. 中华人民共和国药典: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 552.
[3] 池如勋, 张国珍. 用土牛膝治疗白喉32例临床观察[J]. 江西中医药, 1960(1): 25-27.
[4] 欧丽兰, 余 昕, 朱 烨, 等. 土牛膝在急性炎症动物模型中的抗炎作用[J]. 华西药学杂志, 2012, 27(6): 644-646.
[5] 杨运星. 单味鲜土牛膝治疗流行性腮腺炎80例[J]. 湖北中医杂志, 1994, 16(5): 4.
[6] 饶 芳, 李荣群, 傅华洲, 等. 土牛膝治疗急性咽喉炎的实验研究[J]. 现代中西医结合杂志, 2009, 18(33): 4073-4074.
[7] 罗懿钒, 欧阳文, 唐代凤, 等. 牛膝中皂苷和甾酮类物质基础及药理活性研究进展[J]. 中国现代中药, 2020, 22(12): 2122-2136.
[8] 毕 武, 孙 辉, 丁 野, 等. 土牛膝的传统应用及化学成分和药理活性研究进展[J]. 药学研究, 2023, 42(7): 502-510, 516.
[9] 欧阳文, 罗懿钒, 程思佳, 等. 湘产土牛膝中蜕皮甾酮类化合物分离与鉴定[J]. 湖南中医药大学学报, 2018, 38(10): 1129-1132.
[10] 张小鸿, 吴杨峥, 徐先祥. 不同显色剂对牛膝总皂苷含量测定的影响[J]. 中国实验方剂学杂志, 2013, 19(21): 113-116.
[11] 徐 敏. 咽喉清复方对急性咽炎p38/Erk/NF-κB/COX-2信号通路调控的影响[D]. 遵义: 遵义医科大学, 2020.
[12] XU M, HU T Y, LI D C, et al. Yan-Hou-Qing formula attenuates ammonia-induced acute pharyngitis in rats via inhibition of NF-κB and COX-2[J]. BMC Complementary Medicine and Therapies, 2020, 20(1): 280.
[13] 欧阳文, 罗懿钒, 李 震, 等. 土牛膝抗炎成分分离、鉴定与含量测定研究[J]. 天然产物研究与开发, 2020, 32(7): 1171-1181.
[14] 张 磊, 王彦志, 赵会丽, 等. 牛膝化学成分及其对细胞增殖影响[J]. 中成药, 2018, 40(6): 1320-1325.
[15] 郭庆兰, 李 彬, 李 建, 等. 空心莲子草中三萜皂苷类化学成分的研究[J]. 药学学报, 2011, 46(4): 428-431.
[16] 文 庆, 方 磊, 李瑞莲, 等. 土牛膝药材民族特色及研究现状[J]. 中国药业, 2018, 27(21): 1-5.
[17] 戴 斌, 李钊东, 丘翠嫦, 等. “虎牛钻风”类传统瑶药的调查研究[J]. 中国民族民间医药杂志, 1998, 7(2): 28-34, 46.
[18] 潘立文, 杨先振, 李光富, 等. 傣医外治法治疗慢性风湿类疾病的特色探析[J]. 浙江中医药大学学报, 2017, 41(2): 146-149.
[19] 杨福寿. 奇效三味白族药在骨伤科中的临床应用[J]. 中国民族民间医药杂志, 2001, 10(4): 241-242.
[20] 黄竞杰, 杨俊兴, 陈浩雄. 牛膝总皂苷治疗膝骨关节炎的药理研究进展[J]. 中药新药与临床药理, 2021, 32(4): 592-595.
[21] 康 乐, 苗艳艳, 苗明三, 等. 基于调控尿酸转运蛋白的牛膝茎叶总皂苷治疗高尿酸血症肾病大鼠机制研究[J]. 中华中医药杂志, 2020, 35(5): 2305-2310.
[22] CAO Y M, GU C C, ZHAO F L, et al. Therapeutic effects of Cyathula officinalis Kuan and its active fraction on acute blood stasis rat model and identification constituents by HPLC-QTOF/MS/MS[J]. Pharmacognosy Magazine, 2017, 13(52): 693-701.
[23] XU G R, LEI H Y, YUAN Q L, et al. Inhibition of chikusetsusaponin Ⅳa on inflammatory responses in RAW264.7 cell line via MAPK pathway[J]. Zeitschrift Fur Naturforschung C, Journal of Biosciences, 2021, 76(3/4): 103-110.
[24] WANG H, QI J, LI L, et al. Inhibitory effects of Chikusetsusaponin Ⅳa on lipopolysaccharide-induced pro-inflammatory responses in THP-1 cells[J]. International Journal of Immunopathology and Pharmacology, 2015, 28(3): 308-317.
[25] XIN Y, YUAN Q, LIU C Q, et al. MiR-155/GSK-3β mediates anti-inflammatory effect of Chikusetsusaponin Ⅳa by inhibiting NF-κB signaling pathway in LPS-induced RAW264.7 cell[J]. Scientific Reports, 2020, 10(1): 18303.
[26] ZHANG X H, XU X X, XU T. Ginsenoside Ro suppresses interleukin-1β-induced apoptosis and inflammation in rat chondrocytes by inhibiting NF-κB[J]. Chinese Journal of Natural Medicines, 2015, 13(4): 283-289.
[27] WANG T, DAI Y W, DUN Y Y, et al. Chikusetsusaponin V inhibits inflammatory responses via NF-κB and MAPK signal?鄄ing pathways in LPS-induced RAW264.7 macrophages[J]. Immunopharmacology and Immunotoxicology, 2014, 36(6): 404-411.
[28] GAWANDE D, BAREWAR S, TAKSANDE J, et al. Achyranthes aspera ameliorates stress induced depression in mice by regulating neuroinflammatory cytokines[J]. Journal of Traditional and Complementary Medicine, 2022, 12(6): 545-555.
[29] GAWANDE D Y, DRUZHILOVSKY D, GUPTA R C, et al. Anticonvulsant activity and acute neurotoxic profile of Achyranthes aspera Linn[J]. Journal of Ethnopharmacology, 2017, 202: 97-102.
[30] BAGAVAN A, RAHUMAN A A, KAMARAJ C, et al. Larvicidal activity of saponin from Achyranthes aspera against Aedes aegypti and Culex quinquefasciatus (Diptera: Culicidae)[J]. Parasitology Research, 2008, 103(1): 223-229.

