基于Hepcidin和JAK2/STAT3信号通路探讨通痹颗粒对胶原诱导性关节炎大鼠的影响
吴伊莹 柳玉佳 廖亮英 范伏元 郭志华


〔摘要〕 目的 研究通痹颗粒对胶原诱导性关节炎(collagen-induced arthritis, CIA)大鼠铁调素(hepcidin, Hepc)、Janus激酶(janus kinase, JAK)2/信号转导子和转录激活子(signal transduction and activator of transcription, STAT)3信号通路的影响。方法 选取36只雌性SD大鼠随机分成空白组、模型组、阳性对照组和通痹颗粒低、中、高剂量组,每组6只。空白组不予处理,其余组用牛Ⅱ型胶原建立CIA模型。造模完成后,空白组、模型组予生理盐水灌胃,其余各组分别以巴瑞替尼片和低、中、高剂量通痹颗粒灌胃。每天1次,连续4周。HE染色行滑膜组织病理学观察;酶联免疫吸附法测定血清Hepc、白细胞介素6(interleukin 6, IL-6)水平;逆转录-聚合酶链反应法测定滑膜中JAK2、STAT3、细胞信号因子传导抑制体(suppressor of cytokine signaling, SOCS)1、SOCS3的mRNA相对表达量;Western blot法检测滑膜中JAK2、p-JAK2、STAT3、p-STAT3、SOCS1、SOCS3的蛋白表达量。结果 模型组见滑膜上皮结构缺损,滑膜重度增生,排列紊乱,并有大量炎症细胞浸润和多个血管翳形成;各给药组滑膜炎症均有所减轻,阳性对照组优于通痹颗粒高剂量组,通痹颗粒中、高剂量组优于低剂量组。与模型组相比,各给药组关节炎指数评分、血清Hepc和IL-6水平均显著降低(P<0.01);与阳性对照组相比,通痹颗粒中、低剂量组关节炎指数评分、血清Hepc和IL-6水平均升高(P<0.05)。与模型组比较,阳性对照组和通痹颗粒低、中、高剂量组JAK2、STAT3 mRNA和蛋白以及p-JAK2、p-STAT3的蛋白表达量均降低(P<0.05),而通路抑制因子SOCS1、SOCS3 mRNA和蛋白的表达均升高(P<0.05);与阳性对照组比较,通痹颗粒各剂量组JAK2、STAT3 mRNA和蛋白以及p-JAK2、p-STAT3的蛋白表达量均升高(P<0.05),而SOCS1、SOCS3 mRNA和蛋白的表达均降低(P<0.05)。结论 通痹颗粒能够改善CIA大鼠滑膜炎症,其机制可能与抑制JAK2/STAT3信号通路而减少Hepc的表达有关。
〔关键词〕 类风湿关节炎;胶原诱导性关节炎;中药;通痹颗粒;铁调素;JAK2/STAT3信号通路
〔中图分类号〕R285 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.06.005
Effects of Tongbi Granule on collagen-induced arthritis rats based on Hepcidin and JAK2/STAT3 signaling pathway
WU Yiying1,2, LIU Yujia1, LIAO Liangying1, FAN Fuyuan1, GUO Zhihua2*
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China;
2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To study the effects of Tongbi Granule on hepcidin (Hepc) and janus kinase (JAK) 2/signal transduction and activator of transcription (STAT) 3 signaling pathway in collagen-induced arthritis (CIA) rats. Methods A total of 36 female SD rats were randomized into blank, model, positive control, low-, medium-, and high-dose of Tongbi Granule groups, with six rats in each group. CIA model was constructed with bovine type Ⅱ collagen in all groups except the blank group. After modeling, the blank and model groups were given normal saline by gavage, the other groups were given baricitinib tablets, and low-, medium-, and high-dose of Tongbi Granule by gavage respectively, once a day, for continual four weeks. HE staining was performed to observe pathological synovial tissue. Serum Hepc and interleukin 6 (IL-6) levels were measured by ELISA. The mRNA relative expressions of JAK2, STAT3, suppressor of cytokine signaling (SOCS) 1, and SOCS3 in synovium were determined by RT-PCR. Western blot was used to test the protein expressions of JAK2, p-JAK2, STAT3, p-STAT3, SOCS1 and SOCS3 in synovium. Results In the model group, there were defects of synovial epithelium, severe synovial hyperplasia, disordered arrangement, and a large number of inflammatory cell infiltration and pannus formation. However, all administration groups showed reduction of synovial inflammation, the positive control group was better than the high-dose Tongbi Granule group, and the medium- and high-dose groups was better than the low-dose group. Compared with model group, arthritis index scores, and levels of serum Hepc and IL-6 were significantly lower in all drug administration groups (P<0.01). Compared with the positive control group, the arthritis index scores, serum Hepc and IL-6 levels in low- and medium-dose Tongbi Granule groups were higher (P<0.05). Compared with model group, the mRNA and protein expressions of JAK2 and STAT3, as well as the protein expressions of p-JAK2 and p-STAT3 were lower (P<0.05), while the mRNA and protein expressions of pathway inhibitors SOCS1 and SOCS3 were higher in positive control group and low-, medium-, and high-dose Tongbi Granule groups (P<0.05). Compared with positive control group, the mRNA and protein expressions of JAK2 and STAT3, and the protein expressions of p-JAK2 and p-STAT3 were higher in Tongbi Granule groups of various doses (P<0.05), while the mRNA and protein expressions of SOCS1 and SOCS3 were lower (P<0.05). Conclusion Tongbi Granule can relieve synovial inflammation in CIA rats, and its mechanism may be related to inhibiting JAK2/STAT3 signaling pathway and reducing the expression of Hepc.
〔Keywords〕 rheumatoid arthritis; collagen-induced arthritis; Chinese medicines; Tongbi Granule; hepcidin; janus kinase 2/signal transduction and activator of transcription 3 signaling pathway
类风湿关节炎(rheumatoid arthritis, RA)是一种临床常见的免疫介导性疾病,以持续的滑膜炎症和不可逆的软骨、骨损伤为主要临床特点[1]。随着对RA发病机制研究的不断深入,对小分子靶向药和生物制剂的探索使用,RA的临床缓解率已经得到了提高,但仍有部分患者迁延难愈[2]。且常规治疗策略中糖皮质激素、抗风湿药的大剂量、频繁和长期给药,不可避免地导致不良反应,患者依从性差[3]。滑膜炎和骨破坏是RA治疗的主要切入点,但在临床中RA的滑膜炎和骨破坏并非完全一致。当滑膜炎症被控制、病情活动度逐渐降低时,软骨损伤和骨侵蚀仍可继续发展[4];即使是针对非炎症的RA治疗,以破骨细胞为靶点同样可以缓解其骨破坏[5]。因此,在控制关节炎症的同时,寻找滑膜炎和骨破坏机制中共同的作用靶点,具有重要临床意义[6]。
铁调素(hepcidin, Hepc)具有调节机体铁状态、参与炎症反应、增强机体防御机制的重要作用,Hepc作为一种炎症介质参与了RA滑膜炎的发病,还是破骨细胞生成的关键调节因子,研究发现,Hepc的过表达可能与RA滑膜炎和骨破坏共同相关[7]。炎症信号Janus激酶(janus kinase, JAK)2/信号转导子和转录激活子(signal transduction and activator of transcription, STAT)3通路与Hepc的分泌相互关联促进,是调节Hepc的主要信号通路[8]。免疫反应时,炎症因子白细胞介素-6(interleukin-6, IL-6)与细胞受体结合激活STAT3,激活的STAT3与Hepc启动子结合进而增加Hepc的水平,是Hepc的调控因子[9]。
通痹颗粒是由当归、黄芪、白芥子、血竭、甘草、僵蚕等多种药物组成,用于治疗血虚痰瘀证RA活动期患者。前期研究表明,通痹颗粒对RA滑膜炎和骨破坏均有一定改善作用[10-12],但具体机制尚未完全明确。本实验通过研究通痹颗粒对RA模型胶原诱导性关节炎(collagen-induced Arthritis, CIA)大鼠Hepc、JAK2/STAT3信号通路、IL-6及细胞信号因子传导抑制体(suppressor of cytokine signaling, SOCS)的作用,进一步明确通痹颗粒治疗RA的可能作用机制,以期为中药治疗RA研究提供依据并指导临床治疗。
1 材料与方法
1.1 实验动物
雌性健康SPF级SD大鼠36只,体质量(200±20) g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004。大鼠饲养于湖南中医药大学SPF级中心实验室,室温20~25 ℃,相对湿度40%~60%,通风、光照良好,适应性饲养1周后开始实验。本实验严格按照伦理委员会的审查执行,伦理审批号:20201010-35。
1.2 主要药物与试剂
通痹颗粒(湖南中医药大学第一附属医院院内制剂,主要成分是当归、黄芪、血竭、白芥子、僵蚕、甘草等,规格:10 g×6包);巴瑞替尼片(美国礼来公司,批号:H20190039,规格:2 mg×28片)。
牛Ⅱ型胶原(北京凯诗源生物科技有限公司,货号:T07-0597);完全弗氏佐剂(美国Sigma公司,批号:F5881);兔抗JAK2试剂盒、兔抗STAT3试剂盒、兔抗p-STAT3试剂盒(北京Bioss公司,货号:bs-23003R、bsm-52235R、bs-22386R);兔抗p-JAK2试剂盒、兔抗SOCS1试剂盒、兔抗SOCS3试剂盒(美国Affinity公司,货号:AF3024-100、AF5378、DF6133);Hepcidin ELISA试剂盒(上海齐源生物科技有限公司,货号:E4693-100);IL-6 ELISA试剂盒(武汉艾迪抗生物科技有限公司,货号:AD40134)。
1.3 主要仪器
荧光定量RCP仪(美国Bio-rad公司,型号:CFX);超微量分光光度计(美国Thermo公司, 型号:NanoDrop2000);电泳仪、转膜仪(中国北京六一有限公司,型号:DYY-6C、DYCZ-40D);生物样品均质仪(杭州奥盛公司,型号:BioPrep-24);化学发光成像系统(广州勤翔有限公司,型号:Chemiscope6100)。
1.4 造模与分组
将实验大鼠随机分为6组:空白组、模型组、阳性对照组和通痹颗粒低、中、高剂量组,每组6只。空白组不予处理,其余各组予牛Ⅱ型胶原诱导造模,具体如下:取牛Ⅱ型胶原溶解于冰醋酸并充分乳化,将乳化后的溶液与完全弗氏佐剂充分混合,制备牛Ⅱ型胶原试剂;将配制好的试剂皮下注射于大鼠于尾部进行初次免疫,量约为0.2 mg,2周后再以0.1 mg于尾部进行再次免疫;4周后进行模型判定,当免疫后CIA大鼠关节炎指数评分≥6分,则为造模成功[10]。
1.5 实验给药
造模成功后,空白组、模型组予等量生理盐水灌胃,其他各组药物均按照人-大鼠体表面积进行换算,以正常人体质量70 kg进行计算,大鼠体质量平均为210 g,换算系数6.3[13]。其中,阳性对照组以巴瑞替尼片换算为人临床等效剂量,换算后的等效剂量为0.18 mg/(kg·d);通痹颗粒低、中、高剂量组分别换算为等效剂量的1/2、1、2倍,换算后分别为0.9、1.8、3.6 g/(kg·d)。均每天灌胃1次,连续4周。
1.6 取材及指标检测
1.6.1 关节炎指数评分 在造模成功后(第0天)及药物治疗过程(第7、14、21、28天)共计5次评分,根据大鼠关节受累程度不同进行相应的评分,具体如下:无任何关节红肿为0分;仅足趾关节红肿评为1分;足底及足趾均红肿评为2分;踝关节以下全部红肿评为3分;全部足踝关节均红肿则评为4分。将大鼠4个关节的评分加起来所得分数即为大鼠的关节炎指数评分,最大值为16分[14]。关节炎指数评分越高,则大鼠关节炎症状越严重。
1.6.2 取材及处理 治疗4周后处死所有大鼠,予以腹主动脉采血,4 ℃静置4 h,3 500 r/min离心10 min(离心半径15 cm),取上清液用于血清Hepc、IL-6水平检测;将大鼠的左膝关节滑膜剥离,福尔马林液固定,用于滑膜组织病理形态学观察;将大鼠的右膝关节滑膜剥离,放入液氮中速冻,-80 ℃条件下封存,用于JAK2/STAT3信号通路相关基因和蛋白检测。
1.6.3 滑膜组织病理学观察 取固定好的滑膜组织,石蜡包埋,制作切片,HE染色,光镜下(×200)行组织形态学观察。
1.6.4 酶联免疫吸咐法测定各组大鼠血清Hepc、IL-6水平 取离心好的血清室温静置30 min,使用酶联免疫吸咐法测定血清Hepc、IL-6水平,具体流程严格按照试剂盒说明书执行。
1.6.5 逆转录-聚合酶链反应法测定滑膜组织中JAK2、STAT3、SOCS1、SOCS3的mRNA相对表达量 使用Trizol法提取滑膜组织的总RNA,超微量分光光度计检测RNA的浓度和纯度,逆转录后获取互补的cDNA,使用逆转录-聚合酶链反应进行定量扩增。具体为:预变性95 ℃ 10 min;95 ℃ 15 s→60 ℃
30 s,扩增循环40次。以GAPDH为内参,对目的基因的扩增溶解曲线进行逆转录-聚合酶链反应程序分析,采用2-△△ct法计算目的mRNA的相对表达量。基因引物序列详见表1。
1.6.6 Western blot法检测滑膜组织中JAK2、p-JAK2、STAT3、p-STAT3、SOCS1、SOCS3的蛋白表达
将粉碎的滑膜组织进行冰上裂解,裂解后离心并取上层清液,使用BCA法测定相关蛋白浓度,Western blot法电泳后转印于NC膜封闭过夜,将一抗按比例稀释后与膜一起孵育,4 ℃过夜,次日室温放置90 min,PBST洗3次;二抗与膜共同室温孵育90 min后,PBST洗3次,进行ECL显色,并曝光。曝光后底片扫满,以GAPDH为内参,用化学发光成像系统软件分析分子量和灰度值。
1.7 统计学分析
采用SPSS 25.0软件,计量资料以“x±s”表示。若满足正态分布和方差齐性者,行单因素方差分析和LSD检验;方差不齐者则采用Tamhane' T2法。以P<0.05为差异具有统计学意义。
2 结果
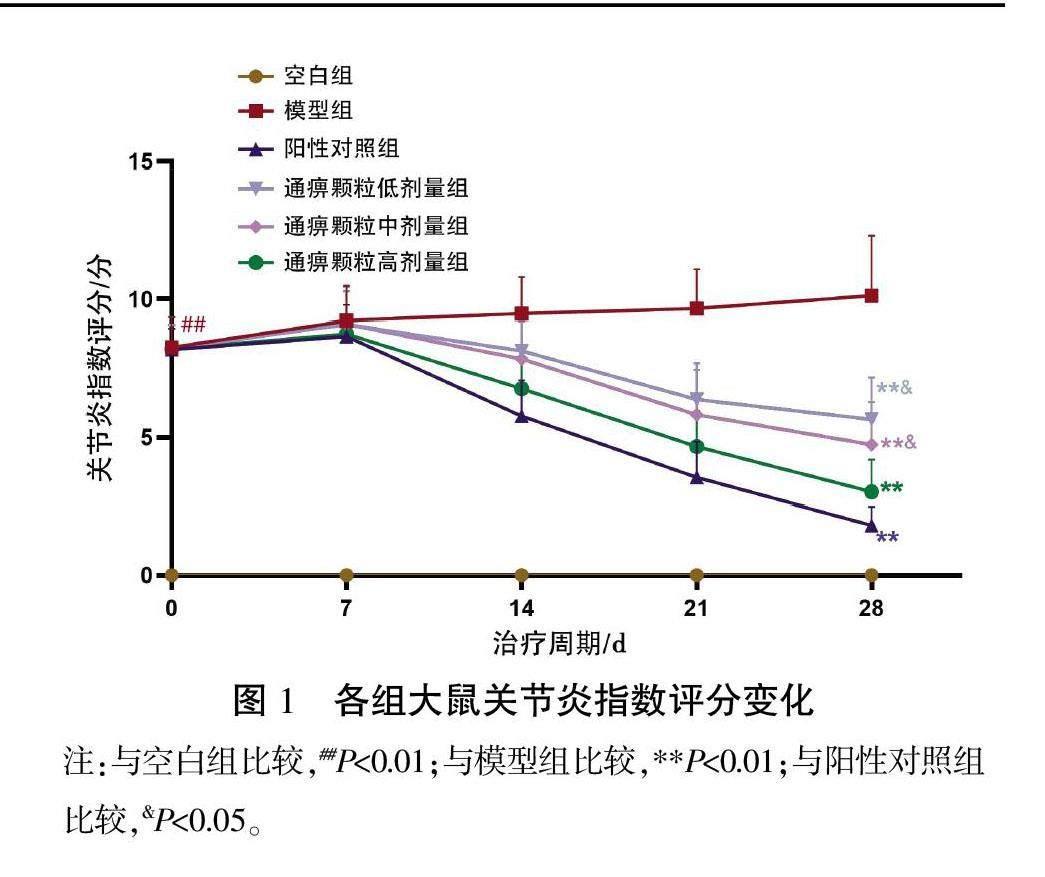
2.1 各组大鼠关节炎指数评分变化
造模后,与空白组相比,其余各组大鼠关节炎指数积分显著上升(P<0.01)。经治疗7 d后,阳性对照组和通痹颗粒各剂量组关节炎指数评分达到高峰。经治疗28 d后,与模型组相比,通痹颗粒高、中、低剂量组及阳性对照组大鼠关节炎指数评分均降低,差异有统计学意义(P<0.01),与阳性对照组比较,通痹颗粒中、低剂量组CIA大鼠关节炎指数评分均增加,差异有统计学意义(P<0.05)。详见图1。
2.2 各组大鼠滑膜组织病理学观察
空白组滑膜上皮细胞形态结构正常,脂肪细胞无明显异常,未见明显炎症增生;模型组见滑膜上皮结构缺损,滑膜重度增生,排列紊乱,并有大量炎症细胞浸润和多个血管翳形成;阳性对照组滑膜结构基本正常,滑膜轻度增生,少量炎症细胞,较模型组明显改善;通痹颗粒低剂量组见滑膜上皮结构缺损,滑膜重度增生,炎症细胞浸润及血管翳形成,较模型组稍轻;通痹颗粒中、高剂量组均见中度滑膜增生及炎症细胞浸润,较低剂量组均减轻,且高剂量组炎症细胞浸润及滑膜增生比中剂量组略轻。详见图2。
2.3 各组大鼠血清Hepc、IL-6水平比较
与空白组比较,模型组和各给药组大鼠血清Hepc、IL-6水平均升高(P<0.05)。与模型组比较,通痹颗粒高、中、低剂量组和阳性对照组血清Hepc、IL-6水平均降低(P<0.05)。与阳性对照组比较,通痹颗粒中、低剂量组血清Hepc、IL-6水平均升高(P<0.05),通痹颗粒高剂量组血清Hepc、IL-6水平差异无统计学意义(P>0.05)。详见表2。
2.4 各组大鼠滑膜组织JAK2、STAT3、SOCS1、SOCS3的mRNA表达量比较
与空白组比较,其余各组大鼠滑膜JAK2、STAT3的mRNA表达均升高(P<0.05),SOCS1、SOCS3的mRNA表达均降低(P<0.05)。与模型组比较,通痹颗粒高、中、低剂量及阳性对照组JAK2、STAT3的mRNA表达均降低(P<0.05),SOCS1、SOCS3的mRNA表达均升高(P<0.05)。与阳性对照组比较,通痹颗粒各剂量组JAK2、STAT3的mRNA表达均升高(P<0.05),SOCS1、SOCS3的mRNA表达均降低(P<0.05)。详见表3。
2.5 各组大鼠滑膜组织JAK2、p-JAK2、STAT3、p-STAT3、SOCS1、SOCS3蛋白表达比较
与空白组比较,其余各组大鼠滑膜JAK2、p-JAK2、STAT3、p-STAT3蛋白表达均升高(P<0.05),SOCS1、SOCS3蛋白表达均降低(P<0.05)。与模型组比较,通痹颗粒高、中、低剂量组和阳性对照组滑膜JAK2、p-JAK2、STAT3、p-STAT3的蛋白表达均降低(P<0.05),SOCS1、SOCS3的蛋白表达均升高(P<0.05)。与阳性对照组比较,通痹颗粒各剂量组JAK2、p-JAK2、STAT3、p-STAT3的蛋白表达均升高(P<0.05),SOCS1、SOCS3的蛋白表达均降低(P<0.05)。详见图2、表4。
3 讨论
RA是一种炎症性、慢性自身免疫性关节疾病,当固有免疫和适应性免疫系统发生异常时,免疫耐受失衡诱发的损伤显得尤为关键,这一系列事件将导致持续的关节炎症、增生性滑膜炎,并最终引起基底层软骨和软骨下骨的损伤,导致永久性关节破坏、畸形和功能丧失[15]。由于RA常规治疗药物并不能完全满足临床,且存在药物相关的耐药性、经济负担和毒副作用等原因[16],中医药辨证论治的独特优势在RA治疗中逐渐凸显出来。中医从整体入手,扶正与祛邪并行,具有多靶点调节、疗效确切、毒副作用小等特点,在临床中得到了广泛应用。
RA属于中医学“尪痹”“骨骱痹”等范畴。《诸病源候论·风湿痹候》载:“由气血虚,则受风湿,而成此病。”《医级·痹》云:“痹非三气,患在痰瘀。”素体正气亏虚,则易感受风寒湿邪为患;久痹不愈,则易成瘀血痰浊而迁延受损。基于RA的病机特点和前期研究[17-18],本课题组提出了RA的基本病机是“虚、瘀、痰”,以此为基础制定了益气养血、化痰逐瘀的经验协定方剂通痹颗粒。方中当归为君,温养活血,舒筋通脉;黄芪为臣,充养元气,配伍当归以共资气血生化,气血双补;血竭散瘀和血止痛,僵蚕、白芥子豁痰散结、通利消肿,皆为佐药;甘草为使,缓急温中健脾,调和诸药。既往课题组研究表明,通痹颗粒对RA滑膜炎和骨破坏均有一定的改善作用[19]。黄芪已被证实可调节阿尔茨海默病模型小鼠脑组织Hepc的表达[19],并可通过JAK2、STAT3免疫炎症相关通路治疗RA[20];当归的有效成分当归多糖对慢性炎症贫血大鼠Hepc的表达具有抑制效应[21]。因此,通痹颗粒可能通过Hepc和JAK2/STAT3信号通路对RA发挥治疗作用。
Hepc是一种具有抗菌特性的肝源性肽,最早于20世纪初从人的血清和尿液中提纯发现,主要由炎症细胞因子尤其是IL-6诱导产生,具有调节铁代谢和参与人体炎症防御反应的重要功能[22]。研究表明,Hepc可以反映RA患者的疾病活动度,其高表达可以直接加剧RA的炎症程度,是RA疾病活动度增强的重要原因[23]。促炎因子在RA的病变进程中发挥重要作用,肿瘤坏死因子(tumor necrosis factor, TNF)、IL-6和粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GMCSF)等驱动了RA持续性滑膜炎和全身并发症[24]。IL-6作为RA临床发病前的关键调节因子,在RA早期滑膜炎的维持和造成关节破坏中发挥主要介导效应。研究发现,与健康者对比,RA组血清Hepc水平显著升高,且与IL-6的表达和RA疾病活动度评分呈正相关,提示Hepc可能直接参与了慢性炎症的发病过程[25];通过药物对IL-6进行抑制,Hepc表达量明显减少,证明IL-6与Hepc之间具有高度相关性[26]。另有研究证实,Hepc在RA中的升高与骨破坏标志物正相关,Hepc的分泌增加促进破骨细胞生成和骨小梁破坏丢失,提示Hepc可能参与RA的骨破坏[27];而Hepc的负调节因子红富铁激素可调节成骨细胞中骨形成蛋白的信号传导、减少核因子-κβ受体活化因子配体的产生,限制破骨细胞生成,具有骨保护作用[28]。因此,Hepc、IL-6与RA的滑膜炎和骨破坏共同相关。本研究发现,通痹颗粒对CIA大鼠滑膜炎症具有明显改善作用,可减少滑膜增生和炎症细胞浸润,并且对大鼠关节炎指数评分具有一定降低作用。与模型组相比,阳性对照组和通痹颗粒各剂量给药组均能有效降低CIA血清Hepc和IL-6水平,且阳性对照组疗效最佳,通痹颗粒高剂量与阳性对照组之间无明显差异,提示Hepc与RA的炎症状态存在一定正相关性,推测通痹颗粒缓解RA滑膜炎和骨破坏的机制可能与降低血清的Hepc和IL-6水平有关,且通痹颗粒的疗效可能存在一定的剂量依耐性。
Hepc主要通过与细胞表面的受体膜铁转运蛋白(ferroportin, FPN)结合后可激活JAK2蛋白激酶,促进FPN磷酸化以及内化降解,并通过调节铁代谢影响成骨功能[8]。JAK2/STAT3通路受多种细胞因子调节,尤其是IL-6和γ干扰素[29],IL-6可刺激JAK/STAT信号通路促使Hepc表达,既可加重RA的炎症反应,还可导致贫血、骨破坏。而SOCS家族成员作为JAK/STAT信号通路的代表性负调节因子,可通过调节T细胞的分化和功能参与免疫耐受[30]。相关研究证实,IL-6可通过JAK2/STAT3信号通路降低十二指肠铁转运蛋白1水平,刺激Hepc的产生[26];而Hepc也可与膜转铁蛋白结合激活JAK2,并磷酸化转录因子STAT3,进而促进IL-6、TNF的表达[31];另外,抑制JAK2/STAT3信号通路可以使Hepc的表达降低,SOCS的转录表达增加,下调IL-6等细胞因子的水平进而减轻RA的骨破坏[8]。Hepc与JAK2/STAT3信号通路相互作用形成恶性循环,从而使RA滑膜炎及骨破坏不断加深加重。通过本实验进一步研究发现,与模型组对比,阳性对照组和通痹颗粒各剂量给药组JAK2/STAT3信号通路相关因子mRNA和蛋白表达均显著降低,而通路抑制因子SOCS1、SOCS3的表达明显升高,提示通痹颗粒对JAK2/STAT3信号通路具有一定的调节作用。
综上所述,通痹颗粒能有效改善CIA大鼠的滑膜炎及关节炎指数评分,对RA具有多靶点的治疗作用,降低炎症因子IL-6水平,其作用机制与抑制JAK2/STAT3信号通路进而减少Hepc的表达有关。本研究还发现,通痹颗粒对Hepc和JAK2/STAT3信号通路的调节作用与药物浓度有关,因此,临床探索最合理有效的治疗剂量也是接下来的研究重点之一;研究还可以结合网络药理学,从细胞分子水平进一步探讨通痹颗粒对破骨细胞的具体作用靶点及相关通路,以期为治疗RA提供新的方法与药物。
参考文献
[1] GRAVALLESE E M, FIRESTEIN G S. Rheumatoid arthritis-common origins, divergent mechanisms[J]. The New England Journal of Medicine, 2023, 388(6): 529-542.
[2] FIRESTEIN G S, MCINNES I B. Immunopathogenesis of rheumatoid arthritis[J]. Immunity, 2017, 46(2): 183-196.
[3] SHEN Q Y, DU Y Z. A comprehensive review of advanced drug delivery systems for the treatment of rheumatoid arthritis[J]. International Journal of Pharmaceutics, 2023, 635: 122698.
[4] HAYER S, BAUER G, WILLBURGER M, et al. Cartilage damage and bone erosion are more prominent determinants of functional impairment in longstanding experimental arthritis than synovial inflammation[J]. Disease Models & Mechanisms, 2016, 9(11): 1329-1338.
[5] LARROUTURE Q C, CRIBBS A P, RAO S R, et al. Loss of mutual protection between human osteoclasts and chondrocytes in damaged joints initiates osteoclast-mediated cartilage degradation by MMPs[J]. Scientific Reports, 2021, 11(1): 22708.
[6] ZHU M L, DING Q, LIN Z X, et al. New targets and strategies for rheumatoid arthritis: From signal transduction to epigenetic aspect[J]. Biomolecules, 2023, 13(5): 766.
[7] CHEN Y T, XU W, YANG H, et al. Serum levels of hepcidin in rheumatoid arthritis and its correlation with disease activity and Anemia: A meta-analysis[J]. Immunological Investigations, 2021, 50(2/3): 243-258.
[8] 邓国倩, 柳玉佳, 吴伊莹, 等. 铁调素在类风湿关节炎骨代谢中的作用[J]. 风湿病与关节炎, 2023, 12(3): 62-66.
[9] LANSER L, PLAIKNER M, SCHROLL A, et al. Tissue iron distribution in patients with anemia of inflammation: Results of a pilot study[J]. American Journal of Hematology, 2023, 98(6): 890-899.
[10] 柳玉佳, 欧慧萍, 吴伊莹, 等. 通痹颗粒对胶原性关节炎大鼠RANKL/RANK/OPG系统及MMP-3、TIMP-1表达的影响[J]. 中医药导报, 2021, 27(10): 22-26, 48.
[11] 柳玉佳, 王莘智, 吴伊莹, 等. 通痹颗粒对胶原性关节炎大鼠Wnt信号通路DKK1、β-catenin表达的影响[J]. 江苏中医药, 2020, 52(2): 83-86.
[12] 龙林钰, 柳玉佳, 吴伊莹, 等. 通痹颗粒治疗类风湿关节炎临床疗效及对氧化应激的影响[J]. 湖南中医杂志, 2023, 39(2): 18-21.
[13] 刘 涛, 季 光. 科研思路与方法[M]. 2版. 北京: 中国中医药出版社, 2016: 95-96, 220-221.
[14] 王敏智, 荆生龙, 何小鹃, 等. CIA大鼠足跖大小与关节积分关联研究[J]. 中国中医基础医学杂志, 2013, 19(12): 1417-1419.
[15] CIOBANU D A, POENARIU I S, CRNGU L I, et al. JAK/STAT pathway in pathology of rheumatoid arthritis (Review)[J]. Experimental and Therapeutic Medicine, 2020, 20(4): 3498-3503.
[16] PRASAD P, VERMA S, SURBHI, et al. Rheumatoid arthritis: Advances in treatment strategies[J]. Molecular and Cellular Biochemistry, 2023, 478(1): 69-88.
[17] 吴伊莹, 柳玉佳, 廖亮英, 等. 基于数据挖掘的旷惠桃教授治疗类风湿关节炎的方药规律研究[J]. 湖南中医药大学学报, 2023, 43(1): 88-94.
[18] 柳玉佳, 王莘智, 旷惠桃, 等. 类风湿关节炎中医证候、证素分布的临床研究[J]. 北京中医药大学学报, 2020, 43(1): 79-83.
[19] 董贤慧, 贺小平, 张天赐, 等. 淫羊藿、黄芪、葛根有效组分复方介导铁调素对HT22细胞中ADAM17表达的影响[J]. 中国中药杂志, 2021, 46(23): 6224-6230.
[20] 姜 帆, 李慧敏, 林婉娜, 等. 基于网络药理学探究黄芪桂枝五物汤治疗类风湿性关节炎的机制[J]. 广东药科大学学报, 2023, 39(4): 49-58.
[21] 李明明, 吴 俊, 张琪琳, 等. 当归多糖抑制慢性炎症贫血大鼠体内铁调素的表达[J]. 中国医院药学杂志, 2016, 36(8): 639-643.
[22] NEMETH E, GANZ T. Hepcidin and iron in health and disease[J]. Annual Review of Medicine, 2023, 74: 261-277.
[23] VAN SANTEN S, VAN DONGEN-LASES E C, VEGT F D, et al. Hepcidin and hemoglobin content parameters in the diagnosis of iron deficiency in rheumatoid arthritis patients with anemia[J]. Arthritis and Rheumatism, 2011, 63(12): 3672-3680.
[24] RIDGLEY L A, ANDERSON A E, PRATT A G. What are the dominant cytokines in early rheumatoid arthritis?[J]. Current Opinion in Rheumatology, 2018, 30(2): 207-214.
[25] 张道雨, 刘 新, 唐 琪, 等. 北疆地区类风湿关节炎合并贫血患者血清中Hepc、s-HJV水平与疾病活动的相关性分析[J]. 中国医药导报, 2023, 20(17): 127-131.
[26] ZHAO Y, WANG C Q, YANG T Y, et al. Chlorogenic acid alleviates chronic stress-induced duodenal ferroptosis via the inhibition of the IL-6/JAK2/STAT3 signaling pathway in rats[J]. Journal of Agricultural and Food Chemistry, 2022, 70(14): 4353-4361.
[27] GUO H H, XIONG L, PAN J X, et al. Hepcidin contributes to Swedish mutant APP-induced osteoclastogenesis and trabecular bone loss[J]. Bone Research, 2021, 9: 31.
[28] CASTRO-MOLLO M, GERA S, RUIZ-MARTINEZ M, et al. The hepcidin regulator erythroferrone is a new member of the erythropoiesis-iron-bone circuitry[J]. eLife, 2021, 10: e68217.
[29] KOUR G, CHOUDHARY R, ANJUM S, et al. Phytochemicals targeting JAK/STAT pathway in the treatment of rheumatoid arthritis: Is there a future?[J]. Biochemical Pharmacology, 2022, 197: 114929.
[30] YOSHIMURA A, ITO M, MISE-OMATA S, et al. SOCS: Negative regulators of cytokine signaling for immune tolerance[J]. International Immunology, 2021, 33(12): 711-716.
[31] DOMENICO I D, ZHANG T Y, KOENING C L, et al. Hepcidin mediates transcriptional changes that modulate acute cytokine-induced inflammatory responses in mice[J]. The Journal of Clinical Investigation, 2010, 120(7): 2395-2405.

