基于线粒体钙稳态探讨血府逐瘀汤对冠心病血瘀证模型大鼠的作用机制
黄舒淳 张秋雁 杨漾 李静 匡慧芳 王明韵

〔摘要〕 目的 基于线粒体钙稳态探讨血府逐瘀汤治疗冠心病血瘀证的作用机制。方法 150只SD大鼠随机均分为正常组、假手术组(只穿线不结扎)、模型组、阿托伐他汀钙组(0.90 mg/kg·d,以下简称他汀组)以及血府逐瘀汤低、中、高剂量组[3.51、7.02、14.04 g/(kg·d),以下简称低、中、高剂量组],每组6只。除正常组和假手术组外,其他组均通过结扎大鼠冠状动脉左前降支制备冠心病血瘀证模型,造模成功24 h后灌胃给药,连续灌胃7 d,取各组大鼠左室缺血区心肌组织。HE染色观察样本坏死病变情况;线粒体钙离子探针检测线粒体内钙离子的荧光强度;定磷法检测心肌细胞Ca2+-Mg2+-ATP酶活性;免疫组织化学检测心肌组织线粒体钙单向转运蛋白(mitochondrial calcium uniporter, MCU)、心肌肌浆网钙离子ATP酶(sarco/sndoplasmic reticulum Ca2+-ATPase 2a, SERCA2a)、瞬时受体电位通道3(transient receptor potential canonical 3, TRPC3)、钙释放激活钙通道1(calcium release-activated calcium channel protein 1, ORAI1)、半胱氨酸(cysteinyl aspartate specific proteinase, Caspase)-3、Caspase-9的蛋白表达。结果 与正常组相比,模型组大鼠心肌组织可见细胞排列紊乱,横纹模糊,大量心肌细胞坏死,线粒体Ca2+平均荧光强度、MCU、TRPC3、ORAI1、Caspase-3、Caspase-9的AOD值明显升高(P<0.01),Ca2+-Mg2+-ATP酶活性、SERCA2a的AOD值明显下降(P<0.01);与模型组相比,他汀组以及血府逐瘀汤各剂量组,心肌细胞水肿程度减轻,炎性细胞浸润减少,细胞排列相对紧密,细胞病理损伤程度有所缓解,他汀组以及血府逐瘀汤各剂量组的SERCA2a的AOD值显著上升(P<0.01),线粒体Ca2+平均荧光强度、MCU、TRPC3、ORAI1、Caspase-9的AOD值显著下降(P<0.05,P<0.01),血府逐瘀汤各剂量组的Ca2+-Mg2+-ATP酶活性显著上升(P<0.05,P<0.01)以及Caspase-3的AOD值显著下降(P<0.05,P<0.01)。结论 血府逐瘀汤可以调控冠心病血瘀证模型大鼠心肌线粒体钙离子转运,调节心肌细胞线粒体钙稳态,可能与上调SERCA2a的蛋白表达,下调MCU、TRPC3、ORAI1、Caspase-3、Caspase-9的蛋白表达相关。
〔关键词〕 血府逐瘀汤;冠心病;血瘀证;线粒体;钙超载
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.06.004
Mechanism of action of Xuefu Zhuyu Decoction on model rats of
coronary heart disease with blood stasis pattern based on
mitochondrial calcium homeostasis
HUANG Shuchun, ZHANG Qiuyan*, YANG Yang, LI Jing, KUANG Huifang, WANG Mingyun
Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To explore the mechanism of action of Xuefu Zhuyu Decoction (XFZYD) in treating coronary heart disease (CHD) with blood stasis pattern based on mitochondrial calcium homeostasis. Methods A total of 150 SD rats were randomized into normal group, sham-operated group (only threading without ligation), model group, atorvastatin calcium group (0.90 mg·kg-1·d-1, hereinafter referred to as statin group), and low-, medium-, and high-dose XFZYD groups (3.51, 7.02, 14.04 g·kg-1·d-1, hereinafter referred to as low-, medium-, and high-dose groups), with six rats in each group. Except for the normal and sham-operated groups, the other groups were prepared for CHD with blood stasis pattern models by ligating the left anterior descending coronary artery of the rats. After 24 hours of successful modeling, the rats were given continuous intragastric administration for 7 d. The myocardial tissue of left ventricular ischemic area in rats of each group was taken. HE staining was used to observe the necrosis of the samples. The fluorescence intensity of calcium ions in mitochondria was determined by mitochondrial calcium ion probe. The Ca2+-Mg2+-ATPase activity of myocardial cells was examined by phosphorus determination method. Immunohistochemistry was used to check the protein expressions of mitochondrial calcium uniporter (MCU), sarco/endoplasmic reticulum Ca2+-ATPase 2a (SERCA2a), transient receptor potential canonical 3 (TRPC3), calcium release-activated calcium channel protein 1 (ORAI1), cysteinyl aspartate specific proteinase-3 (Caspase-3), and cysteinyl aspartate specific proteinase-9 (Caspase-9). Results Compared with the normal group, the model group showed disordered cell arrangement, blurred transverse stripes, necrosis of a large number of myocardial cells, a significant increase in mitochondrial Ca2+ average fluorescence intensity and AOD values of MCU, TRPC3, ORAI1, Caspase-3, and Caspase-9 (P<0.01), and an obvious decrease in Ca2+-Mg2+-ATPase activity and AOD value of SERCA2a in the myocardial tissue of rats (P<0.01). Compared with the model group, the statin group and low-, medium-, and high-dose groups showed reduced myocardial cell edema, inflammatory cell infiltration, and cell pathological damage as well as relatively tight cell arrangement, meanwhile, the AOD value of SERCA2a in those groups significantly increased (P<0.01), and the average fluorescence intensity of mitochondrial Ca2+, AOD values of MCU, TRPC3, ORAI1, and Caspase-9 decreased significantly (P<0.05, P<0.01). In addition, the Ca2+-Mg2+-ATPase activity in low-, medium-, and high-dose groups increased significantly (P<0.05, P<0.01), while the AOD value of Caspase-3 decreased significantly (P<0.05, P<0.01). Conclusion XFZYD can regulate myocardial mitochondrial calcium ion transport and mitochondrial calcium homeostasis in rats of CHD with blood stasis pattern, which may be related to up-regulating the protein expression of SERCA2a and down-regulating the protein expressions of MCU, Caspase-3, and Caspase-9.
〔Keywords〕 Xuefu Zhuyu Decoction; coronary heart disease; blood stasis pattern; mitochondria; calcium overload
冠心病(coronary heart disease, CHD)是冠状动脉粥样病变导致心肌缺血或坏死的心血管疾病,归属于中医学“胸痹”“心痛”的范畴,血瘀证是CHD中最常见的证型之一[1]。CHD的发病机制尚不明确,多种因素和病理机制共同作用于本病,而线粒功能障碍是缺血心肌细胞受损的基本环节,线粒体钙超载是导致线粒体结构与功能障碍的重要因素[2-3]。心肌缺血发生发展的过程中线粒体平衡被打破,ATP生成减少导致细胞内Ca2+浓度上升,诱发线粒体基质摄入钙离子,引发线粒体钙超载,进一步加剧心肌缺血损伤。因此,减轻线粒体钙超载对保护缺血心肌细胞有着重要的意义。血府逐瘀汤具有活血化瘀、行气止痛的功效,是临床上治疗CHD的常用方。血府逐瘀汤干预CHD的作用机制以抗血小板集聚,调节血脂代谢,改善循环抗心肌缺血等为主[4]。本课题组前期通过各项研究证实,血府逐瘀汤可能是通过保护血管内皮、调控线粒体自噬和代谢、抑制心肌细胞凋亡等机制,发挥保护缺血心肌的作用[5-7]。本研究以线粒体钙稳态为切入口,探讨血府逐瘀汤调控线粒体钙稳态实现心肌缺血损伤保护的作用机制,为中医药治疗CHD血瘀证的作用机制提供新的思路与方法。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠150只,体质量220~240 g,由湖南斯莱克景达实验动物有限公司提供。动物合格证号:NO.430727211100715381,动物许可证号: SYXK(湘)2013-0005,伦理批号:LL2021040701。饲养于湖南中医药大学实验动物中心清洁级动物房,温度20~25 ℃,相对湿度55%~60%,自由摄食饮水。
1.2 主要药品、试剂
血府逐瘀汤:当归9 g,生地黄9 g,桃仁12 g,红花9 g,枳壳6 g,牛膝9 g,川芎4.5 g,柴胡3 g,赤芍6 g,甘草6 g,桔梗4.5 g;均购自湖南中医药大学第一附属医院门诊药房,经湖南中医药大学第一附属医院制剂中心鉴定,符合用药标准。药液制备:加10倍量的水浸泡药物30 min,加热回流提取1 h,趁热滤过;再次加入8倍量的水按上法煎煮1 h;合并两次滤液,浓缩定容为含生药量1.404 g/mL的药液。阿托伐他汀片(福建东瑞制药有限公司,规格:10 mg×28片,国药准字:H20193043,产品批号:042206065)。
Ca2+-Mg2+-ATP酶试剂盒(批号:A0161-1-1,南京建成生物科技研究所);MCU抗体(批号:JM10-20)、SERCA2a抗体(批号:ER1803-57)、TRPC3抗体(批号:ER65609)均购自杭州华安生物技术有限公司;ORAI1抗体(批号:Df 7956,美国Affinity公司);Caspase-3抗体(批号:A11319)、Caspase-9抗体(批号:A11910)均购自美国Abclonal公司;Rhod-2 AM钙离子荧光探针[批号:40776ES,翌圣生物科技(上海)股份有限公司]。
1.3 主要仪器
台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司,型号:H1650R),倒置生物显微镜(北京中显恒业仪器仪表有限公司,型号:DSZ2000X),多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:MB-530),紫外可见分光光度计(上海天普分析仪器有限公司,型号:752),荧光定量RCP仪(美国Thermo公司,型号:PIKO REAL 96)。
1.4 动物模型制备
SD大鼠适应性喂养7 d,术前禁食水24 h。参考李仪奎教授编著的《中药药理实验方法学(第2版)》[8]提出的“血瘀证动物病理模型建立方法”进行动物造模。术前腹腔注射1%戊巴比妥钠(30 mg/kg)进行麻醉,麻醉后将大鼠固定在鼠板上。于颈部和左侧胸部备皮,行气管插管,连接小动物呼吸机,呼吸比设置为2∶1,呼吸频率为90次/min,潮气量为30 mL,连接BL-420F生物机能实验系统,观察并记录大鼠心电图变化。大鼠左侧胸部消毒后,于左前第4、5肋间开胸,皮肤切口长约3 cm,逐层钝性分离,使用小型拉钩钩住肋骨,两边拉开,充分暴露心脏,将心包膜撕开,并轻提左心耳,找到肺动脉圆锥与左心耳中间的冠脉左前降支(left anterior descending, LAD),距主动脉根部2 mm处,以此处为结扎标志,使用6/0无创缝合丝线轻轻穿过左心耳下缘的心肌浅层,将LAD结扎。以心电图ST段的改变及左室前壁向外膨胀发绀为造模成功标志,然后将心脏放回胸腔,关胸,逐层缝合。大鼠自主呼吸恢复后,拔出气管。假手术组仅穿线不结扎,正常组不施加任何干预措施,其余各组行完全结扎。术后肌注青霉素8万U/只×3 d抗感染。室内喂养,自由饮水摄食。
1.5 动物分组及给药
将各组SD大鼠随机分为正常组、假手术组、阿托伐他汀钙组(以下简称他汀组)以及血府逐瘀汤低、中、高剂量组(以下简称低、中、高剂量组)。在造模成功24 h后开始灌胃给药,1日1次,连续7 d。详见表1。
1.6 指标检测
第7天灌胃后,腹主动脉采血,处死动物,取出心脏,切取各组左室缺血区心肌,HE染色及免疫组织化学所用标本经生理盐水冲洗干净后,使用4%多聚甲醛固定;其余指标检测标本生理盐水冲洗干净后,存于无菌冻存管,液氮冰冻保存。
1.6.1 心肌组织病理学观察 将固定在4%多聚甲醛内的心肌组织样本制成4 μm的石蜡切片,在60 ℃的恒温箱中烘烤1~2 h。将切片浸置于二甲苯10 min×2次,再将组织切片于梯度(无水、95%、85%、75%)乙醇中进行清洗,每级5 min,再置于蒸馏水中5 min。苏木素染色约1~3 min,流水冲洗,PBS返蓝。伊红染色1~3 min,流水冲洗。梯度(无水、95%、85%、75%)乙醇脱水,每级5 min。再将切片浸置于二甲苯5 min×2次。中性树胶封片封固。在光学显微镜下观察心肌细胞的形态变化并采集图像。
1.6.2 线粒体钙离子荧光强度检测 将心肌组织剪碎,加入3 mL混合酶溶液(0.4%Ⅱ型胶原酶∶0.125%胰酶=2∶1),消化15 min后,弃去上清液。再在组织中加入3 mL混合酶溶液,37 ℃条件下消化8 min后,加入DMEM完全培养基中终止消化,吸取上清液。细胞悬液在1000 r/min条件下离心5 min后,加入5 mL红细胞裂解液重悬,室温裂解5 min。然后1000 r/min离心5 min,弃去上清液,PBS清洗后加入完全培养基重悬细胞。吸取掉细胞培养液后,加入稀释好的线粒体钙离子探针,重悬细胞。37℃细胞培养箱内孵育30 min,然后用不含血清的细胞培养液洗涤细胞3次。采用流式细胞仪进行线粒体钙离子强度检测。
1.6.3 心肌细胞Ca2+-Mg2+-ATP 酶活性检测 取大鼠心肌组织,称定准确质量后,按1∶9质量体积比加入蒸馏水后匀浆,3 000 r/min离心10 min,取上清液100 μL与2 000 μL定磷液匀浆,根据Ca2+-Mg2+-ATP酶测试盒的说明进行操作,按照定磷法检测心肌细胞Ca2+-Mg2+-ATP酶活性。蒸馏水调零,用1 cm光径于660 nm处检测吸光度值计算其活性。
1.6.4 免疫组织化学检测心肌组织SERCA2a、MCU、TRPC3、ORAI1、Caspase-3、Caspase-9的蛋白表达 将心肌组织从固定的多聚甲醛取出后,PBS冲洗,组织脱水后进行常规石蜡切片(4 μm),60 ℃恒温烤箱烘烤2 h;梯度(无水、95%、85%、75%)乙醇脱蜡复水。抗原修复一次,枸橼酸钠缓冲液(pH 6.0)放置微波炉中至沸腾后加入组织切片,断电,间隔5~10 min,重复1~2次,冷却置室温后取出切片,PBS冲洗3次,每次3 min。湿盒中进行一抗孵育:适当滴加稀释的一抗(SERCA2a、MCU、TRPC3、ORAI1、Caspase-9、Caspase-3),4 ℃过夜,PBS冲洗3次,每次5 min。滴加反应增强液,室温20 min,PBS洗3次,每次2 min。滴加二抗,37 ℃孵育60 min,PBS冲洗3次,每次5 min。滴加DAB显色,显微镜下观察显色结果,双蒸水终止反应。苏木素复染:3 min,水洗,盐酸乙醇分色,自来水中促蓝。75%、85%、95%、100%的乙醇,每级1~2 min。流水冲洗、复染、脱水透明,中性树胶封片。显微镜下观察,用Image J 图像分析系统分别测量每张切片中3个视野MCU、SERCA2a、TRPC3、ORAI1、Caspase-9、Caspase-3的面积积分光密度(integrated optical density, IOD)以及对应的面积(Area),并计算出平均光密度值(average optical density, AOD),AOD=IOD/Area。
1.7 统计学方法
采用SPSS 25.0软件进行统计处理,计量资料采用“x±s”表示,满足正态性者,不同组间相比采用单因素方差分析(One-WayANOVA),并进行组间的多重相比,方差齐时选择LSD法,方差不齐时选择Dunnett T3法;不满足正态性时选择秩和检验。以P<0.05差异具有统计学意义。
2 结果
2.1 血府逐瘀汤对CHD血瘀证模型大鼠心肌组织病理学形态的影响
正常组与假手术组,均未见明显病理形态改变,细胞形态规整,排列有序,横纹清晰;与正常组相比,模型组大鼠心肌组织可见细胞排列紊乱,横纹模糊,心肌细胞空泡变性,大量炎性细胞浸润,大量心肌细胞坏死;与模型组相比,他汀组和低、中、高剂量组,心肌细胞水肿程度减轻,炎性细胞浸润减少,细胞排列相对紧密,细胞病理损伤程度有所缓解;与他汀组相比,低、中、高剂量组的心肌细胞受损情况显著减轻;与低、中剂量组相比,高剂量组心肌病理损伤程度明显降低。详见图1。
2.2 血府逐瘀汤对CHD血瘀证模型大鼠心肌细胞线粒体Ca2+平均荧光强度的影响
与正常组和假手术组相比,模型组线粒体Ca2+平均荧光强度明显升高(P<0.01);与模型组相比,他汀组和低、中、高剂量组线粒体Ca2+平均荧光强度明显下降(P<0.01);与他汀组相比,中、高剂量组线粒体Ca2+平均荧光强度明显下降(P<0.05,P<0.01);与低剂量组相比,中、高剂量组线粒体Ca2+平均荧光强度明显下降(P<0.05,P<0.01);与中剂量组相比,高剂量组线粒体Ca2+平均荧光强度明显下降(P<0.05)。详见表2、图2。
2.3 血府逐瘀汤对CHD血瘀证模型大鼠心肌细胞Ca2+-Mg2+-ATP酶活性的影响
与正常组和假手术组相比,模型组Ca2+-Mg2+-ATP酶活性下降(P<0.05,P<0.01);与模型组相比,低、中、高剂量组的Ca2+-Mg2+-ATP酶活性升高(P<0.05,P<0.01);与他汀组相比,中、高剂量组Ca2+-Mg2+-ATP酶活性升高(P<0.05,P<0.01);与低剂量组相比,高剂量组Ca2+-Mg2+-ATP酶活性升高(P<0.01)。详见表3。
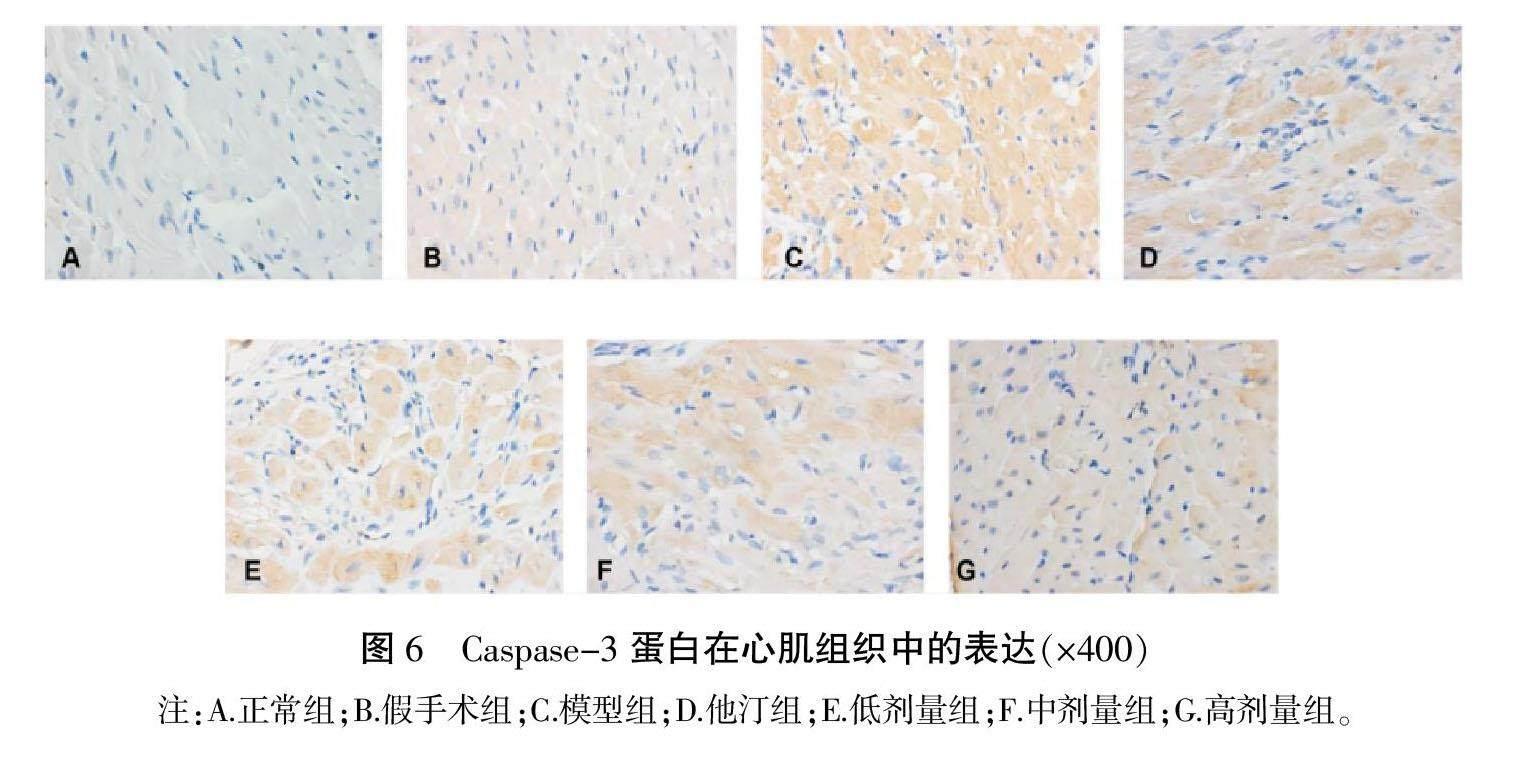
2.4 血府逐瘀汤对CHD血瘀证模型大鼠心肌组织SERCA2a、MCU、TRPC3、ORAI1、Caspase-3、Caspase-9蛋白表达的影响
与正常组和假手术组相比,模型组SERCA2a的AOD值显著下降(P<0.01);与模型组相比,他汀组和低、中、高剂量组SERCA2a的AOD值显著升高(P<0.01);与他汀组相比,高剂量组SERCA2a的AOD值显著升高(P<0.01);与低剂量组相比,中、高剂量组SERCA2a的AOD值显著升高(P<0.05,P<0.01);与中剂量组相比,高剂量组SERCA2a的AOD值显著升高(P<0.05)。详见表4、图2。
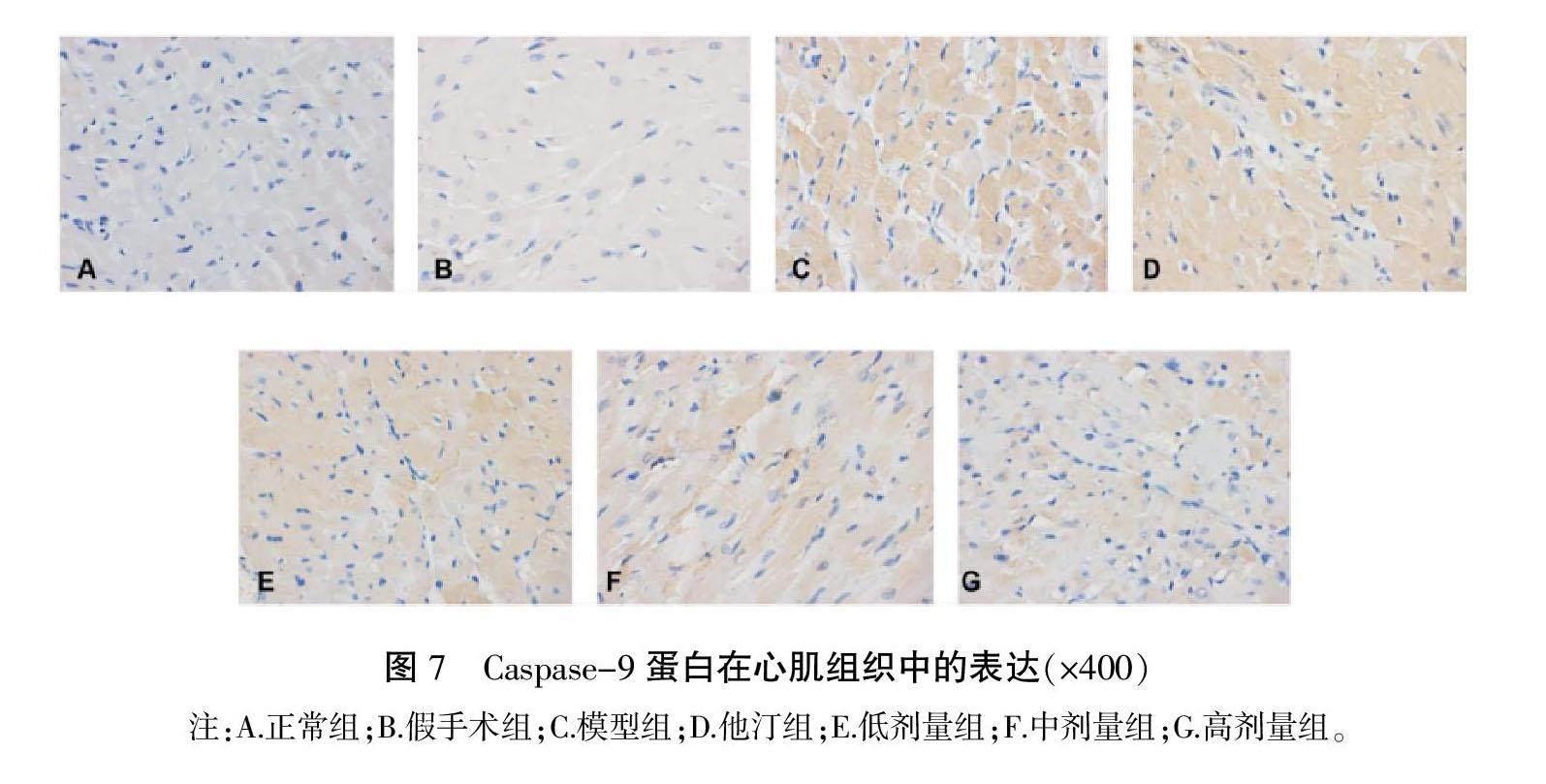
与正常组和假手术组相比,模型组MCU、TRPC3、ORAI1、Caspase-3、Caspase-9的AOD值明显升高(P<0.01);与模型组相比,他汀组和低、中、高剂量组MCU、TRPC3、ORAI1、Caspase-9的AOD值明显下降(P<0.01),低、中、高剂量组Caspase-3的AOD值显著下降(P<0.05,P<0.01);与他汀组相比,中、高剂量组MCU、TRPC3、ORAI1、Caspase-3、Caspase-9的AOD值明显下降(P<0.05,P<0.01);与低剂量组相比,高剂量组MCU、TRPC3、Caspase-3、Caspase-9的AOD值明显下降(P<0.01),中、高剂量组ORAI1的AOD值明显下降(P<0.01);与中剂量组相比,高剂量组MCU、TRPC3、ORAI1、Caspase-3、Caspase-9的AOD值明显下降(P<0.05,P<0.01)。详见表4—6,图2—7。
3 讨论
我国现有约3.3亿心血管疾病患者,其中CHD患者1 139万,且CHD的死亡率呈现逐年上升的趋势[9],CHD早已成为我国的重大公共卫生问题,防治CHD刻不容缓。中医学认为CHD的病机总属本虚标实,本虚为气血阴阳不足、心脉失养,标实为瘀血、气滞、痰湿、寒凝等痹阻心脉,病位在心。血府逐瘀汤出自《医林改错》,王清任针对胸中血瘀证,创立此方,由桃仁、当归、川芎、牛膝、红花、桔梗、生地黄、柴胡、赤芍、枳壳、甘草11味药物组成,方中以当归、赤芍、川芎、桃仁和红花活血为伍,配伍柴胡、桔梗与枳壳等宽胸行气、调畅气机,全方活血为主,兼以行气,以奏活血化瘀、行气止痛之效。现代药理学研究表明,当归和川芎具有保护心肌细胞的作用,其机制可能是通过稳定缺氧心肌细胞膜,保护线粒体功能,通过钙拮抗,抑制细胞钙超载,减少缺血区细胞凋亡的发生[10-12]。本实验中血瘀证模型大鼠在给予血府逐瘀汤之后,心肌细胞线粒体钙离子浓度下降,心肌组织病理改变改善,表明血府逐瘀汤对血瘀证模型大鼠的心肌细胞具有一定的保护作用。
心肌缺血缺氧后,围绕梗死血管周围的缺血心肌组织结构和功能遭受破坏。如何维持心肌细胞结构和能量代谢,减轻心肌细胞损伤,是现代医学研究的重点问题。心肌细胞是对能量代谢敏感的高耗能细胞,心肌能量剥夺是缺血性心脏病发病的关键。线粒体作为细胞的能量源,其功能障碍在心肌缺血的发生发展中发挥着关键作用[13]。线粒体功能障碍可改变细胞内Ca2+敏感通路[14],使胞浆Ca2+水平升高,引起线粒体Ca2+超载,最终导致细胞死亡。因此,调节线粒体Ca2+转运,减轻线粒体钙超载能够改善心肌缺血损伤,有效保护心肌,对寻找减轻CHD心肌缺血损伤的作用靶点具有重要意义。
有研究表明,心肌细胞内质网和线粒体内储存钙离子和静息状态胞浆内游离钙离子浓度很低。CHD血瘀证心肌缺血时心肌细胞供氧供能水平下降,使得ATP酶SERCA2a和Ca2+-Mg2+-ATP酶的活性下降[15-16],SERCA2a不能将胞质中多余的Ca2+泵到肌浆网中,内质网中的钙库耗竭可激活ORAI1[17],导致大量Ca2+向心肌细胞内转移,线粒体摄取细胞内过量Ca2+调节细胞内钙稳态失衡[18],线粒体电子传递失衡导致线粒体能量代谢下降在心脏缺血期间维持进行性损伤[19]。同时,线粒体钙超载导致Ca2+依赖性离子通道开放,线粒体膜通透性改变,线粒体结构受损,诱导线粒体向细胞质中释放一系列促凋亡因子结合成凋亡复合体,激活Caspase-9,Caspase-9的启动进而激活下游Caspase-3进入不可逆的凋亡过程,这些变化因素最终导致心肌细胞死亡[20]。
线粒体通过机制调节Ca2+的信号传导,维持细胞内Ca2+稳态,影响着细胞的有氧代谢和生存死亡[21]。MCU复合物活化和线粒体钙超载是心血管疾病的潜在机制[22]。MCU是线粒体Ca2+摄取的最主要离子通道[23],是钙稳态调节的关键因子。但MCU不是线粒体摄取Ca2+的唯一通路,44%的总经典TRPC3定位于线粒体内膜,当线粒体外钙离子浓度较高时大量Ca2+可以通过TRPC3进入线粒体[24]。这些钙离子通道在线粒体维持钙稳态中发挥重要的作用。
因此,维持线粒体钙稳态保护线粒体结构与功能的完整性对保护心肌细胞生理功能具有重要的意义,影响能量代谢,细胞凋亡[25]。有研究表明[26-27],抑制线粒体钙超载,能有效保护线粒体结构,抑制线粒体途径诱导的细胞凋亡,保护心肌细胞。
本研究结果显示,血府逐瘀汤可以明显改善缺血心肌组织病理形态,在低、中、高剂量组中,高剂量组效果最佳;血府逐瘀汤可以降低线粒体内钙离子浓度,调节线粒体内钙稳态,可能与提高心肌组织中Ca2+-Mg2+-ATP酶活性、上调SERCA2a的蛋白表达、下调MCU、TRPC3、ORAI1、Caspase-9和Caspase-3的蛋白表达有关。
参考文献
[1] 毕颖斐, 王贤良, 赵志强, 等. 冠心病中医证候地域性特征的临床流行病学调查[J]. 中医杂志, 2020, 61(5): 418-422, 461.
[2] 杨冬梨, 李玉红, 张文将, 等. 中药对心肌细胞线粒体功能障碍的调节作用[J]. 中医学报, 2022, 37(3): 529-534.
[3] RAMACHANDRA C J A, HERNANDEZ-RESENDIZ S, CRESPO-AVILAN G E, et al. Mitochondria in acute myocardial infarction and cardioprotection[J]. EBioMedicine, 2020, 57: 102884.
[4] 徐文华, 赵 阳, 宁桂兰, 等. 基于文献计量学和系统药理学分析血府逐瘀汤治疗冠心病的分子机制[J]. 中成药, 2020, 42(11): 3040-3046.
[5] 张秋雁, 王权礼, 苏剑峰, 等. 血府逐瘀汤促急性心肌缺血大鼠心肌血管新生及对血管内皮细胞生长因子的影响[J]. 中国中医药信息杂志, 2011, 18(2): 53-54.
[6] 李 蕾, 钟 声, 苏 畅, 等. 基于线粒体自噬探讨血府逐瘀汤抗心肌缺血损伤的作用机制[J]. 时珍国医国药, 2022, 33(8): 1797-1801.
[7] 谭精培, 钟 声, 张秋雁, 等. 基于线粒体能量代谢探讨血府逐瘀汤治疗冠心病血瘀证的作用机制[J]. 时珍国医国药, 2023, 34(2): 288-291.
[8] LONG L Z, YU Z K, CHEN S J, et al. Pretreatment of Huoxue Jiedu formula ameliorates myocardial ischaemia/reperfusion injury by decreasing autophagy via activation of the PI3K/AKT/mTOR pathway[J]. Frontiers in Pharmacology, 2021, 26(12):780-790.
[9] 胡盛寿, 王增武. 《中国心血管健康与疾病报告2022》概述[J]. 中国心血管病研究, 2023, 21(7): 577-600.
[10] 李 梅, 杨 梅, 赵 琦, 等. 当归的临床运用及用量研究[J]. 贵州中医药大学学报, 2023, 45(6): 32-36.
[11] 董培良, 李 慧, 韩 华. 当归及其药对的研究进展[J]. 中医药信息, 2019, 36(2): 127-130.
[12] 董 湧, 陈先让. 川芎嗪注射液联合天麻素注射液治疗脑梗死伴眩晕临床研究[J]. 新中医, 2021, 53(24): 77-79.
[13] CHAN D C. Mitochondrial dynamics and its involvement in disease[J]. Annual Review of Pathology, 2020, 15: 235-259.
[14] STEFANI D D, RIZZUTO R, POZZAN T. Enjoy the trip: Calcium in mitochondria back and forth[J]. Annual Review of Biochemistry, 2016, 85: 161-192.
[15] 刘遂心, 孙 明, 李 彤. 缺氧对心肌细胞内游离钙离子浓度和SERCA2表达的影响及薯蓣皂甙的干预作用[J]. 中华心血管病杂志, 2004, 32(9): 76-78.
[16] 谭精培, 苏 畅, 张秋雁, 等. 中医药干预心肌缺血线粒体能量代谢研究进展[J]. 辽宁中医药大学学报, 2022, 24(1): 49-53.
[17] 徐 曼, 逯星竹, 毕学苑, 等. 肌浆网/内质网钙调控在心血管疾病中的研究进展[J]. 心脏杂志, 2015, 27(2): 216-220.
[18] SINGH S, MABALIRAJAN U. Mitochondrial calcium in command of juggling myriads of cellular functions[J]. Mitochondrion, 2021, 57: 108-118.
[19] 周 滢, 娄宇轩, 孙 伟, 等. 线粒体离子通道在心血管疾病中的研究进展[J]. 南京医科大学学报(自然科学版), 2022, 42(9): 1322-1334.
[20] 于丰铭, 徐 扬. Caspase-3的研究进展[J]. 中国细胞生物学学报, 2020, 42(11): 2072-2078.
[21] 方若丞, 于苗苗, 樊廷俊. 线粒体相关内质网膜在细胞凋亡中的作用[J]. 生命科学, 2023, 35(10): 1328-1336.
[22] CHAPOY-VILLANUEVA H, SILVA-PLATAS C, GUTIéRREZ-RODRíGUEZ A K, et al. Changes in the stoichiometry of uniplex decrease mitochondrial calcium overload and contribute to tolerance of cardiac ischemia/reperfusion injury in hypothyroidism[J]. Thyroid, 2019, 29(12): 1755-1764.
[23] 赵 杨, 王 培, 杨 颖, 等. MCU及复合物与人类相关疾病的研究进展[J]. 天津医科大学学报, 2022, 28(4): 448-451.
[24] FENG S J, LI H Y, TAI Y L, et al. Canonical transient receptor potential 3 channels regulate mitochondrial calcium uptake[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(27): 11011-11016.
[25] 杨冬梨, 李玉红, 张文将, 等. 中药对心肌细胞线粒体功能障碍的调节作用[J]. 中医学报, 2022, 37(3): 529-534.
[26] KWONG J Q. The mitochondrial calcium uniporter in the heart: Energetics and beyond[J]. The Journal of Physiology, 2017, 595(12): 3743-3751.
[27] XUE Q, PEI H F, LIU Q S, et al. MICU1 protects against myocardial ischemia/reperfusion injury and its control by the importer receptor Tom70[J]. Cell Death & Disease, 2017, 8(7): e2923.

