淡豆豉中产γ-氨基丁酸微生物对产毒黄曲霉菌的拮抗作用和毒素合成关键基因mRNA 表达的影响
戴家齐,贺 婧,朱晓蓝,王立元,龙 凯,周立分,杨安金,翁美芝*,谢小梅*
1.江西中医药大学,江西 南昌 330004
2.南昌大学转化医学研究院,江西 南昌 330031
3.江西中医药大学附属医院,江西 南昌 330006
淡豆豉为豆科植物大豆的成熟种子与桑叶、青蒿等辅料经发酵加工而成,是我国特有的药食两用中药。黄曲霉菌Aspergillusflavus广泛存在于环境中,侵染农作物、中药材等[1]。本实验室前期研究表明,在淡豆豉炮制中的“黄衣上遍”和“再闷”前期均分离出黄曲霉菌,可能因炮制的特殊环境及微生物抑制等多重因素,至“再闷”后期产毒黄曲霉菌和黄曲霉毒素B1(aflatoxin B1,AFB1)含量逐渐减少直至消失[2]。
黄曲霉毒素(aflatoxins,AFT)是黄曲霉菌和寄生曲霉菌A.parasiticus等真菌产生的次级代谢物,在已知多种AFT 中,AFB1的毒性最强,分布广泛、具强致癌性、且难以清除,被世界卫生组织列为I 类致癌物[3]。李汶等[4]报道淡豆豉中AFB1含量高达21.52 ng/g,Qiu 等[5]报道多批次淡豆豉样品存在AFT 污染其阳性率为81.8%,淡豆豉因发酵不充分被产毒株污染的风险提升,安全性难以保证[6]。
γ-氨基丁酸是一种天然存在的非蛋白质氨基酸,是人体重要的抑制性神经递质,能从根本上起到抗焦虑、促进睡眠等作用,与淡豆豉主治“虚烦不眠”相吻合。本实验室首次报道淡豆豉中富含γ-氨基丁酸,并筛选出多株产γ-氨基丁酸微生物[7-8]。基于此,本实验考察从淡豆豉炮制中分离的15 株产γ-氨基丁酸微生物对产毒黄曲霉菌的拮抗能力,并筛选出具有抑制产毒黄曲霉菌生长和降解AFB1的高效拮抗菌,进一步探究其对黄曲霉毒素合成关键基因mRNA 表达的影响。研究结果将为淡豆豉的AFT 污染防控、提高“虚烦不眠”之疗效、揭示其炮制机制提供参考。
1 材料与仪器
1.1 实验菌株
产毒黄曲霉标准株A.flavus,购于中国普通微生物菌种保藏中心,编号CGMCC3.4408;产γ-氨基丁酸微生物15 株(真菌8 株,细菌7 株)均为本实验室从淡豆豉炮制中分离、鉴定并保存[8],由江西中医药大学谢小梅教授和王立元副教授鉴定和命名,具体NCBI 对比结果见表1。
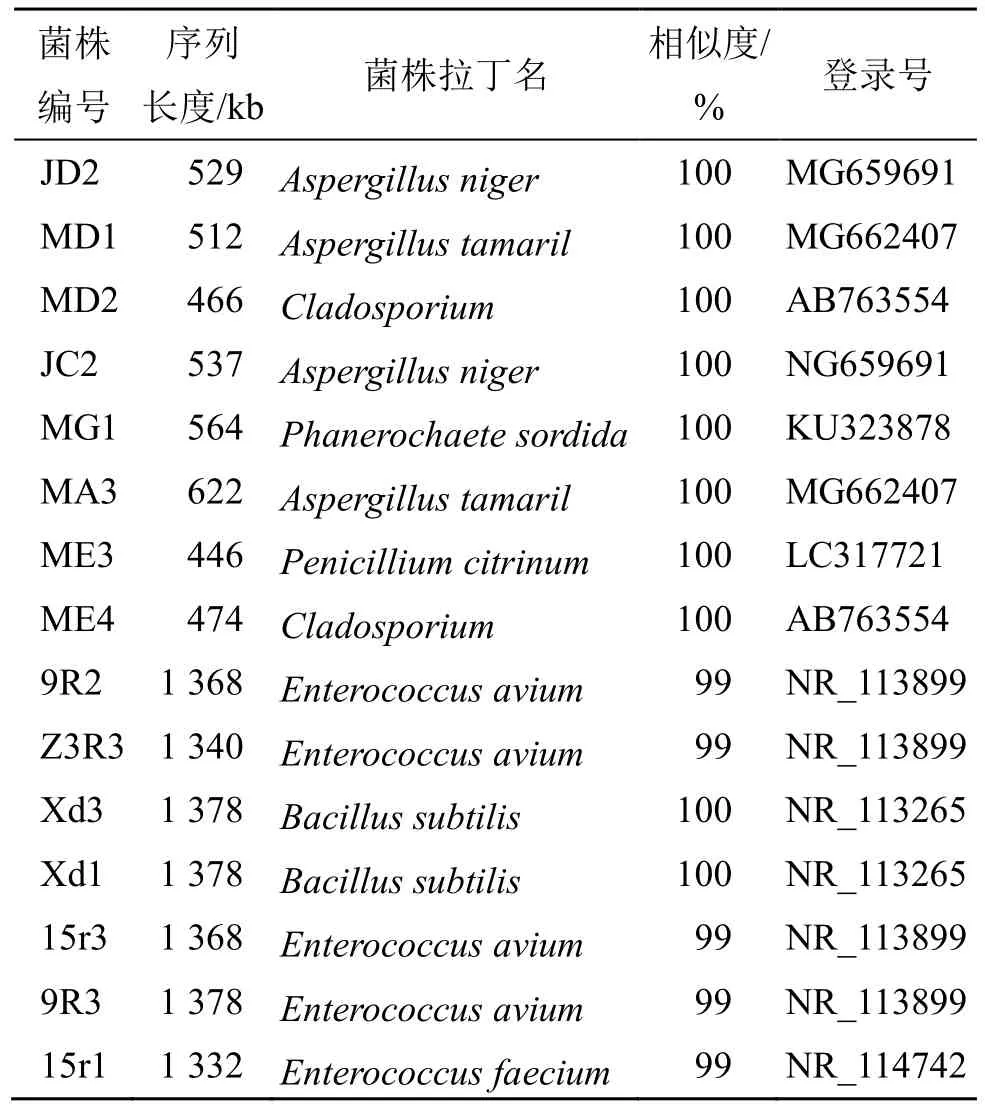
表1 淡豆豉中产γ-氨基丁酸真菌和细菌的NCBI 对比结果Table 1 NCBI comparison results of γ-amino butyri acidproducing fungi and bacteria in Sojae Semen Praeparatum(SSP)
1.2 试剂及仪器
马铃薯葡萄糖琼脂培养基(PDA)、脑心浸液肉汤培养基,批号20230216、20201017,青岛海博生物技术有限公司;马铃薯葡萄糖肉汤(PDB),批号505E031,北京索莱宝科技有限公司;种子培养基、细菌发酵培养基、真菌发酵培养基配方参见实验室前期研究[9];AFB1对照品,质量分数≥98.0%,A832707-1mg,麦克林公司;M5 Plant RNeasy Plus Mini Kit 试剂盒,批号22HB0613,北京聚合美生物有限公司;Prime ScriptTMRT reagent Kit with gDNA Eraser、TB Green®Premix Ex TaqTM(Tli RNase HPlus),批号AM81776A、AM61256A,TaKaRa 生物技术公司;Nexera X2 型超快速液相色谱仪,日本岛津公司;AB Sciex QTRAP 4500 型三重四极杆线性离子肼串联质谱仪,美国AB Sciex 公司;7500 Real Time PCR System(ABI75000),Applied Biosystems公司。
2 方法与结果
2.1 平板对峙法与十字交叉法检测各待测菌及其发酵产物对产毒标准株生长的影响
2.1.1 各待测菌对产毒标准株生长的影响 参考本课题组前期研究[9],活化后培养各待测菌及产毒标准株,吸取1×105CFU/mL 的产毒标准株孢子液10µL 接种于培养基中央,用十字交叉法接种20 µL 1×107CFU/mL 各待测菌孢子液(真菌)或种子液(细菌)于等距的四端,以仅接种1×105CFU/mL 的产毒标准株孢子液于培养基中央作为对照组,28 ℃培养5 d,记录产毒标准株菌落直径,每组3 个平行,计算生长抑制率,结果见表2 和图1。2 株黑曲霉菌JD2、JC2 对产毒标准株的生长抑制效果为真菌中最佳,抑制率分别为56.05%、55.58%;2 株枯草芽孢杆菌Xd3、Xd1 对产毒标准株的生长抑制效果为细菌中最佳,抑制率分别为39.10%、29.64%。
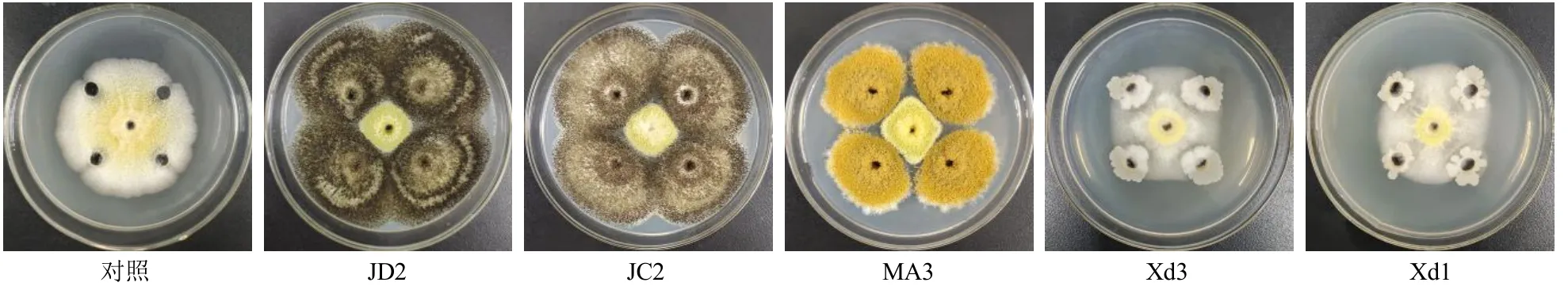
图1 对峙法检测各待测菌对产毒标准株生长的影响Fig.1 Growth effect against toxigenic A.flavus of different strains each microorganisms detected by plate confrontation culture
表2 15 株菌及其发酵产物对产毒标准株的生长抑制率和AFB1 降解率 (±s, n = 3)Table 2 Growth inhibition of A.flavus and degradation of AFB1 by 15 strains (±s, n = 3)
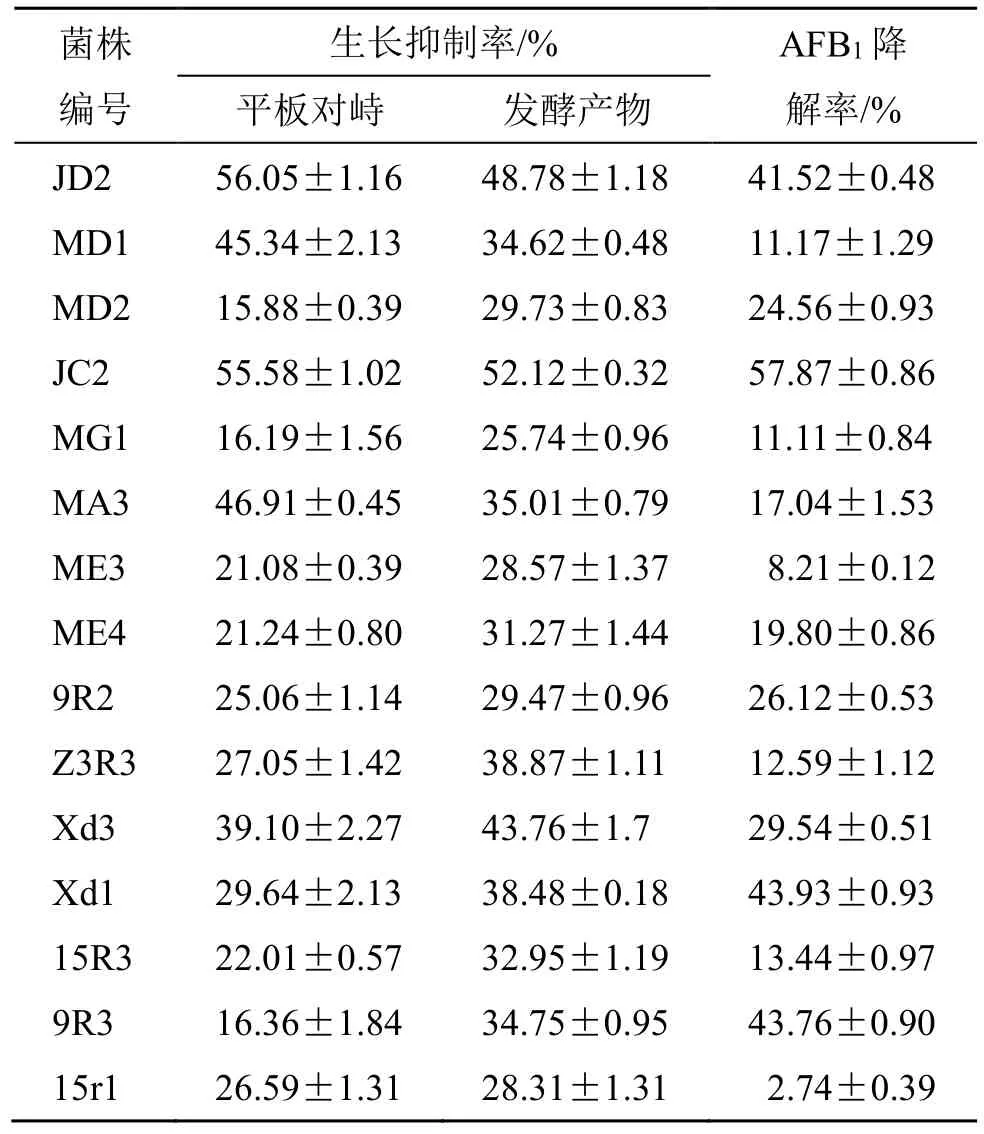
表2 15 株菌及其发酵产物对产毒标准株的生长抑制率和AFB1 降解率 (±s, n = 3)Table 2 Growth inhibition of A.flavus and degradation of AFB1 by 15 strains (±s, n = 3)
菌株编号生长抑制率/% AFB1 降解率/%平板对峙 发酵产物JD2 56.05±1.16 48.78±1.18 41.52±0.48 MD1 45.34±2.13 34.62±0.48 11.17±1.29 MD2 15.88±0.39 29.73±0.83 24.56±0.93 JC2 55.58±1.02 52.12±0.32 57.87±0.86 MG1 16.19±1.56 25.74±0.96 11.11±0.84 MA3 46.91±0.45 35.01±0.79 17.04±1.53 ME3 21.08±0.39 28.57±1.37 8.21±0.12 ME4 21.24±0.80 31.27±1.44 19.80±0.86 9R2 25.06±1.14 29.47±0.96 26.12±0.53 Z3R3 27.05±1.42 38.87±1.11 12.59±1.12 Xd3 39.10±2.27 43.76±1.7 29.54±0.51 Xd1 29.64±2.13 38.48±0.18 43.93±0.93 15R3 22.01±0.57 32.95±1.19 13.44±0.97 9R3 16.36±1.84 34.75±0.95 43.76±0.90 15r1 26.59±1.31 28.31±1.31 2.74±0.39
抑制率=(对照组菌落直径-实验组菌落直径)/对照组菌落直径
2.1.2 各待测菌发酵产物对产毒标准株生长的影响取1 mL 1×107CFU/mL 各待测菌孢子液或种子液于25 mL 相应的发酵培养基中,细菌于37 ℃发酵3 d,真菌于28 ℃、120 r/min 发酵7 d,11 269.44×g离心5 min 后取上清液,0.22 µL 滤膜除菌得发酵产物。取8 mL 与20 mL PDA 在培养皿中混匀凝固后,于培养皿中央接种20 µL 1×105CFU/mL 的产毒标准株孢子液,以中央仅接种1×105CFU/mL 产毒菌标准株孢子液作对照。28 ℃培养5 d,记录菌落直径,计算抑菌率,每组3 个平行。结果显示,黑曲霉菌JD2(48.78%)和JC2(52.12%)、溜曲霉菌MA3(35.01%)和MD1(34.62%)等真菌及枯草芽孢杆菌Xd1(38.48%)和Xd3(43.76%)鸟肠球菌Z3R3(38.87%)和9R3(34.75%)等细菌的抑制率较高,结果见表2 和图2。
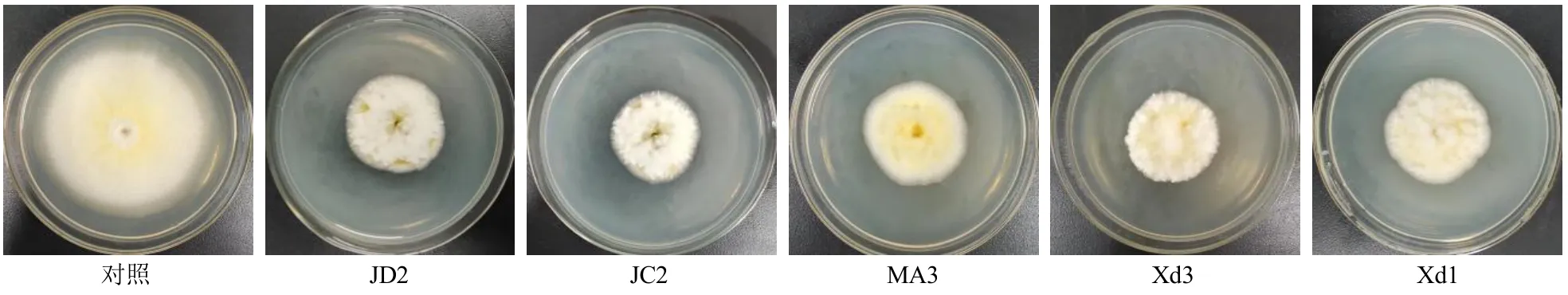
图2 各待测菌发酵产物对产毒标准株生长的影响Fig.2 Effect of fermentation product of different strains on growth of toxigenic A.flavus
抑菌率=(对照组菌落直径-实验组菌落直径)/对照组菌落直径
2.2 UPLC-MS/MS 法检测各待测菌对AFB1 的降解率
本课题组前期已建立了UPLC-MS/MS 法测定AFB1,具体色谱及质谱条件参考前期报道[9]。
2.2.1 对照品溶液的制备 精确量取0.1 mg AFB1对照品于50 mL 棕色量瓶中,加甲醇稀释至刻度,摇匀,过0.22 μm 滤膜,即得2 µg/mL 的AFB1对照品储存液。
2.2.2 供试品溶液的制备 吸取1 mL 1×107CFU/mL 待测菌孢子液或种子液,于25 mL 相应的发酵培养基中,细菌37 ℃培养2 d、真菌28 ℃培养3 d 后,避光吸取980 µL 各菌发酵液,加入20µL 100 µg/mL 的AFB1对照品,对照组不接种待测菌发酵液,37 ℃避光孵育72 h。取孵育后液体各1 mL,氮气吹至近干,加1 mL 甲醇复溶,10 000×g离心10 min,上清液经0.22 µm 滤膜滤过,UPLCMS/MS 上机检测。
2.2.3 线性关系考察 将AFB1对照品储存液配置成各个质量浓度的AFB1对照品溶液(10、50、100、150、200、250、300 ng/mL),混匀,上机测定。得AFB1回归方程为Y=2 154.4X+397.36,r=0.999 2,结果表明,AFB1在10~200 ng/mL 呈现良好的线性关系。
2.2.4 精密度考察 配制AFB1质量浓度为100 ng/mL 的对照品溶液,连续重复进样6 次,按峰面积计算,RSD 为1.87%,结果表明仪器精密度良好。
2.2.5 稳定性考察 取无菌发酵液6 份,精密加AFB1对照品溶液,使终质量浓度为100 ng/mL。按“2.2.2”项下方法制备,分别测定制备后0、4、8、12、16、20、24 h 时的AFB1含量,以峰面积计算,RSD 为0.51%,结果表明供试品溶液在24 h 内稳定性良好。
2.2.6 重复性考察 取无菌发酵液6 份,精密加AFB1对照品溶液,使终质量浓度为100 ng/mL。按“2.2.2”项下方法制备供试品溶液,进样2 µL 测定,以AFB1质量浓度来计算,RSD 为1.50%,结果表明该方法重复性良好。
2.2.7 加样回收率考察 取无菌发酵液9 份,精密加入50、150、300 ng/mL 的对照品溶液(各3 份),得到高、中、低不同加标质量浓度的样品,依“2.2.2”项方法进行样品处理,进样检测含量。
再用甲醇制备相应质量浓度的对照品溶液,进样分析,检测含量。以发酵液为基质,测得低、中、高3 个质量浓度水平时AFB1的平均加样回收率分别为98.51%、96.70%、96.76%,RSD 分别为0.47%、2.13%、1.19%。
2.2.8 AFB1降解率分析 AFB1降解实验中部分待测菌的UPLC-MS/MS 色谱图见图3,结果显示,各待测菌发酵产物对AFB1均有一定降解作用,其降解率大小依次为JC2>Xd1>9R3>JD2;15 株待测菌发酵产物对AFB1降解率在2.74%~57.87%,JC2为真菌中最强,Xd1 为细菌中最强。结果见表2。
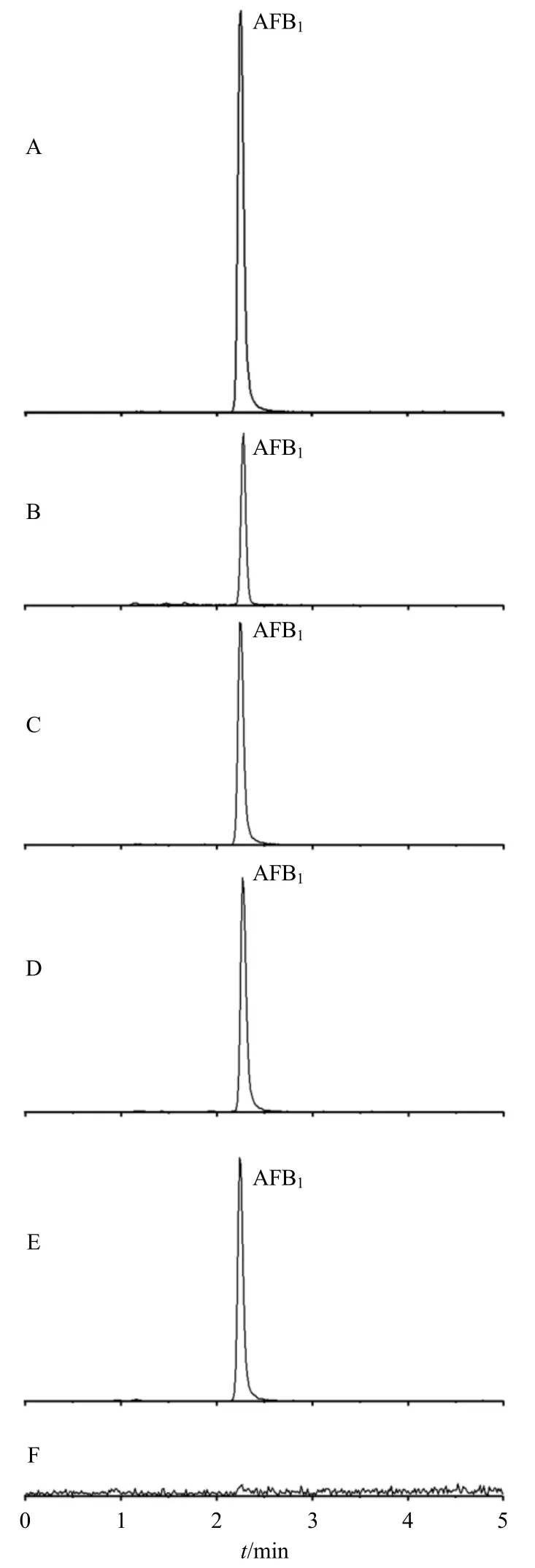
图3 AFB1 降解作用液质色谱图Fig.3 UPLC/MS/MS chromatogram of AFB1 degradation
综上,15 株产γ-氨基丁酸微生物对产毒黄曲霉菌均有一定的拮抗能力,根据它们对产毒标准株生长的抑制效果以及对AFB1降解率,综合筛选出具有高效拮抗作用的真菌和细菌各1 株(JC2 和Xd1)。
2.3 高效拮抗菌对产毒标准株的菌丝生长以及AFT 合成关键基因mRNA 表达的影响
筛选出高效拮抗菌(JC2、Xd1)之后,用菌丝干重法检测其发酵产物对产毒标准株菌丝干重的抑制情况;利用RT-qPCR 法检测其对AFT 合成关键基因mRNA 表达的影响。
2.3.1 菌丝干重法 于20 mL PDB 培养基中接种1 mL 1×106CFU/mL 的产毒标准株孢子液,按“2.1.2”项下方法制备高效拮抗菌发酵产物,分别按0、250、500、1 000、1 500、2 000 µL 加入到PDB 中,28 ℃培养5 d 至产毒中期。无菌纱布滤过,收集菌丝体于60 ℃烘至恒定质量,测定菌丝体干质量,每组3个平行,以仅接种1 mL 1×106CFU/mL 的产毒标准株孢子液为对照组,计算抑制率。结果见图4,JC2 与Xd1 发酵产物对产毒标准株菌丝生长均有显著抑制作用,随着发酵产物加入量的增加,抑制率逐渐上升,当加入量达到2 000 µL 时,JC2 和Xd1菌丝生长抑制率分别为73.82%和63.34%,抑制作用良好,表明JC2 和Xd1 发酵产物能明显抑制产毒黄曲霉菌生长。
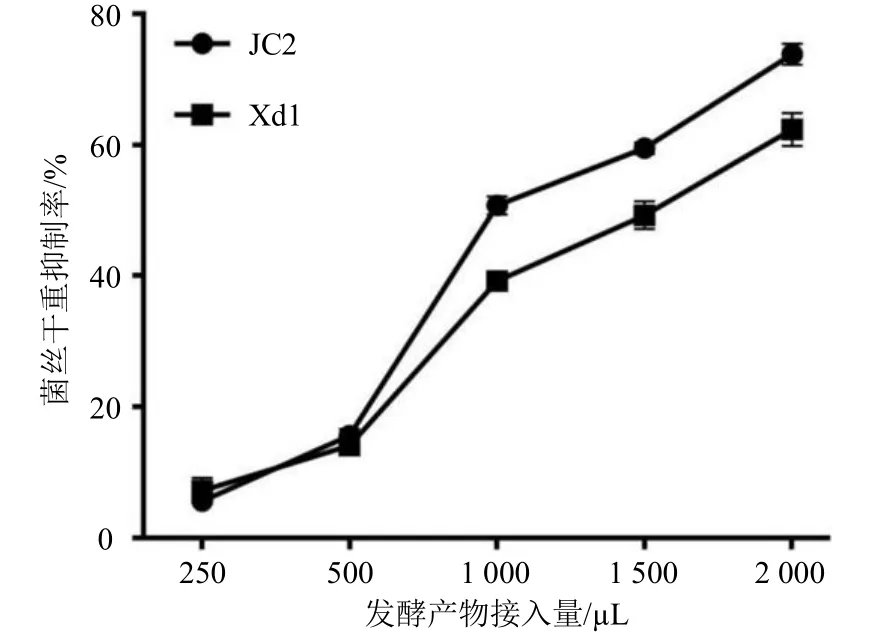
图4 高效拮抗菌发酵产物对产毒标准株菌丝干重的影响Fig.4 Effect of highly efficient antagonistic microorganisms fermentation products on mycelia dry weight of toxigenic A.flavus
抑制率=(对照组菌丝体干质量-实验组菌丝体干质量)/对照组菌丝体干质量
2.3.2 RT-qPCR 法
(1)总RNA 的提取:按“2.3.1”项下条件培养产毒标准株至产毒中期,分别取加入了500、1 000、2 000 µL 高效拮抗菌发酵产物的黄曲霉菌丝,抽滤,于液氮中迅速冷冻,−80 ℃冰箱保存。再取未加入高效拮抗菌发酵产物的黄曲霉菌丝作为空白组进行同样操作。提取RNA 所用的玻璃器皿、研钵等用0.1% DEPC 水37 ℃浸泡12 h,121 ℃灭菌30 min,称取冻存的新鲜菌丝100 mg,液氮研磨法进行RNA提取,具体方法参见M5 Plant RNeasy Plus Mini Kit试剂盒说明书。1%琼脂糖凝胶电泳检测RNA 完整性,超微量分光光度计检测RNA 质量浓度。所提取的总RNA 其A260/A280比值在1.8~2.0,完整性好,无降解,可用于后续反应。
(2)去DNA 反应:对样品中可能存在的DNA进行去除,向除酶管中加入total RNA 1 µg,5×gDNA Eraser Buffer 2 µL,gDNA Eraser 1 µL,补Rnase free dH2O 至10 µL,在PCR 仪中42 ℃ 2 min反应,4 ℃下保存。
(3)cDNA 的合成:采用TaKaRa 反转录试剂盒进行。反应体系:总RNA 10 μL,Rnase free dH2O 4 μL,5×Prime Script Buffer 4 μL,RT Prime MTX 1 μL,Prime Script RT Engme MTXⅠ 1 μL。反转录条件:37 ℃、15 min;85 ℃、5 s;1 个循环。
(4)RT-qPCR 检测基因的表达情况:方法要求设计引物的合成片段不宜过大(50~200 bp),选用18S rRNA(F: 3’-GCTCTTTTGGGTCTCGTAATTGG-5’;R: 3’-CGCTATTGGAGCTGGAATTACC-5’)作为内参基因,其他所用引物为aflR(F: 3’-GATAGCTGTACGAGTTGTGC-5’;R: 3’-CAGCCCAGCGGGGCGTGGGG-5’)[10],aflD(F: 3’-ACCGCTACGCCGGCACTCTCGGCAC-5’;R: 3’-GTTGGCCGCCAGCTTCGACACTCCG-5’)[10],aflM(F: 3’-GTGGGCCTCCCTGTGGAT-5’;R: 3’-CACTTACCCATTCGGCTGTGT-5’)[11]、aflP(F: 3’-CACGCTTTCAGAGCAGGTAA-5’;R: 3’-TTCGGTGGAGGAGGGAGTT-5’)[12]。采用TaKaRa 公司的TB Green®Premix Ex TaqTM进行RT-qPCR 反应,反应体系:稀释后的cDNA 溶液2 μL,TB Green Premix Ex Taq(Tli RNaseH Plus)(2×)10 μL,上下游引物各0.4 μL,ROX Reference DyeⅡ 0.4 μL,dH2O 6.8 μL,反应设1 复孔,以2 μL dH2O 取代cDNA 作为空白对照。每组3 个平行。反应条件:95 ℃、30 s;95 ℃、5 s,60 ℃、34 s,40 循环;95 ℃、15 s;60 ℃、1 min;95 ℃、15 s。
(5)引物特异性:将4 对特异性引物进行实时荧光定量PCR 反应,观察熔解曲线是否为单一峰,以判断引物的特异性,结果见图5。4 对引物的熔解曲线均为单一峰,可见设计的引物特异性良好。
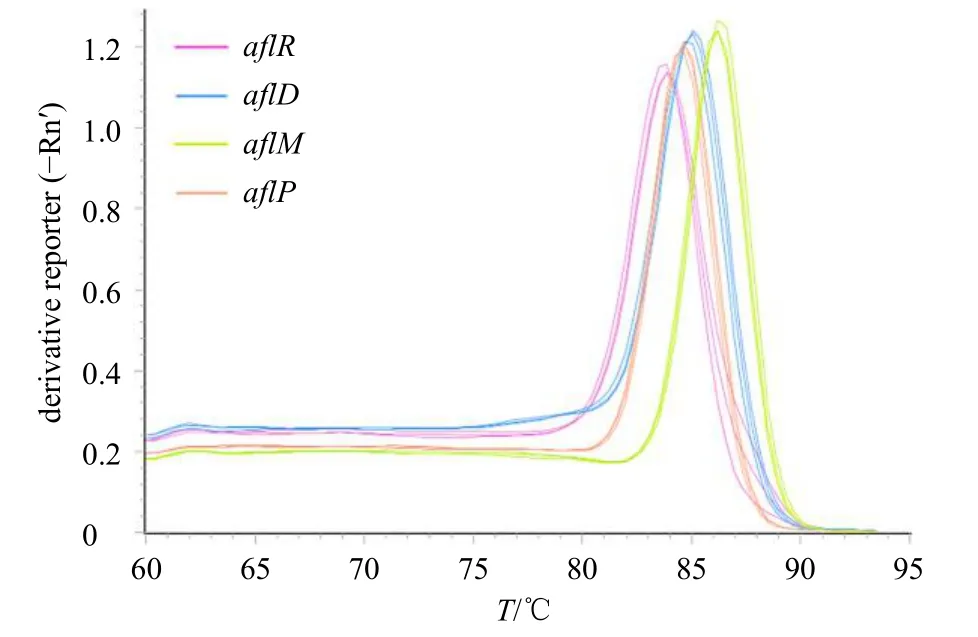
图5 荧光定量PCR 4 对引物熔解曲线Fig.5 RT-qPCR four-pair primer dissolution curve
(6)数据分析:反应结束后,用2−ΔΔCt法计算不同样品中各基因的相对表达量,结果见表3。随着发酵产物加入量的增加,2 株高效拮抗菌对毒素合成4个关键基因的mRNA 表达水平下调趋势逐渐显著,当JC2 发酵产物加入量为2 000 µL 时,aflR表达下调最为明显,依次为aflD、aflM、aflP;当Xd1 发酵产物加入2 000 µL 时4 个基因下调程度由高到低依次为aflD、aflR、aflP、aflM。
表3 高效拮抗菌发酵产物对黄曲霉菌毒素合成关键基因mRNA 表达量的影响 (±s, n = 3)Table 3 Effect of highly efficient antagonistic fermentation products on mRNA expression of key genes in aflatoxin synthesis(±s, n = 3)
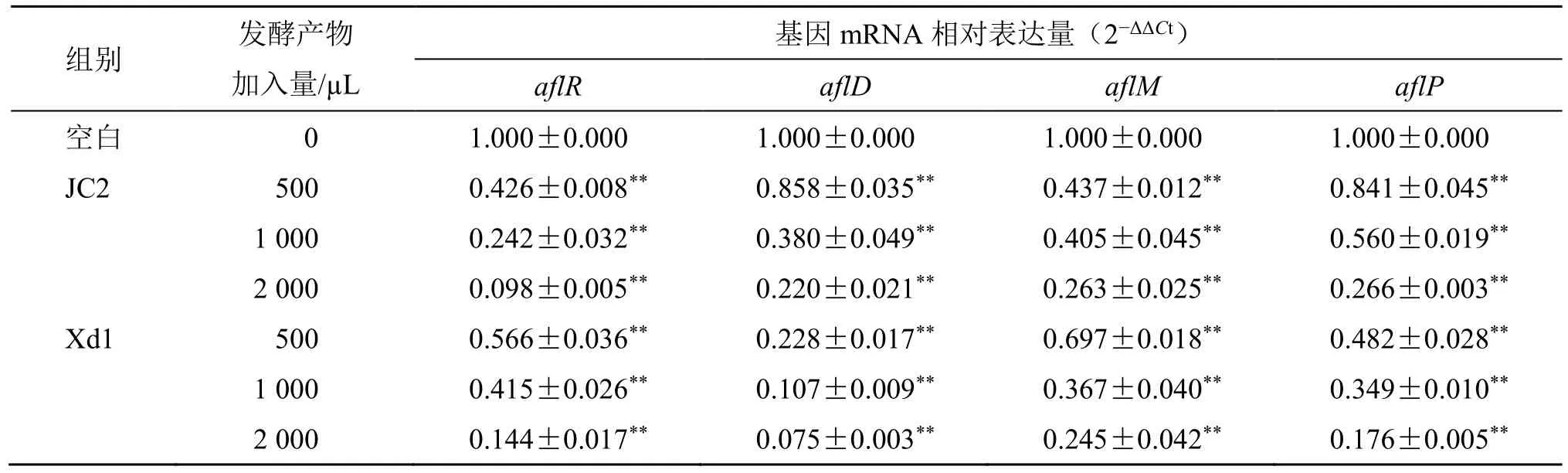
表3 高效拮抗菌发酵产物对黄曲霉菌毒素合成关键基因mRNA 表达量的影响 (±s, n = 3)Table 3 Effect of highly efficient antagonistic fermentation products on mRNA expression of key genes in aflatoxin synthesis(±s, n = 3)
与空白组比较:*P<0.05 **P<0.01。*P < 0.05 **P < 0.01 vs blank group.
组别 发酵产物加入量/µL基因mRNA 相对表达量(2−ΔΔCt)aflR aflD aflM aflP空白 0 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 JC2 500 0.426±0.008** 0.858±0.035** 0.437±0.012** 0.841±0.045**1 000 0.242±0.032** 0.380±0.049** 0.405±0.045** 0.560±0.019**2 000 0.098±0.005** 0.220±0.021** 0.263±0.025** 0.266±0.003**Xd1 500 0.566±0.036** 0.228±0.017** 0.697±0.018** 0.482±0.028**1 000 0.415±0.026** 0.107±0.009** 0.367±0.040** 0.349±0.010**2 000 0.144±0.017** 0.075±0.003** 0.245±0.042** 0.176±0.005**
ΔΔCt=(Ct靶基因-Ct内参)试验组-(Ct靶基因-Ct内参)空白组
Ct表示在反映中cDNA 样本荧光信号达到设定阈值所需的循环数
3 讨论
目前,AFT 的去除方法主要包括物理法、化学法和生物法。生物法降解AFT 相比于常规的物理、化学法更加温和、安全和经济。本实验从15 株产γ-氨基丁酸微生物中筛选出具有抑制产毒黄曲霉菌生长和降解AFB1的高效拮抗菌——黑曲霉菌(JC2)和枯草芽孢杆菌(Xd1),黑曲霉菌不仅可以有效抑制产毒黄曲霉菌的生长,使其生长速度减慢,还可以有效降解培养基中已经产生的AFB1,它是通过直接代谢和分泌胞外酶(主要方式)2 种途径共同降解AFB1的[13]。
有学者[14]从黑曲霉发酵产物中分离出了一种能明显干扰AFT 毒素合成信号传导途径、抑制黄曲霉生长的抗真菌肽(antifungal peptide,AFP),认为黑曲霉抑制黄曲霉菌的活性成分可能主要为其分泌具有半胱氨酸的抗真菌肽;此外,枯草芽孢杆菌也主要通过分泌胞外活性物质来抑制产毒黄曲霉菌生长和降解黄曲霉毒素,这些化合物,尤其是脂肽和蛋白酶,是抑制黄曲霉菌生长和脱除AFT 的有效因子[15]。其机制可能是拮抗物质使菌丝细胞壁出现消融,降低孢子萌发率来实现[16]。另外,目前国内外已有将黑曲霉菌[17]、枯草芽孢杆菌[18]作为生防菌防控AFT 的应用研究。
近年来,随着AFT 合成及调控机制的研究深入,已经确定位于黄曲霉菌3 号染色体端粒上的一段包含30 个基因的基因簇影响着AFT 合成,它们的mRNA 表达水平直接影响AFT 的合成水平[19]。其中,aflR编码一个具有锌指结构的DNA 结合蛋白(AfLR),该蛋白可以结合AFT 途径基因启动子区的回文序列(5’-TCGN5CGA-3’)从而激活基因的表达,因此aflR基因对AFT 合成来说是必需的,有研究表明:aflR基因转录水平在产毒黄曲霉菌中很明显,在不产毒黄曲霉菌株中,aflR基因的转录却受到了明显的抑制,甚至不表达[20]。合成AFT 至少经历18 个酶促反应,而位于毒素合成基因簇上的aflD、aflM、aflP所表达的AFLD、AFLM 和AFLP蛋白分别在AFT 合成早、中、晚期起着至关重要的催化作用[21]。它们的表达直接调控着产AFT 微生物毒素合成代谢路径上多个关键物质的转化[22-24]。
本实验发现,JC2、Xd1 发酵产物在PDB 中具有很强的抑制产毒黄曲霉标准株菌丝生长作用;不同浓度发酵产物作用后,提取菌丝RNA 进行实时荧光定量PCR,它们对黄曲霉毒素合成激活基因及毒素合成的早、中、晚期催化基因的mRNA 表达量均有明显抑制,JC2 发酵产物对aflR基因的mRNA表达下调最为明显,而Xd1 对aflD基因的mRNA表达下调最明显,推测JC2 可能主要通过下调毒素合成激活基因的表达,而Xd1 可能主要通过限制毒素合成早期诺素罗瑞尼克酸(NOR)的转化[22]。
本实验筛选的高效拮抗菌JC2、Xd1,在其安全性达标之后,通过混菌发酵[25]等方法不仅能为提高淡豆豉γ-氨基丁酸含量提供有潜力的候选菌株,也将为防控淡豆豉的AFT 污染、揭示“再闷”后期AFT 降解机制提供参考。
利益冲突所有作者均声明不存在利益冲突