基于UPLC-Q-Exactive Orbitrap-MS 技术与网络药理学研究赶黄草保肝潜在药效物质基础和作用机制
田海涛,蔡春颖,赵东升,张龙霏,邓志鹏
山东中医药大学药学院,山东 济南 250355
赶黄草又名水泽兰、水杨柳,为赶黄草属PenthorumGronov.ex L.植物扯根菜Penthorum chinensePursh 的干燥地上部分,主要分布在我国华北、华东、中南及陕西、四川和贵州等地,其中四川古蔺是其主要产地[1]。赶黄草先后被《重庆市中药材标准(2022 年版第一批)》《四川省中药材质量标准(2010 版)》《湖南省中药材标准(2009 年版)》所收载,为苗族传统用药,在保肝方面发挥着重要作用,常用于治疗各种肝病。现代药理研究表明其具有治疗肝损伤、抑制肝纤维化和肝硬化、治疗慢性活动性肝炎等作用[2-3],其单方制剂肝苏颗粒常用于治疗胆囊炎、黄疸、非酒精性及酒精性脂肪肝和感染性肝炎,具有良好的临床疗效。赶黄草中含有黄酮、木脂素、有机酸、苯丙素类等多种活性成分,其中黄酮和木酯素是最赶黄草中含量较高的成分,且研究显示赶黄草中的黄酮和木酯素成分具有显著保肝活性[4-5]。
本实验通过检索文献构建赶黄草化学成分数据库[6-8],运用UPLC-Q-Exactive Orbitrap-MS 技术分析赶黄草信息,部分成分用标准品进行比对验证,其余成分通过保留时间及二级质谱数据对比推断确认,在此基础上,应用网络药理学及分子对接方法探究赶黄草保肝作用靶点及作用机制。本研究结果对赶黄草的质量控制及药效机制研究有一定的推动作用,为赶黄草药材的研究开发提供一定实验依据与参考。
1 仪器与材料
1.1 药品与试剂
甲醇、乙腈、甲酸(色谱纯,Thermo Fisher,美国);乙醇(分析纯,国药集团化学试剂有限公司);纯净水(杭州娃哈哈集团有限公司);槲皮苷(批号PCS-210509)、槲皮素-3-O-阿拉伯糖苷(批号PCS-210609)、槲皮素(批号PCS-210921)、芹菜素(批号PCS-210513)、芦丁(批号PCS-210717)、槲皮素-3-O-鼠李糖苷(批号PCS-211209)、山柰素(批号PCS-220321)、赶黄草苷A(批号PCS-210920)、赶黄草苷B(批号PCS-220716)、山柰酚-3-O-阿拉伯糖苷(批号PCS-211109)、阿福豆苷(批号PCS-210911)、山柰酚(批号PCS-211208)、原儿茶酸(批号PCS-211009)、乔松素-7-O-β-D葡萄糖苷(批号PCS-211120)、儿茶素(批号PCS-211018)、没食子酸(批号PCS-210710)、乔松素(批号PCS-220316)对照品均购自成都植标化纯生物技术有限公司,质量分数均>98%;赶黄草(批号YL-772-2202-001)药材购自安徽贺林中药饮片科技有限公司,经山东中医药大学李峰教授鉴定为虎耳草科植物扯根菜P.chinesePursh 的干燥地上部分。
1.2 仪器
超高压液相串联Ultimate 3000-Q-Exactive 高分辨质谱(Thermo Fisher Scientific,美国);Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm;Phenomenex,美国);ES-E120B 型电子分析天平(天津市德安特传感技术有限公司);Legend micro 17 微量离心机(Thermo Fisher Scientific 公司,美国);PL-S20 超声波清洗器(东莞康士洁超声波科技有限公司);YRE-501 型旋转蒸发仪(巩义市予华仪器有限责任公司);DLSB-Z C 型低温循环真空泵(郑州长城科工贸有限公司)。
1.3 数据库与软件
中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://tcmspw.com/index.php),PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/);SwissTargetPrediction 数据库(http://www.swisstargetprediction.ch/);人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,http://www.omim.org/),GeneCards 数据库(https://www.genecards.org/),DisGeNET 数据库(https://www.disgenet.org/),治疗靶点数据库(Therapeutic Target Database,TTD,http://bidd.group/index.html/);UniProt 数据库(https://www.uniprot.org/),DAVID 6.8 数据库(https://david.ncifcrf.gov/),蛋白结构数据库(PDB,http://www.rcsb.org/);Cytoscape 3.7.2软件;AutoDockTools1.5.6 软件;AutoDockvina 插件;PyMOL 2.5.4 软件;ChemDraw Professional 15.1软件,Open Babel GUI 软件。
2 方法
2.1 样品溶液的制备
分别取赶黄草全草(含茎、叶、花)、茎、叶各50 g,切碎,加水煎煮3 次,每次加药材量10 倍水煎煮2 h,合并煎液,滤过,滤液浓缩,冷却,加乙醇使含醇量达60%,搅拌,静置,滤过,沉淀用60%乙醇洗涤3 次,合并洗液与滤液,回收乙醇并浓缩至稠膏。稠膏经干燥后,称取500 mg 提取物溶于20 mL 60%甲醇中。所得样品溶液经0.22 μm 滤膜滤过后进样分析。
2.2 对照品溶液的制备
取槲皮苷、槲皮素-3-O-阿拉伯糖苷、槲皮素、芹菜素、芦丁、槲皮素-3-O-鼠李糖苷、山柰素、赶黄草苷A、赶黄草苷B、山柰素-3-O-阿拉伯糖苷、阿福豆苷、山柰酚、原儿茶酸、乔松素-7-O-β-D-葡萄糖苷、儿茶素、没食子酸、乔松素对照品适量,精密称定,加入甲醇制成槲皮苷1.12 mg/mL、槲皮素-3-O-阿拉伯糖苷 1.79 mg/mL、槲皮素 3.76 mg/mL、芹菜素1.21 mg/mL、芦丁1.63 mg/mL、槲皮素-3-O-鼠李糖苷 1.67 mg/mL、山柰素 1.20 mg/mL、赶黄草苷A 1.56 mg/mL、赶黄草苷B 1.21 mg/mL、山柰酚-3-O-阿拉伯糖苷3.38 mg/mL、阿福豆苷1.25 mg/mL、山柰酚1.10 mg/mL、原儿茶酸2.34 mg/mL、乔松素-7-O-β-D-葡萄糖苷 1.13 mg/mL、儿茶素1.28 mg/mL、没食子酸1.83 mg/mL、乔松素1.83 mg/mL 单标溶液,从各单标溶液中吸取10 μL 混合配制成混标溶液。
2.3 质谱检测方法
2.3.1 色谱条件 Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm);流动相:0.05%甲酸水(A)-0.1%甲酸乙腈(B),梯度洗脱(0~30 min,5%~40% B;30~35 min,40%~80% B;35~40 min,80% B;40~40.2 min,80%~5% B;40.2~45 min,5% B);体积流量0.2 mL/min;进样量3.0 μL;柱温30 ℃;自动进样器温度4 ℃。
2.3.2 质谱条件 电喷雾离子源(ESI),正负离子电离模式,喷雾电压为3.5 kV,毛细管温度350 ℃,鞘气和辅助气均为高纯氮气,体积流量分别为10.5、3.0 L/min。分辨率70 000 进行全扫描,扫描范围m/z80~1200,质谱扫描时间40 min。
2.4 赶黄草数据库创建和分析
查阅国内外文献资料以及检索PubChem 数据库、进行数据采集,整理赶黄草药材所含的化学成分信息,包括化学成分、结构式、分子量等,构建赶黄草化学成分专属数据库,共收集整理105 种化合物。UPLC-Q-Exactive Orbitrap-MS 获得色谱峰一级、二级质谱,利用Thermo Scientific Xcalibur 软件计算出高分辨精确相对分子质量,快速推测各色谱峰对应化合物的分子式,并与部分对照品的保留时间及二级质谱数据对比,运用ChemDraw 软件绘制化合物结构并模拟碎片情况,与文献二级碎片进行对照,推断确认成分。
2.5 基于网络药理学赶黄草保肝机制预测
将鉴别的化合物依次输入TCMSP 数据库,依据口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18 筛选活性成分,TCMSP 数据库中未收载成分结合文献进一步筛选活性成分。运用PubChem 数据库查找活性成分SMILES 结构,将活性成分SMILES 结构输入SwissTargetPrediction 数据库预测成分靶点,合并去重后得到赶黄草活性成分靶点。通过OMIM 数据库、GeneCards 数据库(Score≥5)、DisGeNET 数据库(Score≥0.1)、TTD 数据库检索“hepatitis”与“hepatic injury”关键词,获取肝炎、肝损伤相关疾病靶点,合并去重后得到疾病靶点。运用微生信平台(https://bioinformatics.com.cn/)取疾病靶点与化合物靶点交集,将交集靶点导入String 数据库,评分条件设定为置信度>0.7,获得靶点间相互作用关系并导入Cytoscape 3.2.1 软件,构建蛋白质-蛋白质互作(protein-protein interaction networks,PPI)网络,同时计算degree 值,按照degree>20 条件筛选获得核心靶点。将核心靶点导入DAVID 6.8 数据库进行基因本体(gene ontology,GO)生物过程富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析,运用微生信平台实现数据可视化,并利用Cytoscape 3.2.1 软件进行拓扑计算,进一步筛选活性成分,构建“活性成分-核心靶点-通路”网络。
2.6 分子对接
将筛选出的活性成分与核心靶点依次进行分子对接。运用PubChem 数据库查找下载活性成分3D结构sdf 格式文件,进一步采用Open Babel GUI 软件将sdf 格式文件转化为pdbqt 格式文件。在PDB数据库下载核心靶点蛋白3D 结构pdb 格式文件。进一步使用Autodock Tools 1.5.6 对蛋白数据进行加氢、除水等处理并保存为pdbqt 格式。运用Autodock vina 对活性成分和核心靶点对接打分,采用PyMOL 2.5.4 制作活性成分与核心靶点的结合模式图。
3 结果
3.1 赶黄草化学成分鉴定
通过UPLC-Q-Exactive-MS 方法,在上述色谱和质谱条件下对赶黄草全草、茎、叶进样分析,得到样品正、负离子扫描模式的总离子流图,见图1。采用一级质谱全扫描和提取离子峰的方法,确定了赶黄草全草、茎、叶中64 个色谱峰(表1),其中确定49 个化合物,还有pinocembrin-7-O-[3′′-Ogalloyl]-glucoside 及同分异构体共5 个、赶黄草素A、赶黄草素B、赶黄草酮C、赶黄草酮D 及同分异构体共6 个、2′,6′-dihydroxydihydrochalcone-4′-O-[3′′-O-galloyl]-glucoside 及同分异构体共4 个。经过与对照品的保留时间、精准相对分子质量比较,准确鉴定出14 个化合物(赶黄草苷A、赶黄草苷B、阿福豆苷、儿茶素、槲皮素、槲皮素-3-O-阿拉伯糖苷、槲皮苷、芦丁、没食子酸、乔松素、乔松素-7-Oβ-D-葡萄糖苷、芹菜素、山柰酚、山柰酚-3-O-阿拉伯糖苷);通过与文献研究提供的保留时间、相对分子质量、结构式、离子碎片,推测了其他35 个化合物结构。49 个化合物包括黄酮、有机酸、木脂素、苯丙素类化合物。

表1 赶黄草化学成分UPLC-Q-Exactive-MS 色谱/质谱信息Table 1 Chromatographic and MS information of chemical composition of P.chinense by UPLC-Q-Exactive-MS

图1 赶黄草总离子流色谱图Fig.1 Total ion chromatogram of P.chinense
3.1.1 黄酮类成分质谱解析 黄酮类化合物在赶黄草中数量较多,主要为槲皮素、乔松素和山柰酚的衍生物,质谱裂解容易发生脱糖基、脱水、环裂解。正负离子扫描模式下,槲皮素在19.61 min 产生准分子离子m/z301.035 0 [M-H]−和m/z303.049 7[M+H]+,与槲皮素对照品一致。化合物13、16、18、20、22、24、25 均为槲皮素糖苷类化合物,正离子模式下产生m/z303 碎片离子(槲皮素苷元),负离子模式下产生m/z301 碎片离子(槲皮素苷元)。其中化合物16 保留时间为12.36 min,产生准分子离子[M+H]+m/z611.160 5(C27H31O16)和 [M-H]−m/z609.146 4(C27H29O16),与对照品比对确定为芦丁。化合物24 保留时间为14.73 min,产生准分子离子[M+H]+m/z449.107 4(C21H21O11)和 [M-H]−m/z447.093 7(C21H19O11),与对照品比对确定为槲皮苷。化合物20 和22 为同分异构体,正负离子模式下均产生准分子离子 [M+H]+m/z435.092 2(C20H19O11)和 [M-H]−m/z433.077 6(C20H17O11),正负离子模式下均丢失m/z132 产生槲皮素苷元碎片离子,推测为分别丢失木糖或阿拉伯糖部分,对比相关文献和对照品[7],鉴定化合物20、22 分别为槲皮素-3-O-木糖苷和槲皮素-3-O-阿拉伯糖苷。
化合物59 在30.64 min 处产生准分子离子m/z255.066 3 [M-H]−和m/z257.080 8 [M+H]+,与乔松素对照品一致。化合物35、46、55、56、60 均为乔松素糖苷类化合物,在正离子模式下产生m/z257碎片离子(乔松素苷元)、负离子模式下产生m/z255碎片离子(乔松素苷元)。化合物35、55、60 保留时间、准分子离子以及二级碎片离子与对照品一致,分别确定为乔松素-7-O-葡萄糖苷、赶黄草苷B、赶黄草苷A。化合物46 在26.10 min 处产生准分子离子m/z721.140 0 [M+H]+和m/z719.125 4 [MH]−,化合物56 在29.24 min 处产生准分子离子m/z873.150 9 [M+H]+和m/z871.136 3 [M-H]−,正负离子模式下,2 个化合物均产生m/z303/301(六羟基二苯基)、m/z257/255(乔松素苷元)、m/z153/151特征离子,分别推测为 pinocembrin-7-O-[4′,6′-HHDP]-glucoside、PGHG。化合物42 在23.41 min产生准分子离子m/z271.096 2 [M+H]+和m/z269.082 0 [M-H]−,产生m/z167/165 特征碎片,表明有甲基取代,推测为山姜素。化合物27 保留时间15.84 min,产生准分子离子 [M+H]+m/z433.148 9(C22H25O9),二级裂解失去葡萄糖基(162)生成m/z271.096 1 碎片离子,此外还产生m/z167.033 8 特征碎片离子,推测为山姜素-7-O-葡萄糖苷。
化合物41 在23.34 min 产生准分子离子峰m/z287.055 0 [M+H]+和m/z285.040 5 [M-H]−,与对照品比对确定为山柰酚。化合物19、26、29 均为山柰酚糖苷类化合物,在正离子模式下产生m/z287 碎片离子(山柰酚苷元)、负离子模式下产生m/z285碎片离子(山柰酚苷元)。化合物19、26、29 保留时间、准分子离子以及二级碎片离子与对照品一致,分别确定为山柰酚-3-O-芸香糖苷、山柰酚-3-O-阿拉伯糖苷、阿福豆苷。
其他黄酮类有化合物5、23、34、37、39、44、49,其中化合物5、39 保留时间、准分子离子以及二级碎片与对照品一致,确定为儿茶素和芹菜素。化合物23、34、37、44、49 的准分子离子以及二级碎片与文献一致[6-7,9-10],初步推测为柚皮素葡萄糖苷、芹菜苷、柚皮素、2',4',6'-trihydroydihydrochalcon-4'-glucoside、赶黄草苷。
3.1.2 木脂素类成分质谱解析 化合物50、54 均产生准分子离子 [M+H]+m/z343.117 3(C19H19O6),二级质谱裂解产生m/z325 和m/z203 特征离子,结合文献报道推测为赶黄草酮A 和赶黄草酮B[6]。
3.1.3 有机酸成分质谱解析 化合物1、2、6、7、8、10、11、12、14、17 均为有机酸类化合物,化合物2 保留时间、准分子离子以及二级碎片与对照品一致,确定为没食子酸。化合物7 保留时间为6.94 min,产生 [M+H]+m/z197.081 2(C10H13O4),二级质谱裂解产生碎片m/z179(C10H11O3,[M+HH2O]+),m/z151(C9H9O,[M+H-H2O‒CO2]+),推测为短叶苏木酚。化合物6 保留时间为6.57 min,产生准分子离子[M+H]+m/z293.028 6(C13H9O8),二级生成m/z247 [M+H-HCOOH]+、m/z219 [M+H-HCOOH-CO]+、m/z191 [M+H-HCOOH-2CO]+碎片,与文献报道一致[11],推测为短叶苏木酚酸。化合物 11 产生准分子离子 [M+H]+m/z307.044 8(C14H11O8),较短叶苏木酚酸多14,推测为甲基化物,在正离子模式下二级质谱产生m/z247、219、191 碎片离子,推测为短叶苏木酚酸甲酯。化合物17 产生准分子离子 [M-H]−m/z319.045 9(C15H11O8),较短叶苏木酚 [M-H]−m/z291.014 6酸多28,推测为乙基化物,根据碎片离子结合文献报道推测为短叶苏木酚酸乙酯[11]。化合物1、8、10、12、14 二级碎片与文献记载进行比对[6,12-14],初步推测为柯子次酸、香草酸、云实素、丁香醛、鞣花酸。
3.1.4 苯丙素类成分质谱解析 化合物15、30、31为苯丙素类化合物。化合物30、31 为同分异构体,产生准分子离子 [M +H]+m/z505.170 3(C25H29O11),二级碎片产生m/z325(C19H17O5,[M+H-H2O-C6H10O5]+)和m/z203(C12H11O3)特征碎片,结合文献报道[6]推测为 2,3'-dihydroxy-3-methoxy-6′-methanone-benzophenone-4-O-glucoside、2,4-dihydroxy-3-methoxy-6′-methanone-benzo-phenone-3'-O-glucoside。化合物15 产生准分子离子 [M-H]−m/z607.094 7(C26H23O17),二级碎片产生m/z437(C19H15O12,[M-H-C7H8O5]‒)、m/z293(C12H10O8,[M-H-C14H13O9]‒)特征峰,结合文献报道[9]推测为赶黄草苷C。
3.1.5 其他化合物质谱解析 化合物3、4、9、21、28、32、58,其中化合物3 在2.60 min 产生准分子离子m/z283.044 8(C12H11O8,[M+H]+),二级碎片产生m/z237(C11H9O6,[M+H-HCOOH]+)、m/z219(C11H7O5,[M+H-H2O-HCOOH]+)、m/z191(C10H7O4,[M+H-2HCOOH]+)的特征碎片,推测为penthorumnin B。化合物9 在8.35 min 处产生准分子离子m/z331.102 4(C14H19O9,[M+H]+),二级碎片产生m/z169(C8H9O4,[M+H-C6H10O5]+)、m/z151(C8H7O3,[M+H-H2O-C6H10O5]+)的特征碎片,推测为2,6-二羟基苯乙酮-4-O-葡萄糖苷。化合物4、21、28、32、58 二级碎片与文献记载对比[6,15],初步推测为岩白菜素、2,6-二羟基苯乙酮-5-(2′-亚甲基-2(5H)-呋喃酮)-4-O-葡萄糖苷、2,6-二羟基苯乙酮-4-O-[4′,6′六羟基联苯二酰基]−葡萄糖苷、penthorumnin C、2-hydroxyacetophenone-4-O-[4′,6′-hexahydroxydiphenoyl]−glucoside。
3.2 基于网络药理学赶黄草保肝作用机制预测
3.2.1 赶黄草活性成分筛选及其靶点预测 将上述49 个确定化合物输入TCMSP 数据库,依据口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18 筛选活性成分,数据库中未收载成分根据文献报道进一步筛选,得到活性成分28 个。将筛选出的活性成分输入PubMed 数据库查询活性成分SMILES 结构,将SMILES 结构输入SwissTargetPrediction 数据库预测成分靶点,合并去重后得到赶黄草活性成分靶点335 个。
3.2.2 疾病靶点获取 通过 OMIM 数据库、GeneCards 数据库(Score≥5)、DisGeNET 数据库(Score≥0.1)、TTD 数据库检索“hepatitis”与“hepatic injury”关键词,获取肝炎、肝损伤相关疾病靶点,将4 个数据库所得靶点合并后删除重复项,获得靶点1 554 个。运用微生信平台取疾病靶点与化合物靶点交集,获得交集靶点126 个,作为进一步分析的潜在作用靶点(图2)。

图2 成分靶点与疾病靶点韦恩图Fig.2 Venn diagram of component target and disease target
3.2.3 PPI 网络构建及核心靶点筛选 将126 个交集靶点导入String11.5 数据库,设置关联评分0.7,导出原始PPI 网络图(图3)并下载TSV 文件,将TSV 文件导入Cytoscape 3.2.1 软件,构建靶点PPI网络(图4)。结果显示有118 个节点(去除8 个孤立节点),710 条边,节点颜色越深,代表度值越大,说明该节点与其他蛋白相互作用多。以度值中位数的2 倍为界限筛选出24 个核心靶点,核心靶点具体信息见表2。

表2 24 个核心靶点具体信息Table 2 Specific information of 24 core targets

图3 交集靶点原始PPI 网络Fig.3 Original PPI network of intersection target
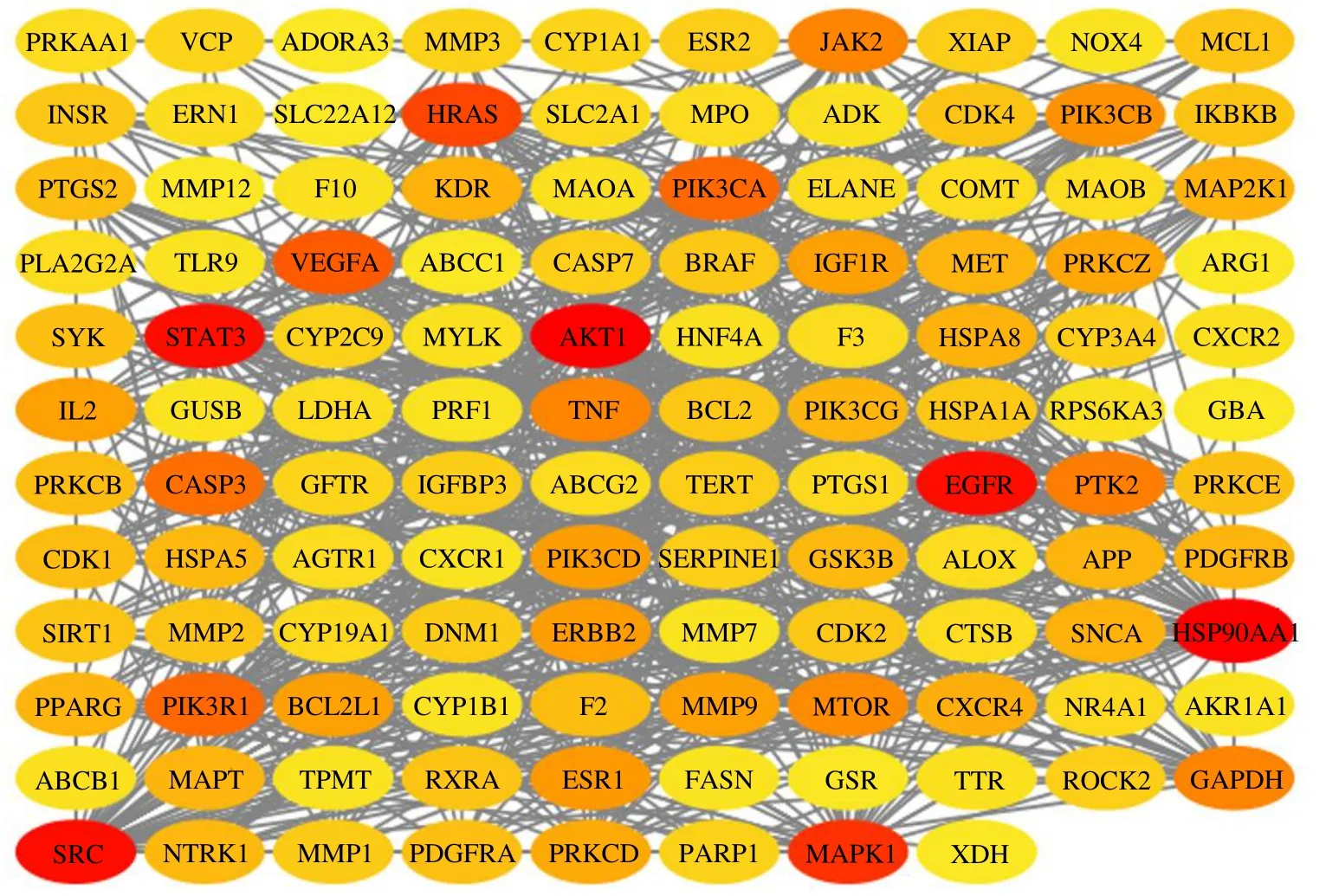
图4 交集靶点PPI 网络Fig.4 PPI network of intersection target
3.2.4 富集分析结果 将 24 个核心靶点导入DAVID 6.8 数据库进行GO 富集分析和KEGG 通路富集分析。GO 富集分析根据FDR≤0.05 筛选得到163 个GO 条目,其中生物学过程(bioprogress,BP)条目122 个,包括蛋白激酶B 信号转导的正调控、细胞迁移的正调控、凋亡过程的负调控、磷脂酰肌醇3-激酶信号、蛋白质磷酸化的正调控等方面;15个细胞组分(cell components,CC)条目,包括细胞质、细胞膜、质膜、细胞浆、细胞质核周区等方面;分子功能(molicular function,MF)条目26 个,包括激酶活性、胰岛素受体底物结合、相同蛋白结合、ATP 结合、蛋白磷酸酶结合等方面。取各项前20 条导入微生信平台进行可视化展示(图5)。KEGG 通路根据FDR≤0.05 筛选得到131 条通路,主要包括EGFR 酪氨酸激酶抑制剂耐药性、内分泌抵抗、癌症信号通路、HIF-1 信号通路等,取前20条信号通路进行可视化分析(图6)。

图6 KEGG 通路富集分析结果Fig.6 KEGG enrichment analysis results
3.2.5 “活性成分-靶基因-通路”网络构建 将28个活性成分、24 个核心靶点、KEGG 信号通路富集分析的前20 条通路导入Cytoscape 3.2.1 软件构建“活性成分-靶基因-通路”网络进行可视化分析,见图7。通过“Analyze Network”分析网络图,得到60个节点,359 条边,得到关键有效成分15 个(表3)。

表3 赶黄草关键有效成分Table 3 Key effective components of P.chinense

图7 “活性成分-靶基因-通路”网络Fig.7 Network of “active component-target gene-pathway”
3.3 分子对接验证
将筛选出的15 个关键有效成分与24 个核心靶点依次进行分子对接,有效成分见表3。对接结果显示,小于−5 kJ/mol 的结果占总数99.2%,−5~−7.0 kJ/mol 的结果占总数32.2%,小于−7.00 kJ/mol 的结果占总数的66.9%,关键有效成分与核心靶点结合能均小于−4.5 kJ/mol,显示他们具有良好的结合活性。GAPDH、PIK3CA、MTOR、SRC、PIK3CD 与各成分均具有良好的结合活性,其中2′,4′,6′-三羟基二氢查耳酮-4′-β-D-葡萄糖苷可与GAPDH、MTOR、CASP3、SRC 相结合,与MTOR 结合能最低为−9.9 kJ/mol,作用位点是残基谷氨酸49、半胱氨酸276、谷氨酰胺225、亮氨酸224;乔松素-7-O-葡萄糖苷可与GAPDH、MTOR、PIK3CA 相结合,与MTOR结合能为−9.0 kJ/mol,作用位点是精氨酸1945、亮氨酸1904、苏氨酸1908;赶黄草苷可与GAPDH、PIK3CA、SRC、PIK3CD 相结合,与PIK3CA 结合能最低为−9.0 kJ/mol,作用位点是半胱氨酸838、谷氨酰胺630、天冬酰胺756;槲皮素3,4'-二葡糖苷可与GAPDH、PIK3CA、PIK3CD、MTOR 相结合,GAPDH 结合能最低为−11.3 kJ/mol,作用位点是天酰胺287、天冬酰胺239、苏氨酸252、丙氨酸238;乔松素可与GAPDH、PIK3CA、PIK3CD 相结合,与PIK3CD 结合能为−8.2 kJ/mol,作用位点是苏氨酸471;鞣花酸可与PIK3CA、GAPDH、MTOR 相结合,与GAPDH 结合能最低为−10.4 kJ/mol,作用位点是脯氨酸236、亮氨酸203、丙氨酸238、天冬氨酸239、天冬氨酸287,分子对接模式图见图8。

图8 部分关键有效成分与核心靶点分子对接模式图Fig.8 Molecular docking diagram of some key active ingredients and core targets
4 讨论
赶黄草是云贵川地区常用保肝药材,其用药历史悠久,保肝疗效显著,在市场上已有单味药成方的中成药肝苏制剂,现阶段赶黄草研究报道相对较少,大部分集中在近十年,其相关研究尚不充分,中国药典尚未收载赶黄草药材。本实验分析研究了赶黄草主要化学成分,并结合网络药理学与分子对接探讨了赶黄草保肝药效物质和潜在作用靶点及作用机制,为赶黄草进一步研究开发提供一定的依据。
本实验利用UPLC-Q-Exactive Orbitrap-MS 技术对赶黄草中的化学成分进行分析。通过对照品、保留时间、碎片信息、自建数据库综合识别了赶黄草水提物的化学成分,结果共鉴定出64 个色谱峰,49 个化合物。其中黄酮化合物有26 种,木脂素化合物2 种,有机酸化合物10 种,苯丙素类化合物4种,其它化合物7 种。对比赶黄草全草、茎、叶化学成分,三者化学成分种类相差较小,后续需要对部分化合物进行定量,探究化合物含量差异,以期为赶黄草药材加工炮制提供一定帮助。
本研究网络药理学部分筛选出24 个核心靶点,网络拓扑参数分析计算的结果显示:HSP90AA1、STAT3、SRC 为度值排名前3 的靶点蛋白。利用Cytoscape 3.2.1 软件构建“活性成分-靶基因-通路”网络进一步筛选出的15 个关键有效成分中有11 个黄酮类化合物,2 个木脂素类化合物,2 个有机酸类化合物,说明这3 类物质可能是赶黄草主要保肝活性物质。分子对接结果显示,除没食子酸外其余成分均与度值排名前3 的靶点蛋白有强烈的结合活性。通过网络分析发现,赶黄草活性成分发挥保肝作用的主要通路有HIF-1、PI3K-Akt、VEGF、TNF等信号通路。研究报道HIF-1 通路可以调控TNF-α炎症因子,赶黄草可通过HIF-1 通路下调TNF-α 表达,抑制肝纤维化[16]。核心靶点中的HSP90AA1 是一种热休克蛋白,热休克蛋白具有分子伴侣活性,对于癌细胞的存活、增值、迁移及肿瘤血管的生成等功能至关重要,抑制HSP90AA1 表达,可以减少肿瘤细胞增殖,抑制核心靶点之一的VEGF 表达诱导的肿瘤转移,同时抑制肿瘤血管生成,降低肝癌病变风险[17]。此外,核心靶点中的PIK3R、PIK3CA、PIK3CB、PIK3CD 属于PI3K 亚基,有文献报道肝细胞癌中 Krüppel 样转录因子 8(Krüppelliketranscription factor 8,KLF8 ) 在人肝癌SMMC7721 细胞中也可能通过PI3K-Akt 信号通路诱导VEGFA 的表达,进而调控肿瘤血管新生[18]。STAT3 是机体内调控细胞增殖、凋亡、上皮-间充质转化(epithelial-mesenchymal transition,EMT)和糖代谢等多种生物过程的重要转录因子,在肝癌中会被过度激活,因此抑制STAT3 活性可抑制肝癌细胞增值[19]。SRC 是酪氨酸蛋白激酶,参与细胞内多条信号传导途径,已有研究报道当PKC-Pyk2/SRC 通路中的SRC 蛋白表达受到抑制,人源肝星状细胞HSC-LX2 的增殖就会被阻止[20]。
据相关文献报道山柰酚、乔松素和槲皮素都对对乙酰氨基酚诱导产生的肝损伤有明显的保护作用,乔松素保护机制可能是抑制肝细胞氧化应激,山柰酚和槲皮素保护机制可能与调控凋亡通路JNK 的表达水平有关[21-23]。槲皮素、没食子酸和鞣花酸对CCl4所致小鼠急性肝损伤具有保护作用,其机制可能与增强抗氧化损伤能力,降低TNF-α 炎症因子水平有关[24-25]。且槲皮素还可以通过诱导过氧化物酶体增殖物激活受体γ辅助因子1-α(peroxisome proliferator-activated receptor gamma coactivator 1α,PGC-1α)表达,激活脂肪酸β 氧化、减轻氧化应激以及抑制炎性反应,发挥雌激素样作用,最终改善肝细胞脂肪变性[26];鞣花酸能够通过抑制NF-κB/COX-2 炎症通路活化,抑制炎症反应及氧化应激,改善AKT基因转染诱导的小鼠非酒精性脂肪性肝病[27]。赶黄草酮A 可以抑制人肝癌细胞SMMC-7721 增殖,且对醋氨酚诱导的肝细胞HL7702 损伤具有保护作用[28-29],赶黄草酮B 对H2O2和醋氨酚分别诱导的肝细胞LO2损伤都具有一定的保护作用[30]。赶黄草苷保肝作用未查到文献报道,有待进一步研究。
综上所述,本研究借助 UPLC-Q-Exactive Orbitrap-MS 方法鉴定了赶黄草主要化学成分,并结合网络药理和分子对接技术预测赶黄草保肝潜在作用靶点及通路,为阐明赶黄草保肝药效物质基础,及进一步临床应用和机制研究提供实验依据。
利益冲突所有作者均声明不存在利益冲突