黑老虎果实中1 个新的联苯环辛烯型木脂素
刘 健 ,陶袁志,吴沁昱,马 静,陈俐亲,吴文明,金 岸 *
1.南华大学药学院,湖南 衡阳 421200
2.湖南医药学院药学院,湖南 怀化 418000
3.江西省人民医院(南昌医学院第一附属医院)药学部,江西 南昌 330006
黑老虎Kadsuracoccinea(Lem.) A.C.Smith 为五味子科南五味子属常绿木质藤本植物,原产于中国南部[1],其根茎在民间常用来治疗胃肠疾病和类风湿性关节炎[2-3]。据文献报道,从黑老虎中分离得到的化学成分有三萜、倍半萜、木脂素、甾体、单萜和氨基酸类等[4]。其中,木脂素和三萜类成分作为黑老虎的主要化学成分,具有抗炎、抗肿瘤、抗艾滋病病毒和保肝等功效[5-7]。目前,对于黑老虎化学成分的研究主要集中在根和藤茎上,而对于果实部位研究相对较少。
黑老虎果实民间又被称为“血藤果”“布福娜”“冷饭团”。黑老虎果实除含有丰富的维生素、氨基酸及多种微量元素外,还具有广泛的药用价值[8],因此可作为一种功能性水果进行开发利用。据相关文献报道,黑老虎果实中提取到的木脂素类成分具有一定的抗艾滋病病毒[9]及保肝活性[10],多酚与花色苷类成分具有抗氧化活性[11]。为进一步揭示黑老虎果实中的化学成分,丰富黑老虎化学成分结构类型,本实验从干燥的黑老虎果实中分离鉴定了11 个单体化合物(图1),其中,化合物1 为新化合物,鉴定为 (aS,7R,8R,8'S,7'R)-7-苄酰氧基-7,7',8,8'-四氢-4,5-亚甲二氧基-3,3',4',5',7'-五甲氧基-8,8'-二甲基-二苯并[a,c]环辛烯 {(aS,7R,8R,8'S,7'R)-7-dibenzoyloxy-7,7',8,8'-tetrahydro-4,5-methylenedioxy-3,3',4',5',7'-pentamethoxy-8,8'-dimethyl-dibenzo[a,c]cycloocten,1},已知化合物分别鉴定为3,4-二羟基-3',4'-二甲氧基-6,7'-环木脂素(3,4-dihydroxy-3',4'-dimethoxy-6,7'-cyclolignan,2)、kadsuralignan H(3)、(+)-(8S,8'R)-4,4'-二羟基-3,3',5'-三甲氧基木脂烷 [(+)-(8S,8'R)-4,4'-dihydroxy-3,3',5'-trimethoxylignan,4]、前戈米辛(pregomisin,5)、松脂醇(pinoresinol,6)、aromadendrane-4β,10β-diol(7)、nephthediol(8)、oplodiol(9)、1β,11-dihydroxy-5-eudesmene(10)、pubinernoid A(11)。化合物1 命名为血藤果素A,化合物2、4、7~11 为首次从该属中分离得到。同时,对分离得到的11 个单体化合物开展了抗炎活性评价。

图1 化合物1~11 的结构Fig.1 Structures of compounds 1—11
1 仪器与材料
LTQ-Orbitrap XL 质谱仪(赛默飞公司,美国);Bruker Avance(400、500 MHz)核磁共振波谱仪(布鲁克公司,德国);Autopol Ⅳ型旋光仪(鲁道夫公司,美国);J-810 型圆二色光谱仪(佳司科公司,日本);快速纯化制备色谱仪(三泰科技有限责公司,常州);柱色谱硅胶(40~63 μm,三泰科技有限责公司,常州);Sephadex LH-20 凝胶(GE 公司,美国);MCI 小孔树脂(75~150 μm,三菱化学,日本);Easysep-3030 Unimicro 全自动高效液相色谱仪(通微公司,上海);MULTISKAN MK3 酶标仪(赛默飞公司,美国);十八烷基硅烷键合填料(C18,50 μm,YMC 公司,日本);SHIMADZU LC-20A 制备液相色谱仪(岛津公司,日本);色谱柱ZORBAX Bonus-RP(150 mm×21.2 mm,7 μm,安捷伦公司制备柱,美国)及Eclipse XDB-C18(250 mm×9.4 mm,5 μm,安捷伦公司半制备柱,美国);色谱级甲醇(迈瑞达公司);分析纯试剂(奥普升化工有限公司,天津)。DMEM(批号SH30243.01B,Hyclone公司,美国),胎牛血清(批号SH30084.03,Hyclone公司,美国);PBS(批号C10010500BT,Life 科技公司,美国),胰酶(批号25200072,GIBCO 公司,美国),MTT(批号M5655-1G,Sigma 公司,上海);L-NIL(批号HY-12116,MCE 公司,美国);总一氧化氮检测试剂盒(批号S0023,上海碧云天公司)。
样品于2018 年采自湖南省怀化市通道县,经湖南医药学院汪冶教授鉴定为南五味子属植物黑老虎K.coccinea(Lem.) A.C.Smith 的成熟果实。样品(201801)保存于湖南医药学院药学院。
2 方法
2.1 提取与分离
取黑老虎干燥果实(32 kg),粉碎后加入75%的乙醇冷浸提取4 次,浓缩得到粗提物浸膏。加适量水将浸膏混悬,用石油醚萃取5 次并收集萃取液,浓缩得到石油醚部位的浸膏1.2 kg。石油醚浸膏用硅胶拌样后经硅胶柱色谱粗分,以石油醚-醋酸乙酯(15∶1~0∶1)梯度洗脱得到12 个组分(Fr.A~L)。
Fr.B(205 g)首先用MCI 柱(甲醇~水1∶3→1∶0)分离成4 个部分Fr.B1~B4。Fr.B1(50 g)用快速纯化制备色谱仪经ODS 色谱柱(甲醇~水1∶4→1∶0)得到馏分Fr.B1-1~B1-11,其中Fr.B1-5 经Sephadex LH-20 凝胶柱(二氯甲烷~甲醇1∶1)色谱分离得到2 个组分Fr.B1-5-1 和Fr.B1-5-2,Fr.B1-5-2 经反相制备型高效液相色谱(65%甲醇)得到化合物2(10.5 mg)和5(13.2 mg);Fr.B1-8 经半制备HPLC 分离得到化合物1(6.5 mg,tR=5.5 min;甲醇-水60∶40,3 mL/min)、化合物3(7.4 mg,tR=6.1 min;甲醇-水60∶40,3 mL/min)和Fr.B1-8-1(14.4 mg,tR=12.3 min;甲醇-水60∶40,3 mL/min),Fr.B1-8-1 再经半制备色谱柱反复纯化得到化合物4(6.2 mg,tR=19.8 min;甲醇-水55∶45,3.3 mL/min)和化合物6(6.8 mg,tR=17.8 min;甲醇-水55∶45,3.3 mL/min)。Fr.C 浸膏(140 g)通过MCI 梯度洗脱(甲醇-水1∶3→1∶0)后得到6 个组分Fr.C1~C6,其中的Fr.C3 经Sephadex LH-20(二氯甲烷-甲醇1∶1)柱色谱分离到4 个组分Fr.C3-1~C3-4,Fr.C3-2 经ODS 色谱柱(甲醇-水1∶4→1∶0)梯度洗脱得到4 个组分Fr.C3-2-1~C3-2-4,Fr.C3-2-2 经半制备HPLC 得到化合物9(9.3 mg,tR=10.8 min;甲醇-水60∶40,3 mL/min)和10(8.5 mg,tR=15.8 min;甲醇-水60∶40,3 mL/min),Fr.C3-2-3 经重结晶得到化合物8(11.3 mg);Fr.C3-3 经ODS 开放柱(甲醇-水1∶3→1∶0)及半制备HPLC 进一步纯化得到化合物7(7.4 mg,tR=10.4 min;甲醇-水65∶35,3 mL/min)和11(6.7 mg,tR=13.5 min;甲醇-水65∶35,3 mL/min)。
2.2 抗炎活性测定
2.2.1 细胞毒性实验 取正常生长的RAW264.7 细胞,以1×104个/孔接种到96 孔细胞培养板中,于5% CO2、37 ℃培养箱中培养过夜。以添加不含药物的培养基作为对照组,以分别加入终浓度为100 μmol/L 的待测样品(1~11)为给药组,每组设3 个复孔,继续在5% CO2、37 ℃条件下培养24 h。采用MTT 法测定并计算细胞存活率。若化合物对RAW264.7 细胞有毒性,则选择更低浓度重复上述实验,直至筛选到对RAW264.7 细胞无明显毒性的浓度,再以此浓度进行抗炎活性实验。
2.2.2 抗炎活性筛选 取正常生长的RAW264.7 巨噬细胞,以5×104个/孔接种于24 孔细胞培养板中,并于5% CO2、37 ℃培养箱中培养过夜。诱导型NO合成酶抑制剂(L-NIL)为阳性对照。设置空白对照组、LPS(1 μg/mL)组、LPS(1 μg/mL)+L-NIL(30 μmol/L)组和LPS(1 μg/mL)+化合物1~11(化合物3、5 用20 μmol/L,化合物2、4 用50 μmol/L,其余用100 μmol/L),培养24 h 后,收集上清液,按照NO 试剂盒说明书检测NO 含量。
3 结果
3.1 结构鉴定
1H-NMR 和13C-NMR 谱中(表1)显示2 个芳香质子信号δH6.53 (1H, s, H-6), 6.63 (1H, s, H-6') 和12 个芳香碳信号δC133.4 (C-1), 121.4 (C-2), 141.7(C-3), 136.2 (C-4), 148.6 (C-5), 102.8 (C-6), 133.0 (C-1'), 123.7 (C-2'), 151.9 (C-3'), 141.7 (C-4'), 152.1 (C-5'), 111.1 (C-6'),5 个甲氧基信号δH3.86 (3H, s), 3.09(3H, s), 3.58 (3H, s), 3.99 (3H, s), 3.04 (3H, s),1 个亚甲二氧基质子信号δH5.96 (2H, overlapped),由此推测化合物1 中存在联苯基团。在1H-1H COSY 谱(图2)中可看出-CH (H-7)-CH (H-8)-CH (H-8')-CH(H-7')-,-CH (H-8)-CH3(H-9)-和-CH (H-8')-CH3(H-9')-3 个相连片段;HMBC 谱(图2)中H-7 与C-2, 6相关,H-6'与C-7'相关,H-9 同C-7, 8, 8'相关,H-9'同C-7', 8'存在相关信号。以上数据表明化合物1具有联苯环辛烯类木脂素的基本骨架。此外,1H NMR 谱中证实化合物中还存在2 个甲基信号δH1.08 (3H, d,J= 7.3 Hz, H-9) 和1.03 (3H, d,J= 7.2 Hz, H-9');13C NMR 谱中还显示存在1 组苄酰氧基信号δC166.0 (C-1''), 129.8 (C-2''), 129.9 (C-3'', 7''),128.2 (C-4'', 6''), 132.1 (C-5'')[12]。

表1 化合物1 的1H- 和13C-NMR 数据 (400/100 MHz, CDCl3)Table 1 1H- and 13C-NMR data of compound 1 (400/100 MHz, CDCl3)

图2 化合物1 的结构以及主要HMBC、1H-1H COSY 相关Fig.2 Structure of compound 1 and key HMBC, 1H-1H COSY correlations
结合HMBC 谱分析,5 个甲氧基信号分别与C-3、C-3'、C-4'、C-5'、C-7'相关,由此确定5 个甲氧基分别位于C-3、C-3'、C-4'、C-5'和C-7'。亚甲二氧基质子信号与C-4 和C-5 有关联表明该基团连在C-4 和C-5 位上。H-7 (δH6.05, 1H, s) 和C-1''(δC166.0) 的HMBC 相关性证实了C-7 上存在苄酰氧基。根据以上数据分析得到化合物1 的平面结构。CD 谱中显示在225 nm 附近呈现正的Cotton 效应,240 nm 附近则呈现负值,表明1 具有S-联苯构型[13]。同时在NOESY 谱中(图3)显示H-6 与H-7, H-8 相关,H-6'与H-7', H3-9'相关,以及H3-9 与H3-9'相关,表明H-7',CH3-9'和CH3-9 是α 构型,H-7 是β 构型,化合物1 中的环辛二烯结构符合扭曲船椅式[14],其绝对构型为:C-7 (R), C-8 (R), C-8'(S), C-7'(R)。故化合物1 的结构鉴定为(aS,7R,8R,8'S,7'R)-7-苄酰氧基-7,7',8,8'-四氢-4,5-亚甲二氧基-3,3',4',5',7'-五甲氧基-8,8'-二甲基-二苯并[a,c]环辛烯。经Scifinder 数据库检索为新化合物,命名为血藤果素A。

图3 化合物1 的重要NOESY 相关Fig.3 Key NOESY correlations of compound 1
3.2 抗炎实验
3.2.1 细胞毒性评价 采用MTT 法,首先测定了在100 μmol/L 浓度下化合物1~11 对RAW264.7 细胞的毒性。结果表明(图4),在100 μmol/L 浓度下,化合物3 和5 显示出较强的细胞毒性,RAW264.7 细胞的存活率分别为2.00%和12.38%;化合物2 和4 具有一定的细胞毒性,RAW264.7 的存活率分别为75.32%和63.73%。因此,选择更低浓度测定化合物2~5 对RAW264.7 细胞的毒性。最终,化合物2 和4 在50 μmol/L 下,化合物3 和5 在20 μmol/L 下对RAW264.7 细胞无明显毒性。
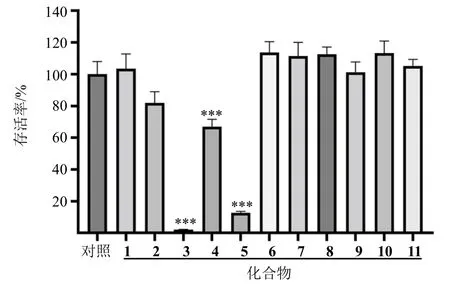
图4 RWA264.7 细胞化合物1~11 作用下的存活率Fig.4 Survival rates of RWA264.7 cells under effects of compounds 1—11
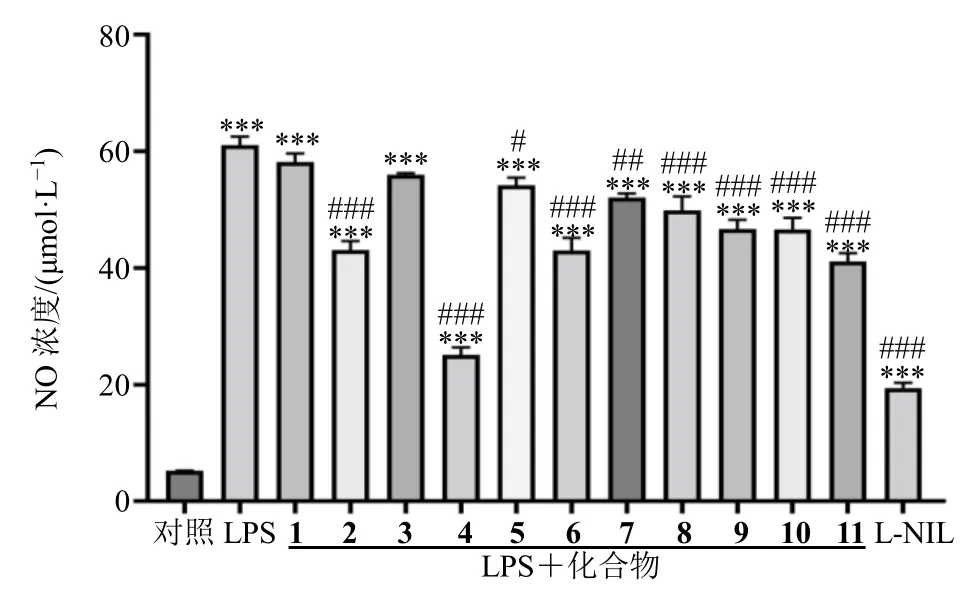
图 5 化合物1~11 对LPS 诱导RWA264.7 细胞生成NO的影响Fig.5 Effect of compounds 1-11 on NO production in RWA264.7 cells induced by LPS
3.2.2 抗炎活性的评价 本实验选择化合物3、5 浓度为20 μmol/L,化合物2、4 浓度为50 μmol/L,其余化合物浓度为100 μmol/L。结果表明(图5),与LPS 组相比而言,所有的化合物对NO 的释放都有一定的抑制效果,其中化合物4 在抑制NO 释放上展示出更好的效果,抑制率为64.45%。30 μmol/L 的L-NIL 作为阳性对照,抑制率为74.57%。
4 讨论
本研究从黑老虎果实的乙醇提取物中分离得到11 个多种类型的化合物包括1 个新的联苯环辛烯型木脂素、2 个环木脂素、2 个简单木脂素、1 个双环氧木脂素、4 个倍半萜及1 个单萜,充分的表明黑老虎果实中存在木脂素和萜类等化学成分。同时,本次研究发现,在100 μmol/L 时,化合物3 和5 对RAW264.7 细胞表现出较强的毒性。在浓度为50 μmol/L,无细胞毒性的条件下,化合物4 在抑制LPS诱导的RAW264.7 细胞释放NO 上表现出较好的效果,表明具有一定的抗炎活性。此外,黑老虎果实中除含有丰富的木脂素外,萜类成分也需得到足够的关注,值得进行深入研究,同时也为后续资源利用和产品开发奠定基础。
利益冲突所有作者均声明不存在利益冲突

