靶向线粒体质量控制防治骨质疏松症及其中药的治疗进展
谢芋涛,王想福,叶丙霖,陈伟国,赵 恒,张万乾,杨焕莹,杨建霞,陶瑜晶,任 毅
1.甘肃中医药大学,兰州 甘肃 730000
2.甘肃省中医院,兰州 甘肃 730050
骨质疏松症(osteoporosis,OP)是一种隐秘慢性的身体健康问题,往往直到骨折发生后,患者或医生才会对此加以关注。其主要表现为单位体积内骨骼的密度下降,降低了骨骼的强度,使得受涉及到的骨骼更容易发生骨折。目前,骨质疏松症已成为全球老年人群所面临的最主要的发病和死亡来源之一。OP 的病因是多方面的,包括遗传因素、性激素水平下降、年龄增长、饮食不合理、缺乏运动等。OP 的主要特征是疼痛、骨折和畸形[1]。流行病学显示OP 患病率随着年龄的增长而增加,在中国大陆,OP 总患病率从6.6%到19.3%(平均13.0%)不等。不同研究、不同地区、不同性别和不同骨骼部位的患病率差异很大,但城市与农村之间的差异很小[2]。相比西医治疗方案而言,中医药防治骨质疏松症具有多方面的优势,治疗方法相对安全、临床疗效显著优异、副作用较少等,依据中医“上工治未病”观念,近年来,单味药、中药复方、针灸等治疗方法逐渐成为医学研究的焦点,体现出中医药在骨质疏松症治疗中有潜力,但中药大规模的临床试验仍然相对不足,需要更多的临床研究来验证中医药治疗的疗效和安全性,此外中医药治疗骨质疏松的具体作用机制还不清楚,这使得中医药的疗效和有效成分难以明确,中医药治疗骨质疏松症缺乏统一的治疗标准,主观辩证可能采用不同的中药药方和治疗方法,难以进行比较和综合分析[3]。近年来,研究发现,线粒体功能障碍在骨质疏松的发展过程中的扮演着至关重要的角色,其功能发生异常和数量减少会导致骨细胞代谢紊乱,进而影响骨组织的结构和功能,表明线粒体质量控制(mitochondrial quality control,MQC)对缓解线粒体损伤和减缓OP的发展具有重要价值。因此,该研究旨在综述MQC在OP 领域的研究进展,并梳理各种针对MQC 治疗OP 的中药(包括单体化合物和复方),以期为开发骨质疏松的新疗法提供一些参考经验和思路。
1 MQC
线粒体是一个高度动态的双膜细胞器,它是最主要且富饶的三磷酸腺苷(adenosine triphosphate,ATP)来源,对于满足真核细胞的能量需求非常关键,在保持所有细胞功能正常运行方面,线粒体扮演着关键的角色[4]。参与真核细胞内的广泛功能,包括氧化还原平衡、钙稳态、能量产生、代谢和细胞死亡等。由于线粒体参与的细胞功能范围广泛,因此该细胞器在调解细胞平衡方面发挥着关键作用,因此,维持健康的线粒体对细胞存活至关重要[5]。MOC 是指细胞内一系列机制和过程,用于维持线粒体的健康和功能状态,它涉及线粒体内部的多个方面,包括线粒体膜电位维持、氧化还原平衡、自噬、线粒体DNA 的维护、融合和分裂、抗氧化防御以及基因调控等,通过这些机制,细胞可以确保线粒体正常工作、防止受损线粒体的积累,并维持细胞的健康状态。线粒体质量控制对于细胞和整体生物的正常功能和健康至关重要[6]。
2 MQC 与OP
OP 是一种常见的全身性骨骼疾病,其特性包括骨矿物质密度的下降、骨骼微观结构的变化,以及骨脆性增加,且好发于老年人。除了与年龄相关的OP 外,其他因素如糖皮质激素使用不当、雌激素缺乏、糖尿病和营养不良也是继发性OP 的常见原因。近些年,医药治疗的主要目标就是抑制破骨细胞的形成或刺激成骨细胞的生长。然而,目前OP 的临床治疗效果并不理想。破骨细胞介导的骨质破坏可能会发生,导致治疗效果受损。因此,迫切需要更有效的OP 治疗策略。研究发现线粒体氧化应激异常、动力学、自噬以及生物发生等特征的MQC 失衡在OP 中起到了重大的作用,这表明MQC 有可能会成为治疗OP 的关键手段。线粒体质量控制系统对OP 的调控靶标图见图1。
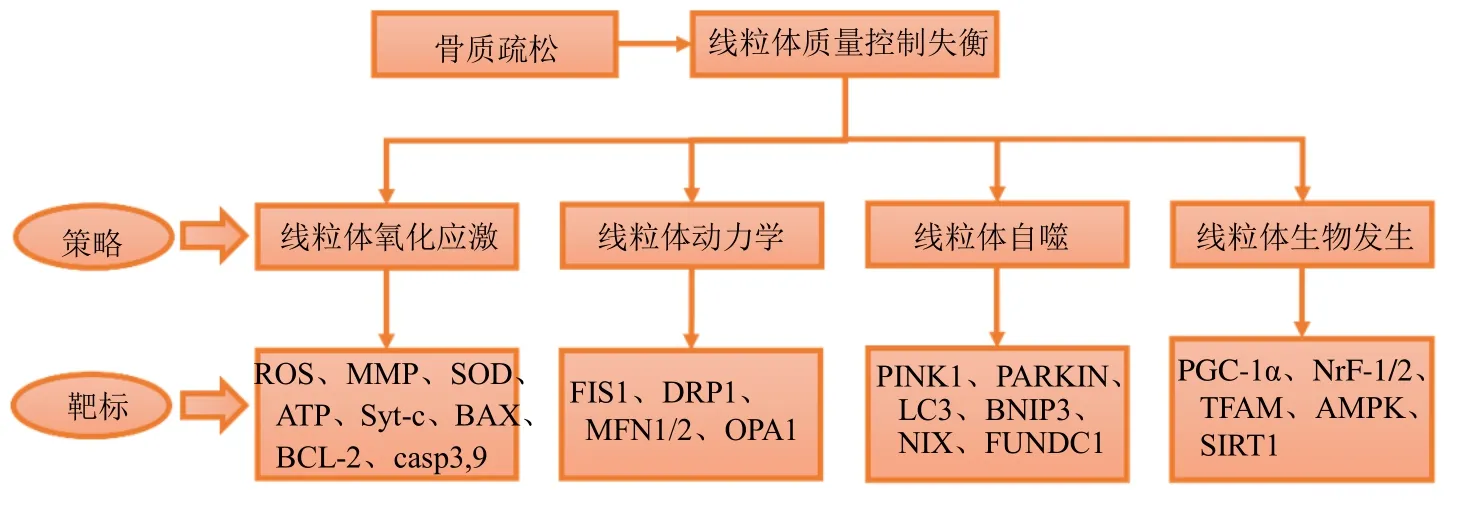
图1 线粒体质量控制系统对骨质疏松症的调控靶标Fig.1 Regulatory targets of mitochondrial quality control system to osteoporosis
2.1 线粒体氧化应激
在真核生物中,线粒体通过营养物质的氧化代谢产生 ATP,但也在同一过程中产生活性氧(reactive oxygen species,ROS),在正常情况下,线粒体会限制ROS 的过度产生,会通过抗氧化酶(超氧化物歧化酶、过氧化氢酶等)和抗氧化化合物(维生素E 和C、谷胱甘肽等)防御系统保护细胞器免受氧化损伤[7]。研究表明线粒体是成骨细胞能量代谢的重要物质,氧化应激导致的线粒体功能障碍直接参与了成骨细胞内在凋亡途径的激活[8],ROS 过载会导致磷脂双分子层受到自由基攻击,进而导致线粒体膜去极化,从而使线粒体膜孔打开,导致线粒体膜电位(mitochondrial membrane potential,MMP)损失。在这一过程中,线粒体膜的通透性增加,使线粒体膜间隙中的致凋亡因子细胞色素 c(cytochrome c,CytC)释放到细胞质中,释放到细胞质中的CytC 会与含半胱氨酸的天冬氨酸蛋白水解酶-9(cysteinyl aspartate specific proteinase-9,caspase-9)相互作用并激活caspase-9,而caspase-9是内在凋亡途径的主要初始步骤,激活的caspase-9会依次激活下游效应含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase),如含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,caspase-3)、含半胱氨酸的天冬氨酸蛋白水解酶-7(cysteinyl aspartate specific proteinase-7,caspase-7)最终完成成骨细胞死亡。此外,caspase 级联反应的激活受到各种调节因子表达的严格调控[9]。其中,由促凋亡蛋白和抗凋亡蛋白组成的B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)家族成员在决定细胞内在凋亡途径的进展中起着关键作用,作为促凋亡蛋白的代表,Bcl-2 相关X 蛋白(BCL2-associated X,Bax)位于线粒体外膜上,通过促进线粒体通透性转换或削弱线粒体外膜的屏障功能来诱导Cyt C 的释放。相反,抗凋亡蛋白Bcl-2 对于维持线粒体通透性和膜屏障稳定以抑制致凋亡因子的释放至关重要。因此,促凋亡和抗凋亡Bcl-2 家族蛋白之间的平衡是诱导激活caspase级联反应的决定性因素,而caspase级联反应是内在成骨细胞凋亡通路启动后的决定性因素[10-11]。Cai 等[12]学者进行的研究指出,在肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的共同培养下,从新生大鼠小腿分离出的成骨细胞内,ROS 和丙二醛的产生,NADPH 氧化酶(reduced nicotinamide adenine dinucleotide phosphate oxidase)的活性增加,线粒体内ROS 数量呈增加趋势,MMP和ATP 合成则出现下滑。此外,抗氧化酶(包括超氧化物歧化酶和过氧化氢酶)的活性被抑制,从而对线粒体功能产生了负面影响。He 等[13]发现人骨肉瘤MG63 细胞暴露于过氧化氢显着增加了细胞氧化应激,降低了碱性磷酸酶(alkaline phosphatase,ALP)活性和细胞活力,诱导成骨细胞凋亡。一并地,过氧化氢降低了线粒体膜的电位,提升了Cyt C及caspase-3 的水平,限制了Bcl-2 mRNA 和蛋白质的生成,减少了Runt-相关转录因子-2(runt-related transcription factor-2,Runx-2) mRNA 和蛋白质的制造。这些结果显示线粒体ROS 在介导线粒体功能障碍和促进成骨细胞凋亡方面的关键作用。
2.2 线粒体动力学
线粒体动力学是线粒体裂变和融合事件之间的一种微妙的生理平衡,是相对的过程,它们共同作用以维持线粒体的形状、大小、数量及其生理功能,受损线粒体基因组DNA、蛋白质和脂质与健康线粒体的交换需要内外膜的融合和裂变循环,以维持线粒体的健全结构和功能。线粒体融合的调控中涉及3 个因子,分别是线粒体融和蛋白 1 和 2(Mitofusin1/2,MFN1/2)以及视神经萎缩蛋白1(Optic atrophy 1,OPA1)。MFN1/2 主要定位于线粒体外膜,则OPA1 则处在线粒体内膜。MFN1/2 对于线粒体外膜的融合至关重要,而OPA1 对于内膜的融合是必需的,通过外膜上的MFN1 和MFN2 的寡聚化,将临近的线粒体连接在一起,介导外膜融合,后续则由OPA1 完成内膜的融合。线粒体融合的调控中涉及 2 个因子,线粒体裂变蛋白 1(mitochondrial fission protein 1,FIS1)和动力相关蛋白1(dynamin-related protein 1,DRP1)分别在线粒体外膜和细胞质。FIS1、线粒体裂变因子(mitochondrial fission factor,MFF)以及线粒体伸长因子 1/2(mitochondrial elongation factor 1/2,MIEF1/2),共同作用DRP1 可以从细胞质募集到线粒体表面,在那里它被组装成高寡聚环复合物以包裹线粒体,通过其三磷酸鸟苷(guanosine triphosphate,GTP)酶活性介导线粒体分裂[14-16]。线粒体动力学紊乱包括营养过剩和细胞功能障碍时发生的异常和/或受损的裂变/融合,直接影响线粒体功能,导致ROS 生成过多、线粒体酶活性改变、钙平衡受损、ATP 生成减少以及细胞能量代谢的整体降低。Cai 等[17]H2O2促进成骨细胞中L-OPA1 快速裂解为S-OPA1,导致融合活性L-OPA1 缺失,加剧线粒体碎裂和随后的成骨细胞凋亡,用OPA1siRNA转染小鼠成骨细胞会加重线粒体形态异常和功能障碍,主要表现为线粒体ROS 的产生显著增加以及线粒体膜电位的减少。此外,用OPA1 siRNA 转染小鼠成骨细胞会明显降低线粒体的长度和密度。Gan等[18]发现在氧化应激条件下,Drp1 的磷酸化水平和表达量都显著增加。通过药物抑制剂或基因敲除阻断Drp1,可明显保护细胞免受H2O2诱导的成骨细胞功能障碍的影响,具体表现为成骨细胞活力增加、ALP 活性和矿化度提高以及线粒体功能恢复。阻断Drp1 对H2O2诱导的成骨细胞功能障碍的保护作用表现为线粒体功能的增强和ROS 生成的抑制。这些结果显示线粒体动力学在介导线粒体功能障碍和促进成骨细胞凋亡方面的关键作用。
2.3 线粒体自噬
线粒体自噬的作用在于通过选择性自噬,清除受损或失效的线粒体,这对于维持线粒体的整体结构和功能至关重要。关于线粒体的识别与向自噬体的运输,可以通过2 种主要方法实现:一种是需要泛素(ubiquitin,Ub)的参与,另一种则无须Ub 即可完成。基于Ub 的线粒体自噬路径,由PTEN 诱导激酶1(PTEN-induced kinase 1,PINK1)和E3 泛素-蛋白连接酶(E3 ubiquitin-protein ligase,PARKIN)所控制的。在这一机制中,MMP 受损时,PINK1 进入线粒体内膜的途径受阻,导致PINK1 在线粒体外膜的胞质面上稳定聚集,募集并激活PARKIN,PARKIN 蛋白酶的空间构象发生改变,转化为活化的E3 泛素连接酶,然后泛素化线粒体上的蛋白,PINK1 与PARKIN 相互作用,共同调控线粒体自噬过程以维持线粒体质量。此外,除了PINK1-PARKIN 通路之外,还有非PARKIN 依赖性的泛素依赖性通路,PINK1 还可以通过泛素磷酸化直接招募自噬受体蛋白如BCL2 相互作用蛋白3(BCL2 interacting protein 3,BNIP3)、其同源物NIP3 样蛋白(NIP3-like protein X,NIX)、FUN14结构域蛋白1(FUN14 domain-containing protein 1,FUNDC1))到线粒体,受体蛋白募集自噬体中的微管相关蛋白1 轻链3(microtubule-associated protein light chain-3,LC3),这使得自噬体能够吞噬线粒体。非泛素依赖途径,线粒体外膜上有许多包含LC3 相互作用的长链反向重复序列(long inverted repea,LIR)区域的蛋白,它们是自噬的受体。它们可以不经泛素化直接与LC3 结合,从而启动线粒体自噬。在哺乳动物中,这些受体主要包括NIX 受体、BNIP3 受体、FUNDC1 受体[19-20]。线粒体自噬是一种正常的生理活动,在健康条件下发生可以维持细胞稳态。然而,在病理或特定的生理条件下,越来越多的证据表明,异常线粒体自噬在干细胞分化和骨代谢紊乱中起关键作用。Li 等[21]研究发现PINK1/PARKIN 介导的线粒体自噬可以降低血浆高级氧化蛋白产物(advanced oxidative protein product,AOPP))度并抑制AOPP诱导的成骨细胞凋亡,从而改善AOPP 积累相关的骨质流失,骨微观结构破坏和骨矿物质密度损失。Lee 等[22]研究发现成骨细胞的分化在Pink1 下调时受到抑制,伴有线粒体稳态受损(用Pink1 siRNA处理后,在分化过程中观察到成骨细胞中DRP1 和FIS1 上调,而MFN1 下调)、成骨细胞线粒体在分化过程中ROS 过度产生和钙摄取异常,证明了分化过程中成骨细胞中PINK1 的表达增加。Xu 等[23]研究发现线粒体自噬相关蛋白HIF-1α 和BNIP3 在缺氧环境中均上调,而当暴露于糖皮质激素时它们的表达下调。另外,当缺氧的环境下,HIF-1α 的过度表达可以抑制糖皮质激素诱发的细胞死亡,这就证实了HIF-1α 的过度表达能够通过其下游的标记物BNIP3 来减轻糖皮质激素对缺氧诱发的线粒体自噬关联蛋白抑制的效果,并保护骨细胞免受凋亡。这些结果显示线粒体自噬在介导线粒体功能障碍和促进成骨细胞凋亡方面的关键作用。
2.4 线粒体生物发生
线粒体生物生成可维持线粒体的数量和大小,主要是指过氧化物酶体增殖物激活受体γ 共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)与多种转录因子/蛋白质相互作用来调控线粒体的生物生成过程,例如核呼吸因子-1、核呼吸因子-2(nuclear respiratory factor 1/2,NRF-1/2)、线粒体转录因子A(mito chondrial transcription factor A,TFAM)、解偶联蛋白(Uncoupling protein,UCP)、过氧化物酶体增殖物激活受体-α(peroxisome proliferator activated receptorα,PPAR-α)、甲状腺激素、雌激素相关受体(estrogen-related receptors,ERRs)等。NRF-1、NRF-2 通过促进TFAM 表达,可调节主要线粒体酶的转录和线粒体DNA 的合成。除了这些转录因子外,还有2 种重要的酶被视为调节线粒体生物生成的代谢传感器,它们是腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)和沉默信息调节因子1(sirtuin1,SIRT1),在能量缺乏状态下,AMPK 和SIRT1 分别通过磷酸化和去乙酰化调节PGC-1α[23]。Peng 等[24]研究发现高压氧、运动和联合治疗改善了大鼠的骨微结构恶化和卵巢切除术诱导的骨质流失,促进了成骨细胞相关基因和氧化代谢相关基因(PGC-1α)的表达,对破骨细胞相关mRNA 表达和骨吸收标志物具有显着的抑制作用,此外,运动和运动-HBO 联合治疗增加了血清超氧化物歧化酶(superoxide dismutase,SOD)和硬化素的表达,可能与超氧化物歧化酶增加和PGC-1α 上调有关。研究发现PGC-1α 在骨代谢中起关键作用,体内研究表明,PGC1α 缺失会对皮质厚度、小梁组织和屈曲阻力产生负面影响,导致骨折风险增加[25]。Sánchez 等[26]研究发现线粒体含量的增加导致了从成骨细胞向骨细胞转变过程中ROS水平的增加,作为氧化应激的主要传感器,转录因子NF-E2相关因子2(nuclear factor erythroid2-related factor 2,NRF2)在成骨细胞形成过程中被激活,并直接转录激活一些成骨细胞特异性基因,如牙本质基质蛋白1(dental matrix protein 1,DMP1)、基质细胞外磷酸糖蛋白( matrix extracellular phosphoglycoprotein,Mepe)等。此外,骨细胞和成熟成骨细胞中缺乏NRF2 的小鼠是骨质减少的,用NRF2 激活剂二甲基甲酰胺(dimethylformamide,DMF)治疗切除卵巢的小鼠,可恢复其骨质流失表型。研究显示绝经后妇女由于脂质代谢和血脂水平异常导致雌二醇流失,骨骼肌和脂肪组织中容易出现脂肪堆积过多,在骨骼肌和脂肪组织中,与能量代谢和脂肪酸氧化相关的基因PGC-1α 和ERRα 的基因被下调,导致脂肪合成和脂质代谢物积累增加,骨髓中脂质过度积累会导致绝经后妇女骨质快速流失、骨质疏松症和骨折风险增加[27]。这些结果显示线粒体生物发生在介导线粒体功能障碍和促进成骨细胞凋亡方面的关键作用。
3 以MQC 为靶点的OP 中药防治
基于MQC 的防治措施可能是治OP 的重要策略。众多研究已经揭示,相关中药单体、小分子化合物及生物制剂等可通过调控成骨和破骨细胞分化代谢,能够恢复骨骼的形态和功能,从而减缓OP 的发展。中医药靶向调控MQC 防治OP 研究情况见表1。
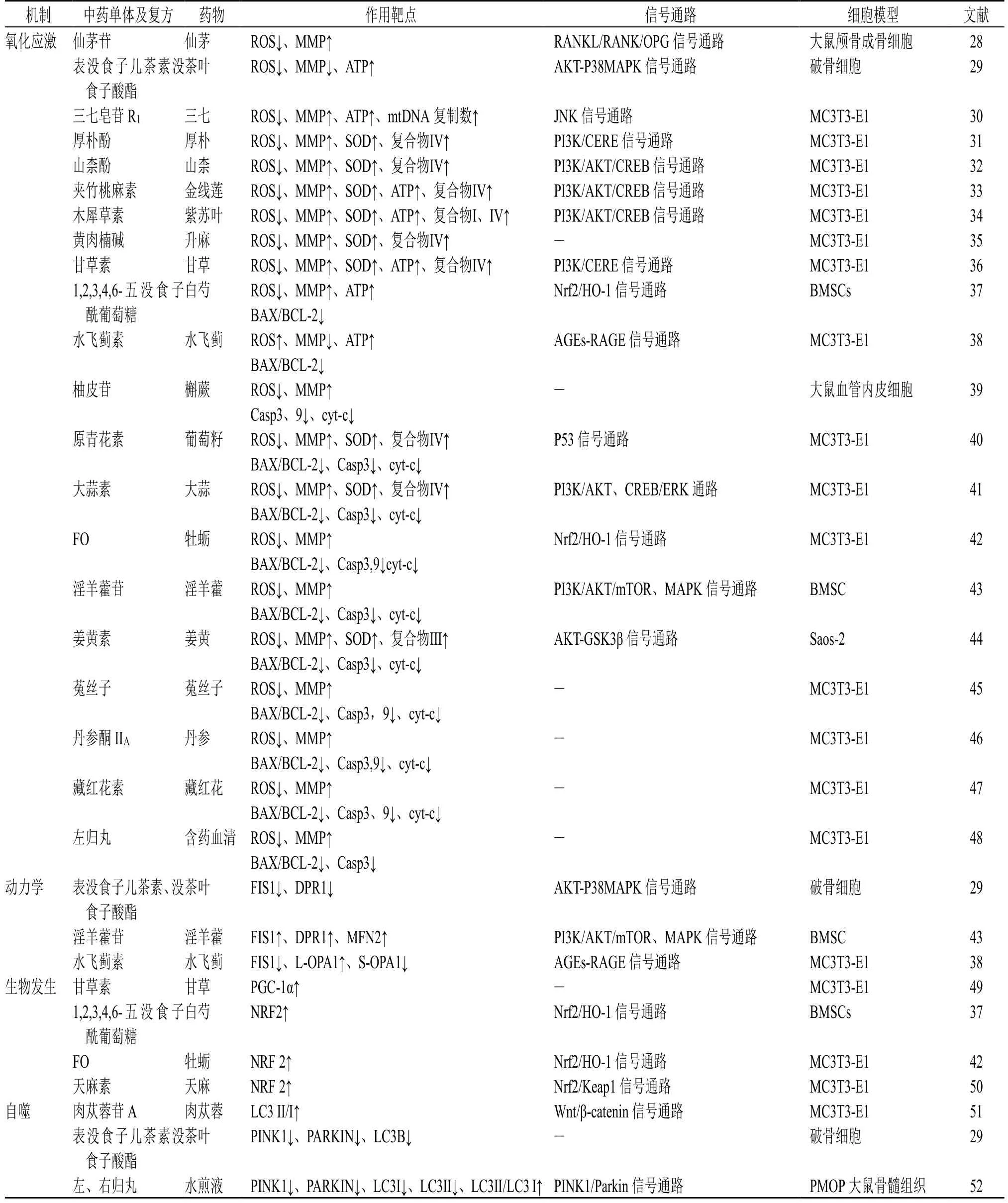
表1 中医药靶向调控线粒体动力学质量控制防治OPTable 1 Research on Chinese medicine targeting regulation of mitochondrial kinetics quality control against OP
3.1 基于线粒体氧化应激防治OP
研究发现仙茅苷保护成骨细胞免受地塞米松诱导的氧化应激损伤,明显减少ROS 产生,提高MMP水平,促进成骨细胞增值和分化,同时仙茅苷提高破骨细胞抑制因子(osteoclastogenesis inhibitory factor,OPG)与破骨细胞分化因子(receptor activator of nuclear factor-κB ligand,RANKL)的相对比值,有效抑制破骨细胞的生成,减少了炎性细胞因子表达抑制破骨细胞生成[28]。研究发现表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)在破骨细胞分化过程中下调了促炎标志物的表达,明显降低细胞内和线粒体ROS 形成,降低了MMP 以及AKT 和p38MAPK 的磷酸化,此外,在破骨细胞分化过程中,EGCG 导致ATP 的产生增加,改善了整体线粒体功能,抑制了破骨细胞的分化[29]。研究显示三七皂苷R1恢复了在氧化应激造成损伤成骨细胞中ALP 等表达水平下降,显着恢复了MMP,改善了线粒体ROS 的产生,并增加ATP 的产生以及线粒体DNA 复制,此外,三七皂苷R1显著阻止了JNK 磷酸化,有效地阻断了H2O2诱导的JNK 信号激活,表明三七皂苷R1通过阻断JNK 信号通路显著减弱氧化应激诱导的线粒体损伤,恢复成骨细胞的成骨分化[30]。研究发现厚朴酚、山柰酚、夹竹桃麻素、木犀草素、黄肉楠碱、甘草素都可以恢复抗霉素A 诱导的细胞内MMP 耗散、ATP 丢失、复合物Ⅳ失活、细胞内钙升高和细胞色素C 释放,显著减少抗霉素A 诱导的细胞损伤。此外,还能诱导被抗霉素A 抑制的PI3K、Akt 和CREB 的活化,表明PI3K/AKT/CREB 信号通路可能参与这些中药诱导的细胞保护反应。所有研究表明它们都可减少衰老过程中线粒体功能障碍,显着预防骨质疏松症患者的成骨细胞损伤[31-36]。通过进一步总结发现,1,2,3,4,6-五没食子酰葡萄糖(1,2,3,4,6-pentyl-Ogalloyl-β-D-glucose,PGG)、水飞蓟素、柚皮苷、原青花素、大蒜素、FO、淫羊藿苷、姜黄素、菟丝子、丹参酮ⅡA、藏红花素、左归丸等能够减少细胞内和线粒体的ROS 产生,恢复MMP 水平,增加ATP 产生,改善体线粒体功能,恢复Bcl-2 蛋白的表达上调,降低Bax 蛋白的表达,抑制CytC 释放到细胞质中,同时降低caspase-9、caspase-3,从而发挥具有抗成骨细胞凋亡的作用[37-48]。
3.2 基于线粒体动力学防治OP
研究发现在破骨细胞分化过程中,添加EGCG可以减少DRP1 和FIS1 的mRNA 表达量,抑制了破骨细胞的分化[29]。研究发现淫羊藿苷治疗可以挽救铁超负荷抑制的骨髓间充质干细胞的成骨分化和增殖,研究观察到DRP1 和CytC 蛋白从细胞质向线粒体的转移以及FIS1 和MFN2 的表达被10 和50 μmol/L 枸橼酸铁铵(ferric ammonium citrate,FAC)处理后促进,而被100 μmol/L FAC 处理后显著抑制,当加入1 μmol/L 的淫羊藿苷发现其能够促进FIS1 和MFN2 表达,并增加DRP1 和CytC 蛋白从细胞质到线粒体的转移,防止铁超载引起的骨髓间充质干细胞功能障碍,这些作用与线粒体融合和分裂的调节、PI3K/AKT/mTOR 通路的激活以及ERK1/2 和JNK 通路的抑制有关[43]。研究发现水飞蓟素通过AGEs-RAGE 信号通路来减弱晚期糖基化终末产物(advanced glycosylation end products,AGEs)诱导的成骨细胞凋亡,水飞蓟素有效地消除了AGEs 诱导的线粒体形态学改变,线粒体长度和密度的增加,细胞内L-Opa1的表达明显增加,S-Opa1和Fis1 的水平降低,改善线粒体的异常裂变/融合[38]。
3.3 基于线粒体生物发生防治OP
研究发现甘草素显著增加一氧化氮和PGC-1α水平,表明甘草素可能诱导线粒体生物发生[49]。研究发现PGG 在氧化应激环境下对成骨细胞的保护作用可能与促进Nrf2 入核、增强HO-1 表达有关,体内外实验证明,PGG 可促进骨形成,具有骨保护作用,该作用可能与激活Nrf2/HO-1 通路,改善线粒体功能从而抗成骨细胞凋亡有关。FO 逆转了H2O2导致的细胞内ROS 生成增加和线粒体损伤,最终抑制了细胞凋亡[37]。在这一过程中,FO 激活了Nrf2,并促进了其下游靶蛋白HO-1 的表达,从而缓解了氧化应激,同时增强了抗氧化能力。天麻素干预能够缓解地塞米松处理引起的细胞增殖受阻及凋亡,表明天麻素具有缓解骨质疏松的效果,进一步研究发现天麻素可能是通过促进Nrf2、HO-1 等表达,抑制Keap1 表达,来缓解氧化应激引起的线粒体膜电位改变,从而促进成骨细胞分化以及成骨结节形成来缓解地塞米松引起的骨质疏松[42]。
3.4 基于线粒体自噬防治OP
研究发现在破骨细胞分化过程中,添加EGCG 后PINK1、PARKIN、LC3B 的mRNA 表达量降低,抑制了破骨细胞的分化[29]。研究发现肉苁蓉苷A 可以增加成骨细胞分化和矿化,肉苁蓉苷A 通过增加细胞中LC3-Ⅰ、Ⅱ的表达以及提高Wnt/β-catenin 信号通路的活性,减少了细胞凋亡并促进了自噬,自噬抑制剂3-MA的加入抑制成骨分化,并抑制了Wnt/β-catenin 信号通路的活性,增加了细胞凋亡,同时降低了自噬水平,肉苁蓉苷A 和DKK-1 的组合导致更高水平的细胞凋亡,但自噬水平较低。因此,基于Wnt/β-catenin 信号通路,肉苁蓉苷A 是原发性成骨细胞自噬的有效诱导剂和凋亡的抑制剂,从而增强了成骨分化[51]。研究发现模型组及各给药组LC3Ⅱ/LC3Ⅰ均显著低于假手术组,但各给药组LC3Ⅱ/LC3Ⅰ均高于模型组,说明左、右归丸能促进LC3Ⅰ向LC3Ⅱ转换,改善线粒体自噬水平,左、右归丸在促进骨形成的同时,能影响PINK1、PARKIN 等蛋白的表达,说明左、右归丸可能通过调控PINK1/PARKIN 信号通路改善线粒体自噬水平,进而调节骨代谢,这可能是左、右归丸防治PMOP 的新靶点[52]。中医药调控线粒体质量控制防治骨质疏松的作用机制示意图见图2。
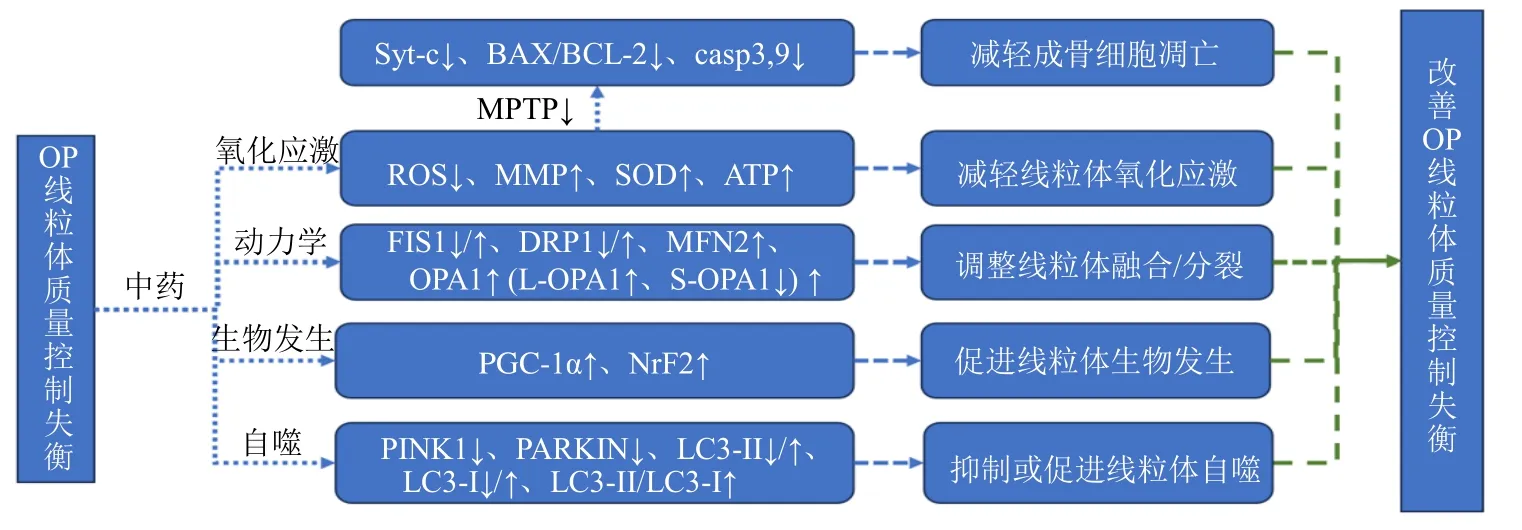
图2 中医药调控线粒体质量控制防治骨质疏松的作用机制Fig.2 Mechanism of action of Chinese medicine in regulating mitochondrial quality control against osteoporosis
4 结语及展望
近年来,研究揭示了MQC 与OP 线粒体新陈代谢和适应性调整的紧密关联。在病理状态下,如线粒体的氧化应激、融合和分裂的不均衡、自噬功能障碍以及mtDNA 的突变,都可能引发线粒体的功能性损害和OP 的产生。然而,MQC 可以通过抗氧化系统减缓ROS 对细胞产生的氧化伤害,并通过生物生成来补充线粒体储备;同时也可以通过线粒体动力学改变形状和大小,并通过自噬来清理受损的内部结构以维持其功能。因此,MQC 所参与的机理可能成为干涉治疗OP 的潜在目标。本文回顾了MQC 在OP 中的研究进展,阐释了化学药物、生物制剂和中药(包括单体化合物和复方)通过调节氧化应激反应、线粒体动态、线粒体自噬以及线粒体生物生成等相关因素的表达,从而调控MQC,以修复线粒体的形状和功能,治疗OP 的可能性。
综上所述,线粒体质量控制在维持细胞健康和功能方面发挥着关键作用,但与骨质疏松症的关联仍然需要更多深入的研究,尽管与线粒体质量控制相关的研究已经在其他领域取得了很大进展,但目前对线粒体与骨质疏松症之间的具体关系仍然存在研究不足的情况。一些初步的研究提示,线粒体功能和健康可能与骨骼健康有关,但具体的机制和影响尚未完全理解,需要更多的研究来深入探讨线粒体在骨质疏松症中的作用以及与该疾病的具体关联,这可能包括研究线粒体功能和结构在骨骼细胞中的作用,以及线粒体相关的遗传变异是否与骨质疏松症的风险有关。相信随着科学的不断进步,我们可以期待更多关于线粒体与骨质疏松症之间关系的深入了解,这可能有助于开发更好的治疗方法和预防措施。
利益冲突所有作者均声明不存在利益冲突

