基于HPLC 指纹图谱及化学模式识别对比研究曲花紫堇及同属药材
李惠敏,李凤超,高必兴,郭佳晨,张 艺,蒋桂华, *,尹显梅, *
1.成都中医药大学药学院,西南特色中药资源国家重点实验室,中药材标准化教育部重点实验室,四川 成都 611137
2.成都中医药大学 民族医药学院,四川 成都 611137
3.四川省药品检验研究院/国家药品监督管理局中成药质量评价重点实验室,四川 成都 611731
罂粟科紫堇属藏药始载于《月王药诊》,后续《宇妥本草》《晶珠本草》等藏医药经典著作对其均有记载,多以全草入药,性甘味寒,在藏医中多用于清热解毒、止血镇痛、活血散瘀、祛风利气,主治热性病、肝热、脉热、血热、肝炎、流感、疫疠、高血压、瘫痪、跌打损伤、痈疖等[1],在瘟病时疫中使用也较多,是藏医临床常用特色药材,在南北各地均有分布,但以西南地区最集中,大部分药用植物主要分布在青海、四川、西藏、甘肃及云南等西南高山,生长在海拔2 500~5 000 m 的灌丛、高山草地、流石滩等环境。紫堇属植物含有丰富的化学成分,包含生物碱[2-4]、黄酮[5]、挥发油[6],甾体[7]、苯丙酰胺类[8]、萜类[9]等活性成分,具有抗菌、抗炎、镇痛、抗心律失常、保肝、杀虫、抗疟、抗肿瘤等作用,对心血管系统、中枢神经系统、平滑肌等具有药理作用[10]。
因资源分布、用药习惯差异等因素,紫堇属藏药的多基原、地域性现象十分突出,这类藏药基原复杂,在历代藏本草和标准中收载情况不尽相同,各地实际使用药材基原大不相同,其来源涉及紫堇属多种植物[10]。如藏药“丝哇”在流通使用过程中,常出现地区习用品、替代品或混淆品,均作为清热止痛药入方剂或者单独使用,性状相似,难以明辨真伪。如收载于《四川省藏药材标准》(2020 版)的“玉珠丝哇”,是紫堇属植物曲花紫堇Corydalis curvifloraMaxim.的干燥全草,功效为清热利胆,止血镇痛,止渴,用于“赤彩”病、胆囊炎、肝炎、瘟病、隐热、“陈旧热”、烧伤等[11]。同属植物暗绿紫堇C.melanochloraMaxim.的干燥全草作为“德哇”也收载于该标准中,二者是传统藏医药治疗热症的药材来源之一。前期调研发现,市售及藏医临床使用的“丝哇”药材还来源于紫堇属多种植物,如斑花黄堇C.conspersaMaxim.、粗糙黄堇C.scaberulaMaxim.、赛北紫堇C.impatiens(Pall.)Fisch.、灰绿黄堇C.aduncaMaxim.、条裂黄堇C.linarioidesMaxim.等,不同基原的紫堇属药材功效主治和用法用量有一定差异,众多基原植物的“丝哇”药材同等入药,不利于市场监管,也对质量可控性及临床使用规范性造成一定困扰。因此对紫堇属混淆药材进行鉴别研究,可为该属药材质量控制提供参考。
中藏药的多组分复杂体系以及化学成分的多样性和复杂性是质量评价的重点与难点。指纹图谱可以整体表征被测样品主要化学成分的特征,能较为全面地反映中药及其制剂中所含化学成分的信息及不同样品间的相互关系,进而对药品质量进行整体描述和评价[12],是目前公认的最适合中药及天然药物物质群质量控制的手段之一[13]。化学模式识别方法能更全面和系统地对药材进行评价,主要包括主成分分析、聚类分析、判别分析等[14]。指纹图谱结合多元统计分析可以对复杂的化学数据信息进行整合,更加形象地反映不同样品间的差异。因此,本研究主要针对化学成分,首次建立曲花紫堇药材指纹图谱,再通过建立的指纹图谱方法与同属14 种药材进行对比鉴别;并对与其形态上极易混淆的暗绿紫堇进行化学模式识别研究,为优选曲花紫堇质量控制指标、完善紫堇属药材质量评价体系提供参考,为紫堇属药材鉴别提供新方法,为该属药材资源的合理开发、市场的规范发展及临床使用提供科学的依据。
1 仪器与试药
1.1 仪器
Ultimate 3000 型高效液相色谱仪;BT125D 型十万分之一电子天平(德国Sartorius 公司);BP121S 型万分之一天平(德国Sartorius 公司);Milli-Q Direct 型超纯水系统(德国Merck 公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);ZBRTD-211 型电子恒温水浴锅(常州智博仪器有限公司)。
1.2 试药
新绿原酸(批号 MUST-21030108)、绿原酸(批号 MUST-21030304)、原阿片碱(批号 MUST-19110711)、紫堇灵(批号MUST-19052702)、乙酰紫堇灵(批号MUST-20052703)、芦丁(批号MUST-21011510)、紫云英苷(批号MUST-21022410)、烟花苷(批号MUST-21040704)、槲皮素(批号MUST-20101104)、山柰酚(批号MUST-20082818)均购自成都曼思特生物科技有限公司,质量分数均≥98.0%;甲醇为色谱纯;水为超纯水;其他均为分析纯。
60 批药材样品经成都中医药大学蒋桂华教授鉴定,分别为曲花紫堇C.curvifloraMaxim.ex Hemsl.、暗绿紫堇C.melanochloraMaxim.、斑花黄堇C.conspersaMaxim.、钩距黄堇C.hamataFranch.、粗糙黄堇C.scaberulaMaxim.、密穗黄堇C.densispicaC.Y.Wu、条裂黄堇C.linarioidesMaxim.、紫堇C.edulisMaxim.、叠裂黄堇C.dasypteraMaxim.、白穗紫堇C.trachycarpavar.LeucostachyaC.Y.Wu et H.Chuang.、糙果紫堇C.trachycarpaMaxim.、灰绿黄堇C.aduncaMaxim.、草黄堇C.stramineaMaxim.ex Hemsl.、赛北紫堇C.impatiens(Pall.) Fisch.及小花黄堇C.racemosa(Thunb.) Pers.的干燥全草。样品信息见表1。

表1 样品信息Table 1 Sample information
2 方法与结果
2.1 指纹图谱的建立
2.1.1 对照品溶液的制备 取新绿原酸、绿原酸、原阿片碱、紫堇灵、乙酰紫堇灵、芦丁、紫云英苷、烟花苷、槲皮素及山柰酚对照品适量,精密称定,加70%甲醇制成质量浓度分别为0.032、0.026、0.044、0.129、0.179、0.070、0.030、0.036、0.051、0.047 mg/mL 的混合对照品溶液。
2.1.2 供试品溶液的制备 称取曲花紫堇(过四号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声处理30 min,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.1.3 色谱条件 色谱柱:Agilent ZORBAX Extend C18(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.2%磷酸水溶液(B),梯度洗脱(0~5 min,5%~16%A;5~25 min,16%~20% A,25~32 min,20%~25% A;32~45 min,25% A;45~60 min,25%~35% A;60~70 min,35%~40% A;70~80 min,40%~60% A;80~85 min,60%~90% A;体积流量1.0 mL/min;检测波长298 nm;柱温30 ℃。
2.1.4 精密度试验 取“2.1.1”项下混合对照品溶液,按“2.1.3”项下的色谱条件连续进样6 次,记录指纹图谱,以4 号峰(绿原酸)为参照峰,计算共有色谱峰的相对保留时间及相对峰面积度的RSD 小于1.0%,结果表明仪器精密度良好。
2.1.5 重复性试验 取同一批曲花紫堇粉末(Q1)6 份,按“2.1.2”项下方法制备供试品溶液,按“2.1.3”项下色谱条件进行测定,记录指纹图谱,以4 号峰(绿原酸)的保留时间和色谱峰面积为参照,计算各共有色谱峰的相对保留时间和相对峰面积。各共有峰的相对保留时间及相对峰面积的RSD 值均小于2.0%,结果表明重复性良好。
2.1.6 稳定性试验 取精密度试验项下同一供试品溶液Q1,按照“2.1.3”项下色谱条件,分别在0、2、4、6、8、12、24 h 测定,记录指纹图谱,以4 号峰(绿原酸)的保留时间和色谱峰面积为参照,计算各共有峰的相对保留时间和相对峰面积。各共有的相对保留时间及相对峰面积的RSD 值均小于3.0%,表明供试品溶液在24 h 内稳定。
2.1.7 曲花紫堇指纹图谱的建立 取10 批曲花紫堇粉末,分别精密称定,按“2.1.2”项下方法制备供试品溶液,精密吸取10 μL,分别进样测定,记录85 min 的HPLC 色谱图,将检测波长为289 nm 处的色谱图转换成AIA 格式,导入《中药色谱指纹图谱相似度评价系统》(2012.130723 版本,以下简称“指纹图谱软件”),将Q1 号样品的图谱设为参照图谱,采用中位数法,时间窗宽度设为0.5 min,进行多点校正和色谱峰全谱峰匹配,最终确定了18 个共有峰,得到指纹图谱叠加图,并生成对照指纹图谱,见图1。
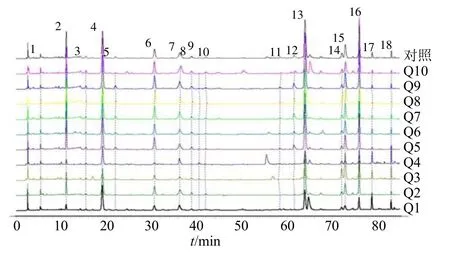
图1 曲花紫堇样品和对照HPLC 指纹图谱Fig.1 HPLC fingerprint of C.curviflora
2.1.8 特征峰的标定 根据10 批曲花紫堇的指纹图谱检测结果,共标定18 个特征峰。结合前期高分辨质谱对曲花紫堇中化学成分的初步分析结果,再与对照品色谱峰的保留时间、紫外吸收光谱信息比对,共指认10 个峰,2 号峰为新绿原酸,4 号峰为绿原酸,9 号峰为原阿片碱,11 号峰为紫堇灵,12号峰为乙酰紫堇灵,13 号峰为芦丁,14 号峰为紫云英苷,15 峰为烟花苷,17 号峰为槲皮素,18 号峰为山柰酚,对照指纹图谱及混合对照品溶液的HPLC 图见图2。
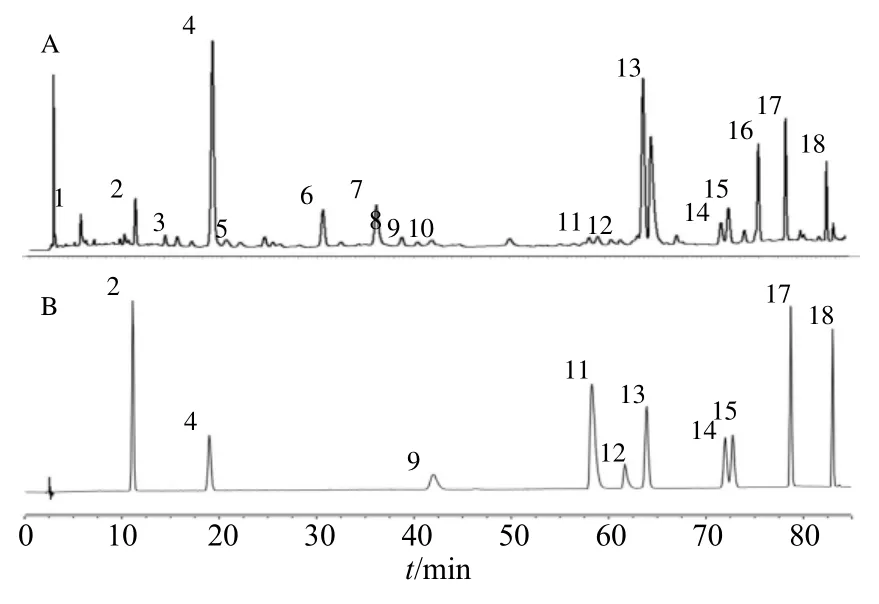
图2 曲花紫堇对照指纹图谱 (A) 和混合对照品HPLC图 (B)Fig.2 HPLC reference fingerprint of C.curviflora (A) and HPLC chromatogram of mixed reference substances (B)

图3 曲花紫堇对照指纹图谱和14 种紫堇的色谱图比较Fig.3 Comparison of similarity between control fingerprint of C.curviflora and fourteen species
2.2 相似度分析
2.2.1 曲花紫堇相似度分析 10 批曲花紫堇药材与对照指纹图谱进行相似度比较分析,结果见表2,不同批次曲花紫堇药材与对照指纹图谱比较相似度均>0.850,相似度良好,表明不同批次药材的化学成分差异性较小,质量相对稳定。
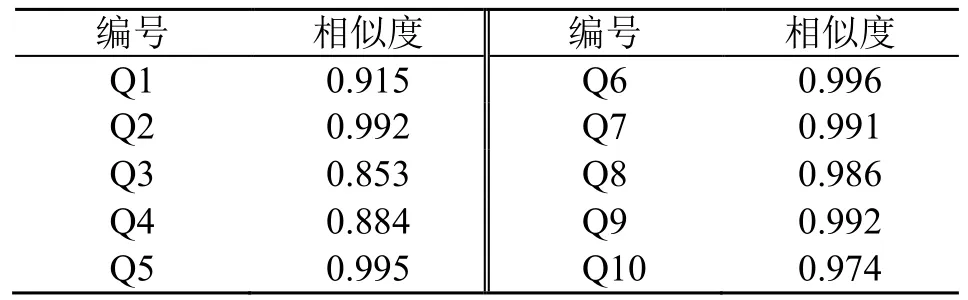
表2 曲花紫堇指纹图谱相似度Table 2 Comparison of reference fingerprint of C.curviflora
2.2.2 曲花紫堇及同属其他药材指纹图谱相似度分析 取表1 中除曲花紫堇其他14 种紫堇属药材样品50 批,按“2.1.2”项下方法处理后进样,与曲花紫堇对照指纹图谱进行相似度比较分析,结果见图3、表3,曲花紫堇与其他14 种紫堇属药材有2 个共有峰,相似度在0.078~0.686;取15 种紫堇样品共60 批,进行指纹图谱相似度交叉比较,结果显示相似度在0.021~0.849,说明各种之间化学成分差异较大。以上表明该指纹图谱方法可以反映不同基原紫堇化学成分的差异,对紫堇属15 种药材进行初步鉴别。

表3 曲花紫堇对照指纹图谱和14 种紫堇相似度比较Table 3 Comparison of similarity of fingerprints of C.curviflora and fourteen species
因暗绿紫堇与曲花紫堇原植物形态及药材性状上极其相似,仅凭外观评价往往难以鉴别、极易混淆,故选取暗绿紫堇进行进一步指纹图谱相似度比较分析和化学模式识别研究,结果见图4、表3,曲花紫堇对照指纹图谱与8 批暗绿紫堇有14 个共有峰,相似度在0.335~0.481。

图4 曲花紫堇对照指纹图谱和暗绿紫堇的色谱图比较Fig.4 Comparison of similarity between control fingerprint of C.curviflora and C.melanochlora
2.3 化学模式识别
因暗绿紫堇与曲花紫堇原植物形态及药材性状极其相似,且难以鉴别、极易混淆,故选取暗绿紫堇进行进一步化学模式识别研究。
2.3.1 聚类分析(clustering analysis,CA) 以18批样品(表1 中10 批曲花紫堇和8 批暗绿紫堇)的14 个指纹图谱共有峰峰面积为变量,导入SPSS 26.0软件,采用Ward 聚类方法,平方欧式距离作为度量标准,Z得分进行数据标准化,得到聚类分析树状图,见图5。当分类距离为25 时,可分为2 类,曲花紫堇聚为一类(Q1~Q10),暗绿紫堇聚为一类(A1~A8)。

图5 曲花紫堇及暗绿紫堇聚类分析树状图Fig.5 Cluster analysis dendrogram of C.curviflora and C.melanochlora
2.3.2 主成分分析(principal component analysis,PCA) 主成分分析是在尽可能保持原有数据信息的前提下,通过降维处理达到简化指标的计量学方法[15]。将18 批样品的14 个共有峰峰面积导入SPSS 26.0 软件,进行主成分分析,结果见表4。由表4 可知,提取特征值大于1 的4 个成分,其方差的累积贡献率为89.77%,表明这4 个成分能够代表14 个指标在这批样品中大部分的信息,该结果与PCA 分析结果相同。
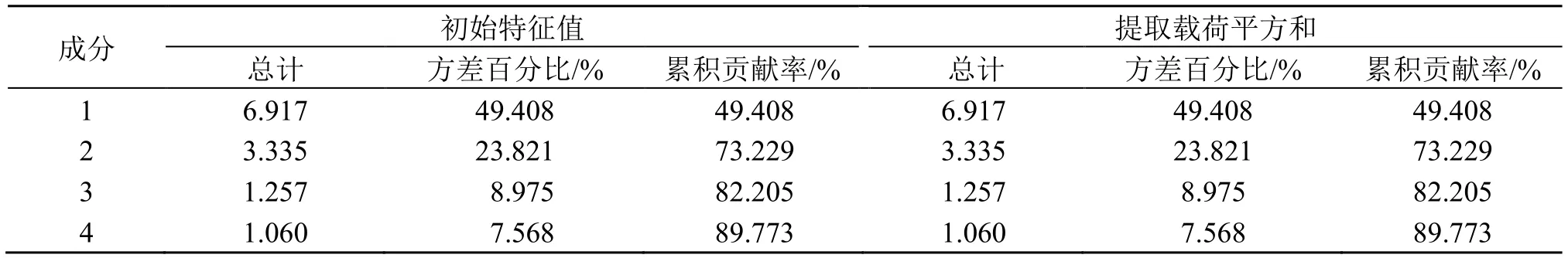
表4 特征根、各主成分的贡献率Table 4 Contribution rate of characteristic roots and principal components
同时将18 批样品指纹图谱的14 个共有色谱峰的峰面积导入SIMCA 14.1 软件,采用非监督识别方法进行主成分分析,观察样品的自然聚集,建立PCA 模型,采用自标度化法(UV)进行缩放[16],提取4 个主成分,得到模型解释率参数R2X为0.89,预测能力参数Q2为0.429,表明提取的主成分可解释89.0%的原始变量,模型的预测能力为49.2%。18 批样品的PCA 得分图见图6,结果显示样品可分为2 类,一类为曲花紫堇,另一类为暗绿紫堇,与相似度评价和聚类分析结果相一致,说明2 种紫堇的化学成分有一定差异。
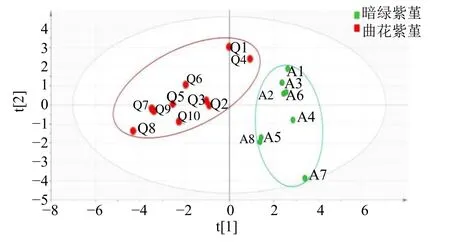
图6 18 批紫堇样品PCA 得分图Fig.6 PCA score chart of 18 batches of Corydalis
2.3.3 正交偏最小二乘法-判别式分析(partial least squares discrimination analysis,OPLS-DA) OPLSDA 是一种有监督的判别分析统计方法。将18 批紫堇的14 个共有峰峰面积导入SIMCA14.1 软件,建立有监督模式识别法OPLS-DA 模型进行分析,获得相应模型。其中R2X和R2Y分别为0.863 和0.964,模型预测能力参数Q2为0.823,表示所建模型对X和Y 矩阵的解释率分别为86.3%和96.4%,模型预测能力为82.3%,说明该模型稳定、可靠。从OPLSDA 得分矩阵图(图7)可看出,2 组样品聚类良好,分离显著,与PCA 结果相比,2 组样品进一步聚集。运用统计推断分析进一步验证鉴别模型,图8 为OPLS-DA 模型置换验证图,图中Q2为累积交叉有效性,Q2值越大表示模型预测能力越好;R2为累积方差值,表示原始数据被用于建立新的OPLS-DA判别模型的解释率,R2值越大模型解释能力越强[15]。置换检验参数R2和Q2的截距值分别为0.412 和−1.18,位于右边的OPLS-DA 模型原始R2和Q2值均大于其左边随机排列后的R2和Q2,说明建立的OPLS-DA 模型没有出现过拟合现象,具有较好的预测能力。
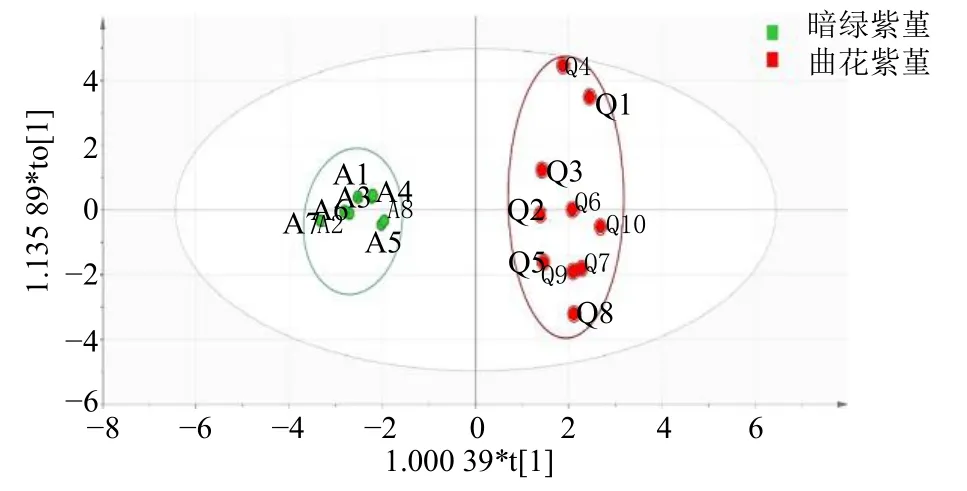
图7 18 批紫堇样品OPLS-DA 得分图Fig.7 OPLS-DA score plots of 18 batches of Corydalis

图8 18 批紫堇样品OPLS-DA 模型的置换验证Fig.8 OPLS-DA permutation test of 18 batches of Corydalis
变量重要性投影值(variable importance in projection scores,VIP)是筛选差异性化合物的重要指标,VIP 值越高,对组间差异的影响越大[15]。结合VIP 法,以变量VIP 值>1.0 为显著影响,共找到两种基原药材的6 个差异性标志物,结果见图9,分别为峰7、峰3(绿原酸)、峰8(芦丁)、峰5、峰2(新绿原酸)以及峰1,根据VIP 值大小进行排序,为峰7>绿原酸>芦丁>峰5>新绿原酸>峰1,这些峰是引起曲花紫堇和暗绿紫堇之间差异的主要变量,其余峰VIP 值小于1,对区分样品影响较小。

图9 18 批紫堇样品14 个共有峰的VIP 值Fig.9 VIP values of 14 common peaks of 18 batches of Corydalis
3 讨论
本研究建立了曲花紫堇HPLC 指纹图谱方法,并对紫堇属药材进行对比研究,同时结合化学计量学方法实现对暗绿紫堇的准确区分及反映差异标志物,能够有效地鉴别曲花紫堇及同属药材,为紫堇属药材质量评价提供方法及科学依据。
3.1 供试品溶液制备方法考察和色谱条件优化
本实验考察冷浸、超声、回流3 种提取方法,结果表明超声提取效率最高。同时对提取溶剂(甲醇、70%甲醇、甲醇、盐酸-70%甲醇(1∶100)、乙醇),提取时间(15、30、60 min)进行考察,发现以70%甲醇为提取溶剂,超声处理30 min 提取效果佳;考察了不同色谱柱,确定以Agilent ZORBAX Extend C18(250 mm×4.6 mm,5 μm)所得到的色谱图峰形最好,峰数多。检测波长经DAD 全波长图谱对比,同时考虑基线,发现289 nm 下色谱峰信息全面,基线平稳,因此选择检测波长为289 nm。对流动相(甲醇-水、甲醇-0.1%甲酸水、甲醇-0.2%磷酸水、乙腈-水、乙腈-0.1%甲酸水),体积流量(0.8、1.0、1.2 mL/min)、柱温(25、30、35 ℃)进行考察,以流动相为甲醇-0.2%磷酸水溶液,体积流量1.0 mL/min,柱温30 ℃为佳。
3.2 曲花紫堇及同属药材指纹图谱分析
质量控制研究一直是中药研究与发展的关键[17]。指纹图谱能比较全面地反映出中药所含的化学成分种类和数量,体现药材的整体质量和临床的整体疗效[13]。目前对于紫堇属藏药的鉴别研究较少,多种混用品的区分不够全面,同等入药使用影响该属藏药的临床规范使用。以《四川省藏药材标准》2020版收载的曲花紫堇药材为主建立指纹图谱,可为紫堇属药材的基原鉴定和质量控制提供参考和依据。因此本研究首次建立了曲花紫堇药材HPLC 对照指纹图谱,标定18 个共有峰,识别了其中10 种成分,能全面反映药材的内在质量;曲花紫堇对照指纹图谱与紫堇属其他药材相似度在0.078~0.686,说明该指纹图谱方法可以显示出不同紫堇的化学成分差异,可以有效区分曲花紫堇和同属其他混淆药材;对紫堇属15 种药材的指纹图谱进行相似度交叉比较,相似度在0.021~0.849,表明上述药材化学成分存在较大差异,是否可以同等入药使用,有待后续药效进一步研究。所建立的指纹图谱方法适用于区别紫堇属大部分药材,可为紫堇属药材提供有效可行的指纹图谱鉴别方法。
3.3 曲花紫堇及暗绿紫堇的模式识别分析
曲花紫堇和暗绿紫堇药材及易混淆,鉴别研究较少,缺乏指纹图谱和化学计量学层面的区分鉴别,且尚未提出差异标志物。因此本实验基于HPLC 指纹图谱和化学模式识别对两者进行区分研究,实验数据表明,曲花紫堇与暗绿紫堇的指纹图谱中具有14 个共有峰,含有的化学成分种类大体基本一致。但相似度计算结果却有明显差异,说明2 种药材在化学成分上还是存在一定的差异。为进一步区分2 种基原,寻找差异性成分,使用化学模式识别研究,对曲花紫堇和暗绿紫堇的指纹图谱进行聚类分析和主成分分析,结果发现2 种紫堇化学成分存在差异,模式识别分析可很好的区分2 个种。并利用所建立的OPLS-DA 模型分析,找到了6 个差异性成分,其中绿原酸、芦丁、新绿原酸3 个成分经对照品比对确认,说明药材中含有的黄酮类和酚酸类成分具有差异,能够作为区分2种药材的依据,为后期质量标志物的确定提供研究思路。实验结果证明该方法准确可靠,专属性强,为2种药材的区分和质量控制提供分析方法和参考依据。
目前只收集到8 批暗绿紫堇,该种的指纹图谱样本量不足。6 个差异性标志物,目前只指认出绿原酸、芦丁、新绿原酸,另外3 个差异性标志物所代表的化学成分及其药理活性有待后续进一步研究。
本研究采用HPLC 指纹图谱结合相似度评价以及化学计量学识别方法对紫堇属不同药材综合分析,可对曲花紫堇及紫堇属其他易混淆药材进行有效区分,为紫堇属不同药材的质量控制和品质评价提供依据和参考。
利益冲突所有作者均声明不存在利益冲突