ε-聚赖氨酸盐酸盐对扩展青霉生长和产毒的影响
姜辣,陈海燕,张婧,崔亚敏,孟祥红
(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
ε-聚赖氨酸盐酸盐对扩展青霉生长和产毒的影响
姜辣,陈海燕,张婧,崔亚敏,孟祥红*
(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
摘要通过固体和液体两种培养方式,探究了ε-聚赖氨酸盐酸盐对扩展青霉菌体生长和展青霉素产生的影响。结果表明,固体培养方式下,ε-聚赖氨酸盐酸盐可以显著地抑制扩展青霉孢子萌发和菌体生长,且具有浓度依赖性。液体培养方式下,不同浓度的ε-聚赖氨酸盐酸盐对扩展青霉菌体生长的影响不同,但是均明显地抑制毒素的产生。其中1.2 mg/mL ε-聚赖氨酸盐酸盐在一定时间内可以显著地抑制扩展青霉菌体生长和产毒,但在培养后期抑制作用减弱,并促进了产毒。
关键词ε-聚赖氨酸盐酸盐;扩展青霉;产毒;生长
扩展青霉(Penicilliumexpansum)是果蔬采后的主要病原菌之一,广泛存在于苹果、梨、葡萄、柑橘和桃等水果中[1-2],它不仅会导致水果的腐烂,而且还会产生一种次级代谢产物——展青霉素(Patulin)。展青霉素具有潜在的细胞和动物毒性,存在致畸性、致癌性和免疫毒性[3],严重危害人体健康,世界上许多国家已经对水果及其加工制品中的展青霉素含量做出了严格的限定[4]。
化学杀菌剂是控制采后病害的主要方法,但杀菌剂的化学残留对人类健康及环境的影响已引起关注,同时由于病原菌变异和耐药性的产生,使得化学杀菌剂的应用越来越受到限制。因此,寻求安全、高效的抑菌物质来代替化学杀菌剂用于控制采后病害一直是国内外的研究热点[5]。目前,已有将壳聚糖和植物精油用于控制采后病害的报道[6-7],但壳聚糖不溶于水,黏度高,其抑菌效果受分子量大小和脱乙酰度的影响,而植物精油易挥发,不容易控制,有些植物精油还具有强烈的刺激性气味,应用领域受到限制。ε-聚赖氨酸作为一种食品添加剂,具有来源广泛、水溶性好、热稳定性和安全性高[8-10]等优点。有研究表明,ε-聚赖氨酸具有良好的抑菌效果,刘蔚等[11]以大肠杆菌、枯草芽孢杆菌、青霉为研究对象,确定了ε-聚赖氨酸对3种菌的最小抑菌质量浓度分别为25、25和400 mg/L。YE等[12]研究发现,ε-聚赖氨酸对大肠杆菌(E. coliO157:H7)具有明显的抑菌效果,ε-聚赖氨酸能够破坏细胞膜结构;诱导活性氧的产生,激活细胞中氧胁迫基因的表达;并能激活细胞的DNA损伤修复应答(SOS应答)机制,对菌体DNA造成一定程度的损伤。之前有关ε-聚赖氨酸抑菌作用的研究主要集中在对细菌生长的抑制作用和机理方面的探究,但ε-聚赖氨酸对真菌生长方面的研究、尤其是对扩展青霉菌体生长和产毒的影响却鲜有报道。
本文通过固体和液体2种培养方式,探究了ε-聚赖氨酸盐酸盐对扩展青霉孢子萌发、菌体生长和展青霉素产生的影响,以期为ε-聚赖氨酸盐酸盐在采后病害控制中的应用提供依据。
1材料与方法
1.1材料与试剂
ε-聚赖氨酸盐酸盐, 浙江新银象生物工程有限公司;乙腈(色谱纯), 德国Merck公司;冰乙酸(色谱纯),天津市科密欧化学试剂有限公司;展青霉素标准品(纯度98%), 美国Sigma公司;超纯水,美国Millipore超纯水系统;其他试剂均为分析纯。扩展青霉(Penicillium expansun)由实验室从感染青霉病的发病苹果果实中分离纯化,回接验证所得(经鉴定编号为M1),于4 ℃ PDA斜面培养基中保存。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L,自然pH。
PDB培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 L,自然pH。
1.2仪器与设备
BMJ-250C霉菌培养箱,上海博讯实业有限公司医疗设备厂;BK5000-LEDR光学显微镜,重庆奥特光学仪器有限责任公司;Agilent-1260高效液相色谱仪,美国安捷伦科技有限公司;IS-RDS3恒温振荡器,美国精骐有限公司;RE-52A旋转蒸发仪,上海荣生化学仪器厂;YGC-12氮吹仪,郑州宝晶电子科技有限公司。
1.3试验方法
1.3.1扩展青霉孢子悬浮液及其菌饼的制备
将扩展青霉接种到PDA斜面上,25 ℃下培养7d后,加入无菌生理盐水,将菌落表面的孢子刮下,用灭菌的4层纱布过滤除去菌丝等杂质,用血球计数板计数,将孢子浓度调整至106CFU/mL。
取一定体积的孢子悬浮液制备成含孢子浓度为105CFU/mL的PDA培养基,混匀后以每皿10 mL添加量倒入直径为90 mm的无菌培养皿中制成平板。用无菌打孔器在含菌培养基上打孔得到直径为9 mm的圆形菌饼。本实验均在经紫外线杀菌的无菌操作台内进行。
1.3.2孢子萌发试验
制备ε-聚赖氨酸盐酸盐质量浓度分别为0、0.1、0.2、0.3、0.4 mg/mL的PDA培养基,调节pH为5.6。混匀后以每皿10 mL添加量倒入直径为90 mm的无菌培养皿中,待培养基凝固后,均匀涂布100 μL扩展青霉孢子悬浮液。将培养皿置于25 ℃,相对湿度90%的霉菌培养箱中培养9.5 h后,在显微镜下观察,以孢子芽管超过孢子直径视为萌发[13],并计算孢子萌发率。每个处理设3个平行,每个平行样中至少统计200个孢子。
1.3.3固体培养条件下抑菌试验
制备ε-聚赖氨酸盐酸盐质量浓度分别为0、0.4、0.8、1.2、1.6、2.0、4.0、6.0、8.0、10.0、20.0 mg/mL的PDA培养基,调节pH 为5.6。混匀后以每皿15 mL添加量倒入直径为90 mm的无菌培养皿中,待培养基凝固后,取含有扩展青霉孢子悬液的菌饼置于培养皿中央。将培养皿置于25 ℃,相对湿度90%的霉菌培养箱中培养。培养7 d后,直至对照组的菌落直径生长至培养皿直径1/2~2/3时[14],用十字交叉法测量各处理组的菌落直径,计算抑制率:

每组实验设3个平行。
1.3.4液体培养条件下菌体生长和产毒试验
1.3.4.1扩展青霉生长量的测定
制备ε-聚赖氨酸盐酸盐质量浓度为0、0.4、0.8、1.2、1.6、2.0、4.0 mg/mL的PDB培养基,调节pH为5.6。混匀后以每瓶40 mL添加量置于250 mL无菌锥形瓶中,接入0.4 mL 1×106CFU/mL 的扩展青霉孢子悬浮液,用透气的封瓶膜封口。将锥形瓶置于25 ℃,相对湿度90%的霉菌培养箱中静置培养 7d。其中将质量浓度为0和1.2 mg/mL的处理组分别培养5,7,9,11,13 d。培养结束后抽滤收集菌体,于60 ℃下烘干至恒重,称重,每组实验设3个平行。
1.3.4.2展青霉素的测定
展青霉素测定采用高效液相色谱法,参考测定方法[15]。量取10 mL抽滤所得滤液,用于提取测量展青霉素,向待测样品中加入15 mL乙酸乙酯振荡提取1 h,静置分层后,收集上层的乙酸乙酯相。重复2次,合并有机相,加入10 mL Na2CO3溶液(15 mg/mL),振荡1 min,静置分层后,再用10 mL的乙酸乙酯对Na2CO3层提取1次,合并乙酸乙酯提取液,于40 ℃水浴上旋转蒸发至液体剩余1~2 mL,将浓缩液转移至5 mL离心管中,于40 ℃下氮气吹干,用1.0 mL乙酸水溶液(pH=4.0)溶解残留物,经0.45 μm滤膜过滤后,用HPLC进行测定。色谱柱:Agilent SB-C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(10∶90,体积比);流速1.0 mL/min;柱温30 ℃;检测波长276 nm;进样量20 μL。
1.3.4.3pH和还原糖的测定
将滤除菌体的滤液用于以下指标的测定:pH值采用酸度计测定;还原糖采用DNS比色法测定[16]。
1.4统计分析
所有数据采用SPSS(Version 20.0, Inc., Chicago, IL, USA)软件进行统计。实验数据通过ANOVA进行邓肯多重比较。当P< 0.05时,即表示差异显著。
2结果与讨论
2.1ε-聚赖氨酸盐酸盐质量浓度对扩展青霉孢子萌发的影响
如图1所示,培养9.5 h后,对照组的孢子萌发率达到87.3 %± 1.0%,而0.4 mg/mL ε-聚赖氨酸盐酸盐组孢子萌发率为(5.4±1.0)%。扩展青霉孢子培养9.5 h后,用显微镜观察,对照组孢子几乎全部萌发,而0.4 mg/mL ε-聚赖氨酸盐酸盐组孢子基本没有萌发,多数孢子还没有完成萌发所必须的体积膨大过程(图2)。说明ε-聚赖氨酸盐酸盐对扩展青霉孢子萌发具有明显的抑制作用,其抑制作用强弱依赖于浓度的变化。这与β-氨基丁酸(BABA)对扩展青霉孢子萌发的研究结果[17]是一致的。
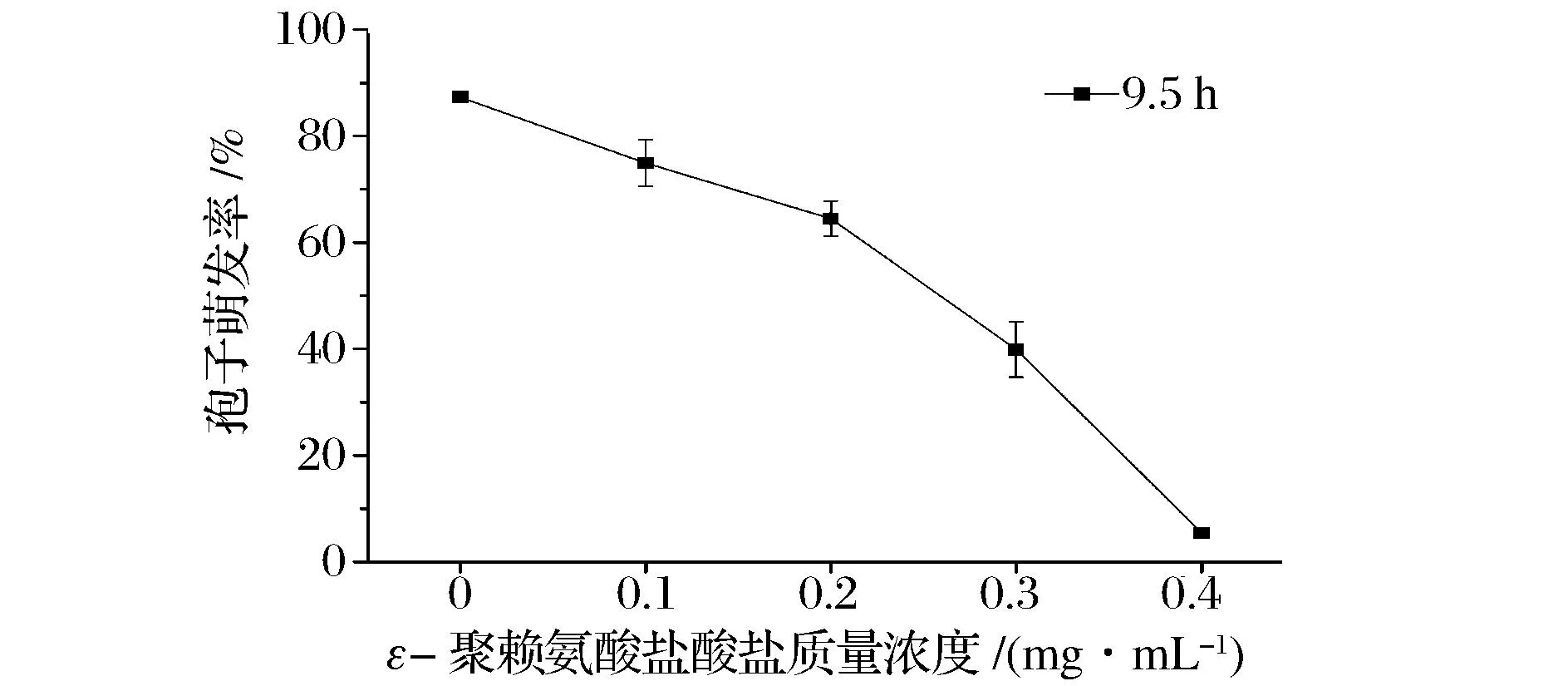
图1 ε-聚赖氨酸盐酸盐质量浓度对扩展青霉孢子萌发的影响Fig.1 Effect of ε-poly-L-lysine·HCl with different concentrations on spore germination of P. expansum
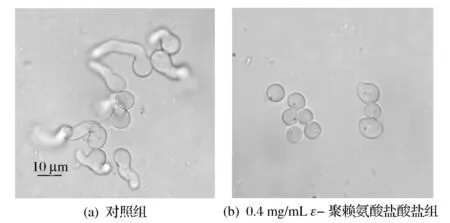
图2 ε-聚赖氨酸盐酸盐对扩展青霉孢子形态的影响Fig.2 Effect of ε-poly-L-lysine·HCl on spore morphology of P. expansum
2.2固体培养方式下ε-聚赖氨酸盐酸盐质量浓度对扩展青霉菌体生长的影响
如图3a所示,培养至第7天时,对照组的菌饼直径达到(50.7±0.1) mm。0.4 mg/mL ε-聚赖氨酸盐酸盐对扩展青霉菌体生长的抑制率为21.9%±0.1%,随着浓度的升高,ε-聚赖氨酸盐酸盐对菌体生长的抑制作用逐渐增强,当浓度达到20 mg/mL时,抑制率为(68.6±3.6)%(图3b)。说明固体培养方式下,ε-聚赖氨酸盐酸盐对扩展青霉菌体生长的抑制具有浓度依赖性。
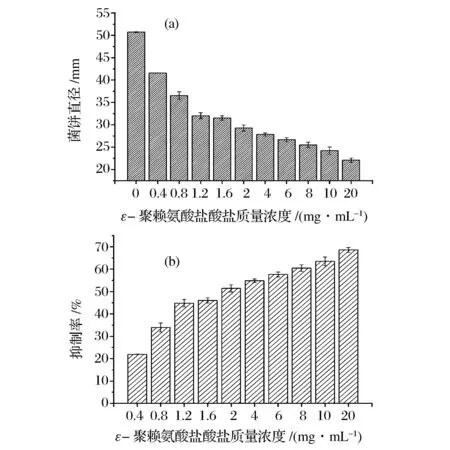
图3 固体培养方式下ε-聚赖氨酸盐酸盐质量浓度对扩展青霉菌体生长的影响Fig.3 Effect of ε-poly-L-lysine·HCl with different concentrations on the mycelial growth of P. expansum in solid medium
2.3液体培养方式下ε-聚赖氨酸盐酸盐质量浓度对扩展青霉菌体生长和产毒的影响
考虑到菌体生长和产毒过程中会引起培养环境发生变化,因此,采用液体培养的方式来探究ε-聚赖氨酸盐酸盐对扩展青霉菌体生长和产毒的影响。由表1可以看出,液体培养方式下,相同培养时间(7 d)内,ε-聚赖氨酸盐酸盐对扩展青霉菌体生长的抑制作用并不呈现浓度依赖性。在ε-聚赖氨酸盐酸盐浓度为1.2 mg/mL时,对菌体生长的抑制效果最好。但随着ε-聚赖氨酸盐酸盐浓度的升高,抑制作用逐渐减弱。当质量浓度达到2.0 mg/mL以上时,扩展青霉菌体生长量与对照组相当。分析可能的原因是液体培养方式下,ε-聚赖氨酸盐酸盐分子中大量带正电荷的基团与菌体表面的吸附作用,使菌体生长量增加,刘胜荣[18]的研究也发现,生理条件下,ε-聚赖氨酸可以大量的吸附至产生菌细胞。也可能是液体培养方式下,高浓度的ε-聚赖氨酸盐酸盐促进了菌体的生长,使菌体生长量增加。张昕等[19]的研究表明还原糖的降低与菌体生长量的上升具有一致性,这与本研究中高浓度处理组菌体对还原糖的消耗要高于1.2 mg/mL处理组的结果具有一致性。
表1液体培养方式下ε-聚赖氨酸盐酸盐质量浓度对扩展青霉菌体生长量、毒素含量及相关指标的影响
Table1Effect of ε-poly-L-lysine·HCl with different concentrations on the mycelial growth ofP.expansum, the production of patulin and the related indicators in liquid medium
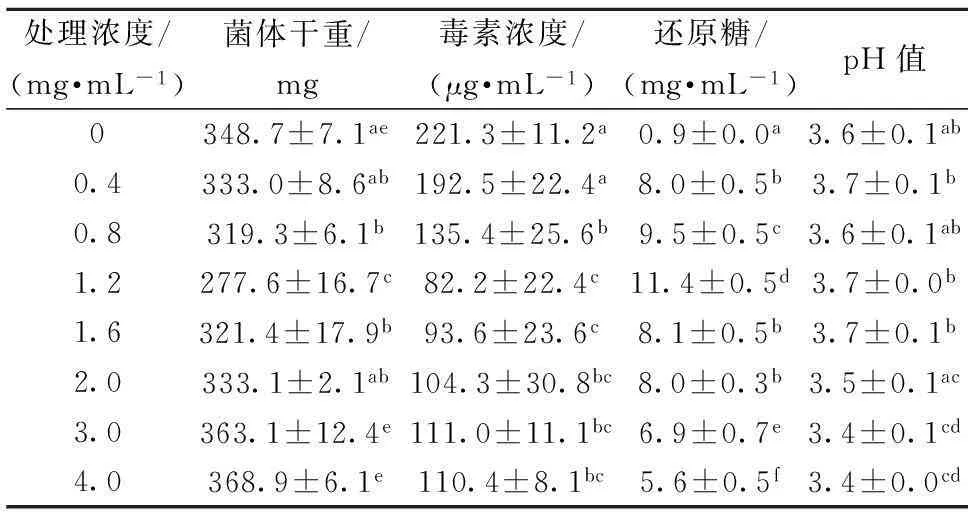
处理浓度/(mg·mL-1)菌体干重/mg毒素浓度/(μg·mL-1)还原糖/(mg·mL-1)pH值00.40.81.21.62.03.04.0348.7±7.1ae333.0±8.6ab319.3±6.1b277.6±16.7c321.4±17.9b333.1±2.1ab363.1±12.4e368.9±6.1e221.3±11.2a192.5±22.4a135.4±25.6b82.2±22.4c93.6±23.6c104.3±30.8bc111.0±11.1bc110.4±8.1bc0.9±0.0a8.0±0.5b9.5±0.5c11.4±0.5d8.1±0.5b8.0±0.3b6.9±0.7e5.6±0.5f3.6±0.1ab3.7±0.1b3.6±0.1ab3.7±0.0b3.7±0.1b3.5±0.1ac3.4±0.1cd3.4±0.0cd
注:不同小写字母代表同种指标不同浓度处理间差异显著(P<0.05)
相同培养时间内,与对照组相比,ε-聚赖氨酸盐酸盐能够明显地抑制产毒,随着ε-聚赖氨酸盐酸盐浓度的升高,产毒呈现先降低后保持平缓的变化趋势。其中对菌体生长抑制效果最明显的1.2 mg/mL ε-聚赖氨酸盐酸盐组,其产毒受到强烈抑制。可能是该浓度的ε-聚赖氨酸盐酸盐强烈的抑制了菌体生长而阻止了菌体产生次级代谢产物,因而降低了产毒[20]。而高浓度处理组虽然对菌体生长量无显著影响但却明显地降低了产毒。关于抑菌剂对菌体生长和产毒不一致的情况在其他的研究中也有报道。例如,MOSSINI等[21]研究发现,含有槲皮素和其他酚类物质的苦楝树叶提取物不抑制扩展青霉菌体生长,但是却能够抑制展青霉素的产生,这与本研究结果一致。但关于其产毒的机制有待进一步研究。
相同培养时间内,各处理组还原糖均明显降低。但是与对照组相比,ε-聚赖氨酸盐酸盐组均显著降低了对还原糖的消耗。其中菌体生长量最小的1.2 mg/mL ε-聚赖氨酸盐酸盐组其还原糖的消耗最少。说明菌体生长和产毒的过程中需要消耗还原糖。相同培养时间内,各处理组的pH均明显降低。说明在扩展青霉菌体生长和产毒的过程中会产酸。PRUSKY等[22]的研究发现,扩展青霉生长过程中会分泌有机酸,如葡萄糖酸,而展青霉素也在酸性条件下产生。NERI等[23]研究也发现,展青霉素产生比较弱的扩展青霉菌株并不能酸化基质。这与本研究结果一致。
2.4液体培养方式下ε-聚赖氨酸盐酸盐对扩展青霉菌体生长和产毒随时间变化的影响
相同培养时间内,1.2 mg/mL ε-聚赖氨酸盐酸盐对扩展青霉菌体生长和产毒的抑制效果最明显,因此选择该质量浓度来探究其对扩展青霉菌体生长和产毒随时间变化的影响。由图4a可以看出,对照组从培养第5~13天,菌体生长量变化不明显。而ε-聚赖氨酸盐酸盐组,从培养第5~9天菌体生长量一直增加,但低于对照组。从第11天开始,菌体生长量与对照组相当,变化不明显。说明ε-聚赖氨酸盐酸盐在一定时间内抑制了扩展青霉菌体生长。
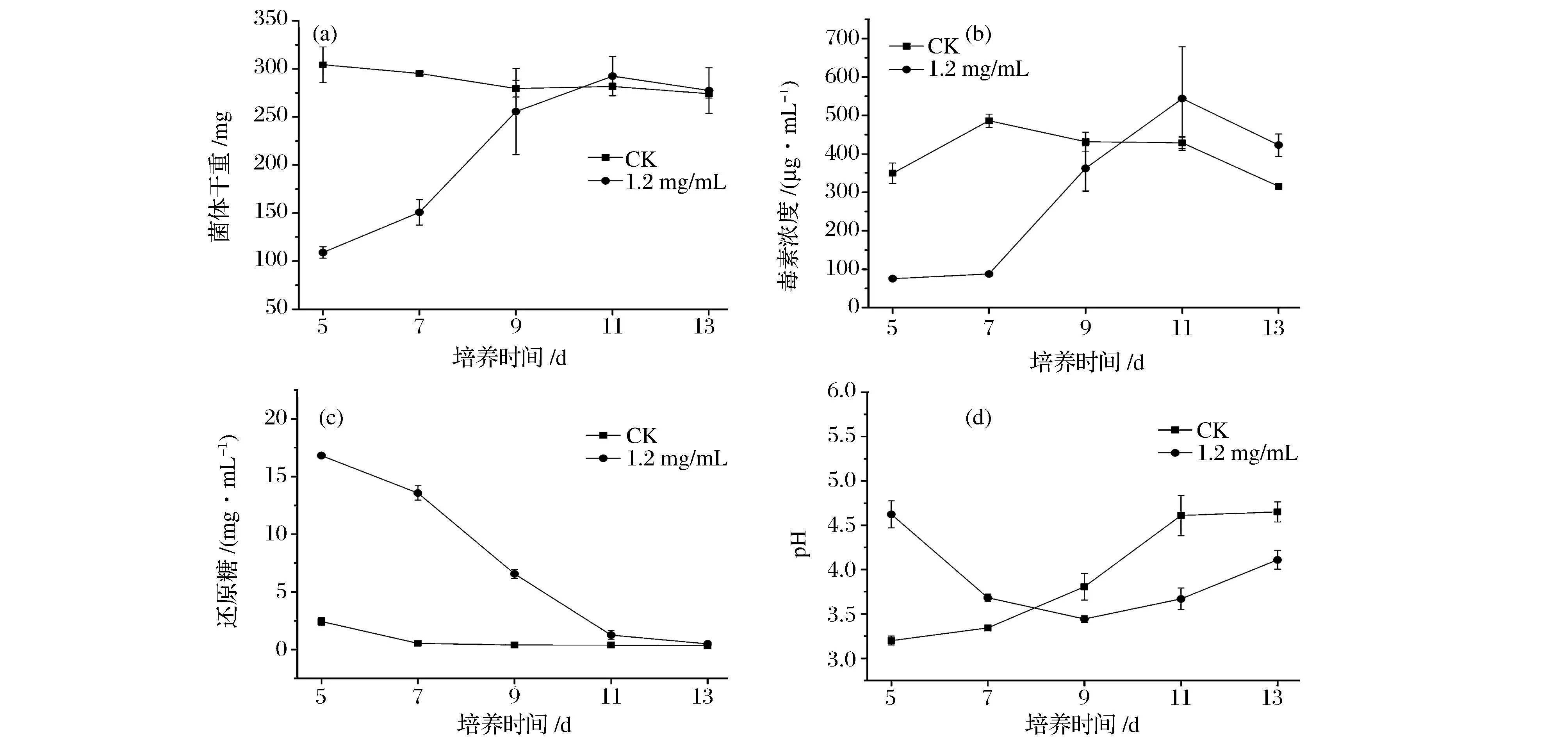
图4 液体培养方式下ε-聚赖氨酸盐酸盐对扩展青霉菌体生长量、毒素含量及相关指标随时间变化的影响Fig.4 Effect of ε-poly-L-lysine·HCl with different time on the mycelial growth of P. expansum, the production of patulin and the related indicators in liquid medium
由图4b可以看出,在培养过程中,对照组与ε-聚赖氨酸盐酸盐组产毒均呈现先上升后降低的变化趋势。对照组在培养的第7天达到产毒高峰,而ε-聚赖氨酸盐酸盐组在培养的第5~9天产毒一直在增加,但一直低于对照组,当培养至第11天时,ε-聚赖氨酸盐酸盐组产毒达到高峰,并高于对照组。说明ε-聚赖氨酸盐酸盐在一定时间内抑制了产毒。而在培养过程中ε-聚赖氨酸盐酸盐组出现了产毒高于对照组的情况,可能是因为ε-聚赖氨酸盐酸盐提供了一个菌体生长的“逆境”环境,使病原真菌更倾向于向次级代谢产物的方向合成[24]。展青霉素是扩展青霉的次级代谢产物,培养前期ε-聚赖氨酸盐酸盐强烈的抑制菌体生长,而抑制产毒,但随着培养时间的增加,这种“逆境”下的菌体不断生长,因而促进了扩展青霉产生更多的次级代谢产物,使产毒增加。在培养过程中,对照组与ε-聚赖氨酸盐酸盐组产毒分别从培养的第7和11天开始降低。
如图4c所示,对照组与ε-聚赖氨酸盐酸盐组在培养过程中还原糖都随着时间的增加而逐渐降低,分别在培养的第7,11天达到最低值,随后两组还原糖变化不明显。而pH均呈现先下降后上升的变化趋势,对照组与ε-聚赖氨酸盐酸盐组分别在培养的第5,9天达到最低值,随后开始上升 (图4d)。这说明菌体生长和产毒的过程中需要不断地消耗还原糖,并产酸。而培养后期各处理组还原糖达到最低值后变化不明显,以及pH值的升高,这可能与培养后期产毒降低有一定的关系。由于营养物质缺乏,展青霉素合成被终止,同时培养液的pH发生改变,会导致展青霉素不稳定,而发生降解。VARGA等[25]也认为,毒素可以被菌体自身降解,同时由于营养物质缺乏,真菌毒素的产生或积累可以被终止,这与本研究结果一致。
3结论
本研究通过固体和液体两种培养方式,探究了ε-聚赖氨酸盐酸盐对扩展青霉菌体生长和展青霉素产生的影响,结果表明:固体培养方式下,ε-聚赖氨酸盐酸盐能够显著地抑制扩展青霉孢子萌发和菌体生长,且具有浓度依赖性。液体培养方式下,ε-聚赖氨酸盐酸盐对扩展青霉菌体生长的抑制作用并不呈现浓度依赖性,当浓度达到2.0 mg/mL以上时,扩展青霉菌体生长量与对照组相当,因此要注意不同的培养方式对其发挥抑菌作用的影响,但是不同浓度的ε-聚赖氨酸盐酸盐均明显地抑制了产毒,关于其产毒的机制还有待深入研究;其中1.2 mg/mL ε-聚赖氨酸盐酸盐在一定时间内可以显著地抑制扩展青霉菌体生长和产毒,但在培养后期对菌体生长和产毒的抑制作用减弱,并促进了产毒。因此,对ε-聚赖氨酸盐酸盐进行抑菌性评价时,应该考虑培养方式对其抑菌作用的影响,同时更应重视其对产毒的影响。本文的研究结果可为ε-聚赖氨酸盐酸盐在采后病害控制中的应用提供依据。
参考文献
[1]CERIONI L,de losNGELES LAZARTE M,VILLEGAS J M,et al. Inhibition of Penicillium expansum by an oxidative treatment[J].Food Microbiology,2013,32(2):298-301.
[2]MOSS M O.Fungi,quality and safety issues in fresh fruits and vegetables[J].Journal of Applied Microbiology,2008,104(5):1 239-1 243.
[3]PUEL O,GALTIER P,OSWALD I P.Biosynthesis and toxicological effects of patulin[J].Toxins, 2010,2(4):613-631.
[4]CUNHA S C,FARIA M A,PEREIRA V L,et al. Patulin assessment and fungi identification in organic and conventional fruits and derived products[J].Food Control,2014,44:185-190.
[5]TAYLOR M.Handbook of natural antimicrobials for food safety and quality[M].UK:Woodhead Publishing,2014:287-313.
[6]ZHANG H Y,LI R P,LIU W M.Effects of chitin and its derivative chitosan on postharvest decay of fruits:a review[J].International Journal of Molecular Sciences,2011,12(2):917-934.
[7]SIVAKUMAR D,BAUTISTA-BANOS S.A review on the use of essential oils for postharvest decay control and maintenance of fruit quality during storage[J].Crop Protection,2014,64:27-37.
[8]REN X D,CHEN X S,ZENG X,et al. Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation byStreptomycessp.M-Z18 from agro-industrial by-products[J].Bioprocess and Biosystems Engineering,2015,38(6):1 113-1 125.
[9]赵娟,贾士儒,谭之磊,等.生物防腐剂ε-聚赖氨酸的稳定性[J].天津科技大学学报,2009,24(4):9-13.
[10]HIRAKI J,ICHIKAWA T,NINOMIYA S,et al. Use of ADME studies to confirm the safety of ε-polylysine as a preservative in food[J].Regulatory Toxicology and Pharmacology,2003,37(2):328-340.
[11]刘蔚,周涛. ε-聚赖氨酸抑菌机理研究[J].食品科学,2009,30(9):15-20.
[12]YE R S,XU H Y,WAN C X,et al. Antibacterial activity and mechanism of action of ε-poly-l-lysine[J].Biochemical and Biophysical Research Communications,2013,439(1):148-153.
[13]臧睿,黄丽丽.苹果树腐烂病菌分生孢子萌发及其影响条件研究[J].西北农业学报,2007,16(1):64-67.
[14]孙昊,张万萍,孟繁博,等.番茄采后灰霉病原对几种抑菌剂的敏感性研究[J].食品与机械,2014(1):165-168.
[15]MENG J,HUANG F F,WU R,et al. Determination of patulin in apple and hawthorn products by HPLC[J].Acta Agriculturae Shanghai,2009,25(1):27-31.
[16]徐玮,汪东风.食品化学实验和习题[M].北京:化学工业出版社,2008:14-16.
[17]ZHANG C F,WANG J M,ZHANG J M,et al. Effects of β-aminobutyric acid on control of postharvest blue mould of apple fruit and its possible mechanisms of action[J].Postharvest Biology and Technology,2011,61(2):145-151.
[18]刘盛荣.ε-聚赖氨酸生物合成及代谢调控研究[D].广州:华南理工大学,2012.
[19]张昕.扩展青霉分批培养中展青霉素的降解机制[D].杨凌:西北农林科技大学,2008.
[20]GARCIA D,RAMOS A J,SANCHIS V,et al. Predicting mycotoxins in foods:a review[J].Food Microbiology,2009,26(8):757-769.
[21]APARECIDA G M S,De OLIVEIRA K P,Kemmelmeier C.Inhibition of patulin production byPenicilliumexpansumcultured with neem (Azadirachtaindica) leaf extracts[J].Journal of Basic Microbiology,2004,44(2):106-113.
[22]PRUSKY D,MCEVOY J L,Saftner R,et al. Relationship between host acidification and virulence ofPenicilliumspp.on apple and citrus fruit[J].Phytopathology,2004,94(1):44-51.
[23]NERI F,DONATI I,VERONESI F,et al. Evaluation ofPenicilliumexpansumisolates for aggressiveness,growth and patulin accumulation in usual and less common fruit hosts[J].International Journal of Food Microbiology,2010,143(3):109-117.
[24]CALVO A M,WILSON R A,BOK J W,et al. Relationship between secondary metabolism and fungal development[J].Microbiology and Molecular Biology Reviews,2002,66(3):447-459.
[25]VARGA J,RIGó K,TEREN J.Degradation of ochratoxin A byAspergillusspecies[J].International Journal of Food Microbiology,2000,59(1):1-7.
Effects of ε-poly-L-lysine·HCl on growth ofPenicilliumexpansumand production of patulin
JIANG La,CHEN Hai-yan,ZHANG Jing,CUI Ya-min,MENG Xiang-hong*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
ABSTRACTEffects of ε-poly-L-lysine·HCl on the growth of Penicillium expansum and the production of patulin were investigated in solid and liquid medium. The results showed that ε-poly-L-lysine·HCl obviously inhibited spore germination and the growth of Penicillium expansum with increasing dose in solid medium. Treatment with different concentrations of ε-poly-L-lysine·HCl had different effects on the growth of Penicillium expansum. However, it could obviously reduce the production of patulin in liquid medium. Particularly, 1.2 mg/mL ε-poly-L-lysine·HCl significantly inhibited the growth of Penicillium expansum and the production of patulin within a certain time,but weakened inhibiting at the end of cultivation, even promoted the production of patulin. This study provides foundation for application of ε-poly-L-lysine·HCl in controlling of postharvest diseases.
Key wordsε-poly-L-lysine·HCl;Penicillium expansum;patulin;growth
收稿日期:2015-11-10,改回日期:2015-12-06
基金项目:国家科技计划课题(863计划)(2012AA101607); 国家自然科学基金(31171762)
DOI:10.13995/j.cnki.11-1802/ts.201604008
第一作者:硕士研究生(孟祥红教授为通讯作者,E-mail : mengxh@ouc.edu.cn)。
——以珠海市水库为例

