Circ-DDX5靶向miR-3940抑制人乳腺癌细胞系的增殖和侵袭
李江丽,孙 静,唐一君,郭君兰,陈 博,郭胜男
1.河南科技大学附属安阳市肿瘤医院 肿瘤内科,河南 安阳 455000;2.南方医科大学附属广东省人民医院 肿瘤科,广东 广州 519041
乳腺癌是一种起源于乳腺上皮细胞的恶性肿瘤,根治性手术是乳腺癌治疗最有效的治疗方式[1-2]。由于乳腺癌早期症状不显著、缺乏有效生物标志物和特异性治疗靶点等原因,多数乳腺癌患者的预后较差[3-4]。因此,探索乳腺癌发病机制以及寻找分子标志物和治疗靶点至关重要。环状RNA(circular RNA,circRNA)是一种呈闭合结构的RNA,由转录后的mRNA反向剪切而成[5]。CircRNA被证实广泛参与细胞的各种生理以及病理过程,在疾病的发生、进展过程中起到关键作用[6]。大量研究发现,胰腺癌、淋巴瘤、骨肉瘤、乳腺癌等恶性肿瘤中均存在circRNA的高表达或低表达[7-8]。CircRNA通过靶向结合微小RNA(microRNA,miRNA)调节肿瘤细胞的增殖、血行转移、化疗敏感性等,影响肿瘤的病理分期和患者预后[9]。HGNC数据库显示,circ-DDX5定位在人染色体17q23.3,其由第1、2、3号外显子反向剪切形成,其长度为203个核苷酸。Circ-DDX5在肿瘤特别是乳腺癌中的表达、功能及相关机制并不清楚。本研究旨在探索circ-DDX5在乳腺癌组织中表达水平及其与乳腺癌患者临床分期的相关性,分析circ-DDX5是否通过靶向miR-3940影响乳腺癌细胞系的增殖和侵袭,以期为乳腺癌的诊疗提供新的分子标志物和治疗靶点。
1 材料与方法
1.1 细胞和试剂
人乳腺癌细胞系SK-BR-3、MDA-MB-231、BT-549、MCF-7、HCC-1937和永生化乳腺上皮细胞系MCF-10A(中国科学院细胞资源中心)。Lipofectamine 3000、RPMI 1640培养基(Invitrogen公司);DMEM培养基和胎牛血清(FBS)(Roche公司);Transwell小室、CCK-8试剂盒(Corning公司);SYBR Green试剂盒、Matrigel基质胶(Dojindo公司);Circ-DDX5过表达质粒、阴性对照质粒(上海吉玛制药技术有限公司)。双荧光素酶报告基因检测试剂盒、TRIzol试剂盒(Promega公司);野生型质粒circ-DDX5 WT、突变型质粒circ-DDX5 MUT、NC mimic(CUCGGG CCAUCCCAGCCCACUU)和miR-3940 mimic(上海碧云天生物技术公司);一抗兔源cyclin C、CDK3、Snail、vimentin和β-actin(BD公司)。
1.2 方法
1.2.1 生物信息学分析:通过TCGA数据库分析circ-DDX5在乳腺癌组织中的表达及circ-DDX5表达水平与乳腺癌患者临床分期的关系。通过生物信息学在线网站CSCD预测circ-DDX5和miR-3940之间的互补结合位点。
1.2.2 细胞的分组及处理:将SK-BR-3、MDA-MB-231、BT-549、MCF-7、HCC-1937细胞置于RPMI 1640培养基(含10% FBS),MCF-10A细胞置于DMEM培养基(含10% FBS),培养条件为37 ℃、5% CO2。转染前8 h,将MDA-MB-231细胞接种于12孔板,保证转染时MDA-MB-231细胞汇合度达60%。MDA-MB-231细胞的分组和转染:Circ-DDX5组(转染circ-DDX5过表达质粒)和NC组(转染阴性对照质粒)。通过Lipofectamine 3000转染试剂将质粒转染至MDA-MB-231细胞,收集对数增殖期的MDA-MB-231细胞进行后续研究。
1.2.3 RT-qPCR检测细胞circ-DDX5、miR-3940表达:用TRIzol试剂抽提细胞总RNA,验证纯度以及浓度后反转录为cDNA。根据SYBR Green试剂盒说明书设定RT-qPCR反应条件:96 ℃ 7 min;96 ℃ 11 s,52 ℃ 29 s,71 ℃ 29 s,共31个循环。Circ-DDX5、miR-3940相对表达量通过2-ΔΔCt法计算。Circ-DDX5正向引物:5′-CCCAAGTTGCTTCAGTT GGT-3′,反向引物:5′-TGTGCCTGTTTTGGTACTGC-3′;U6正向引物:5′-TTATGGGTCCTAGCCTGAC-3′, 反向引物:5′-CACTATTGCGGGTCTGC-3′;miR-3940正向引物:5′-CTCAAGGACCACCGCATC-3′, 反向引物:5′-CAGTGCGTGTCGTGGAGT-3′;GAPDH正向引物:5′-CCCCGGTTTCTATAAATTGAGC-3′, 反向引物:5′-CACCTTCCCCATGGTGTCT-3′。
1.2.4 集落形成实验检测MDA-MB-231细胞增殖:收集NC组和circ-DDX5组处于对数增殖期的MDA-MB-231细胞,以4×103个/孔接种在6孔板,每组均为4个复孔。培养至8 d,加入1 mL甲醛溶液,固定1 h。再加入1 mL结晶紫溶液,染色1 h。用流水洗涤,干燥后在肉眼下观察、计数每孔的集落形成数并拍照。
1.2.5 Transwell小室法检测各组MDA-MB-231细胞侵袭:在Transwell上室加入45 μL基质胶,在培养箱内固定。收集NC组和circ-DDX5组处于对数增殖期的MDA-MB-231细胞,以195 μL细胞悬液(4×104个细胞)加入Transwell上室。加入705 μL含16%FBS培养基到下室,连续培养24 h。手持棉签轻柔擦掉上室细胞,加入1 mL甲醛溶液,固定1 h。再加入1 mL结晶紫溶液,染色1 h。在倒置显微镜下,每组随机选6个视野拍照并计数侵袭细胞。
1.2.6 双荧光素酶报告基因实验检测circ-DDX5和miR-3940的靶向关系:野生型质粒circ-DDX5 WT含有circ-DDX5和miR-3940的互补结合序列,突变型质粒含有互补序列的突变序列。通过Lipofectamine 3000转染试剂分别将报告基因质粒circ-DDX5 WT、circ-DDX5 MUT与NC mimic或miR-3940 mimic共转染至MDA-MB-231细胞。连续培养48 h,消化细胞,通过双荧光素酶报告基因实验试剂盒各组MDA-MB-231细胞的荧光素酶活性。
1.2.7 Western blot实验检测MDA-MB-231细胞增殖表型蛋白和侵袭表型蛋白表达:收集NC组和circ-DDX5组处于对数增殖期的MDA-MB-231细胞,加入200 μL蛋白裂解液,继续孵育1 h。采用电泳分离蛋白,随后在低温下转膜,用脱脂牛奶进行固定。分别加入一抗cyclin C(1∶3 000)、CDK3(1∶3 000稀释)、β-actin(1∶4 000)、Snail(1∶1 000稀释)、vimentin(1∶2 000稀释),在低温下孵育11 h。随后加入二抗(1∶7 000稀释),在室温下孵育3 h。用ECL试剂进行染色,在凝胶成像仪中观察条带并拍照。
1.3 统计学分析
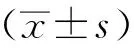
2 结果
2.1 乳腺癌组织中circ-DDX5的表达及其与miR-3940表达的相关性
Circ-DDX5由第1、2、3号外显子首尾相接组成。TCGA数据库显示,circ-DDX5在乳腺癌组织中表达为3.86±1.06明显低于癌旁组织的6.77±1.57(P<0.01);Circ-DDX5表达水平与乳腺癌患者的临床分期呈负相关(P<0.01)(图1);Circ-DDX5在乳腺癌组织中表达水平与miR-3940表达水平呈现明显负相关(r=-0.78,P<0.01)(图2)。

图1 Circ-DDX5表达水平与乳腺癌患者临床分期的关系Fig 1 Relationship between the expression level of circ-DDX5 and the clinical stage of patients with breast cancer

图2 乳腺癌组织中circ-DDX5与miR-3940表达的相关性Fig 2 Correlation between circ-DDX5 and miR-3940 expression in breast cancer tissues
2.2 乳腺癌细胞系中circ-DDX5呈低表达
与MCF-10A细胞比较,SK-BR-3、MDA-MB-231、BT-549、MCF-7、HCC-1937细胞中circ-DDX5呈低表达(P<0.05),MDA-MB-231细胞中circ-DDX5表达较其他乳腺癌细胞系更低,因而选取MDA-MB-231细胞行后续实验(图3)。

*P<0.05,**P<0.01 compared with MCF-10A cells.图3 Circ-DDX5在乳腺癌细胞系中的表达Fig 3 Expression of circ-DDX5 in breast cancer
2.3 Circ-DDX5过表达质粒上调MDA-MB-231细胞中circ-DDX5表达
Circ-DDX5组和NC组MDA-MB-231细胞circ-DDX5表达分别为(9.57±1.25)和(1.04±0.37),与NC组相比,circ-DDX5组MDA-MB-231细胞circ-DDX5表达水平明显增加(P<0.01)。
2.4 过表达circ-DDX5抑制MDA-MB-231细胞增殖
Circ-DDX5组和NC组集落形成数分别为(43±11)个和(101±10)个,与NC组相比,circ-DDX5组MDA-MB-231细胞增殖能力下降(P<0.01)(图4)。

*P<0.05 compared with NC.图4 过表达circ-DDX5对MDA-MB-231细胞对集落形成的影响Fig 4 Effect of over-expression of circ-DDX5 on the colong-forming of MDA-MB-231 n=4)
2.5 过表达circ-DDX5抑制MDA-MB-231细胞侵袭
Circ-DDX5组和NC组侵袭细胞数分别为(20.91±6.66)个和(85.97±14.83)个,与NC组相比,circ-DDX5组MDA-MB-231细胞侵袭能力下降(P<0.01)(图5)。
*P<0.05 compared with NC.图5 过表达circ-DDX5使MDA-MB-231细胞侵袭能力下降Fig 5 Effect of over-expression of circ-DDX5 on the invasion of MDA-MB-231 n=6)
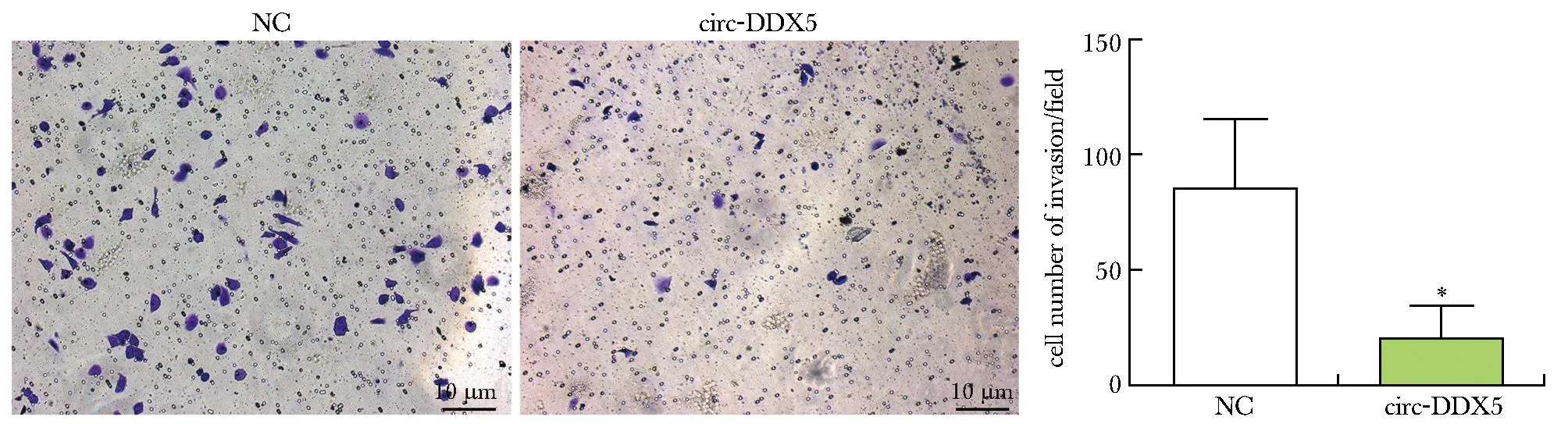
2.6 Circ-DDX5与miR-3940之间存在靶向关系
生物信息学分析网站CSCD预测显示,miR-3940与circ-DDX5存在互补结合位点(图6)。双荧光素酶报告基因实验显示, 与NC mimic+circ-DDX5 WT组相比,circ-DDX5 WT+ miR-3940组MDA-MB-231细胞荧光素酶活性明显降低(P<0.01)(图7)。
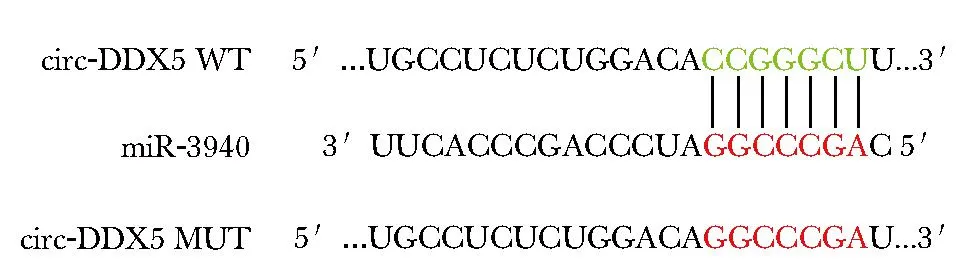
*P<0.01 compared with NC mimic+circ-DDX5 WT.图6 circ-DDX5与miR-3940之间的结合位点Fig 6 Binding site between circ-DDX5 and miR-3940
*P<0.01 compared with NC mimic+circ-DDX5 WT.图7 双荧光素酶报告基因实验验证circ-DDX5与miR-3940的靶向结合Fig 7 Dual-luciferase reporter gene assays verified the targeted binding of circ-DDX5 to miR-3940
2.7 过表达circ-DDX5抑制miR-3940表达
Circ-DDX5组和NC组MDA-MB-231细胞中miR-3940表达分别为(1.01±0.21)和(5.84±0.88),与NC组相比,circ-DDX5组MDA-MB-231细胞miR-3940表达明显降低(P<0.01)。
2.8 过表达circ-DDX5抑制MDA-MB-231细胞增殖表型蛋白和侵袭表型蛋白表达
与NC组相比,过表达circ-DDX5的MDA-MB-231细胞中增殖表型蛋白(cyclin C、CDK3)和侵袭表型蛋白(Snail、vimentin)表达均明显下降(P<0.01)(图8)。
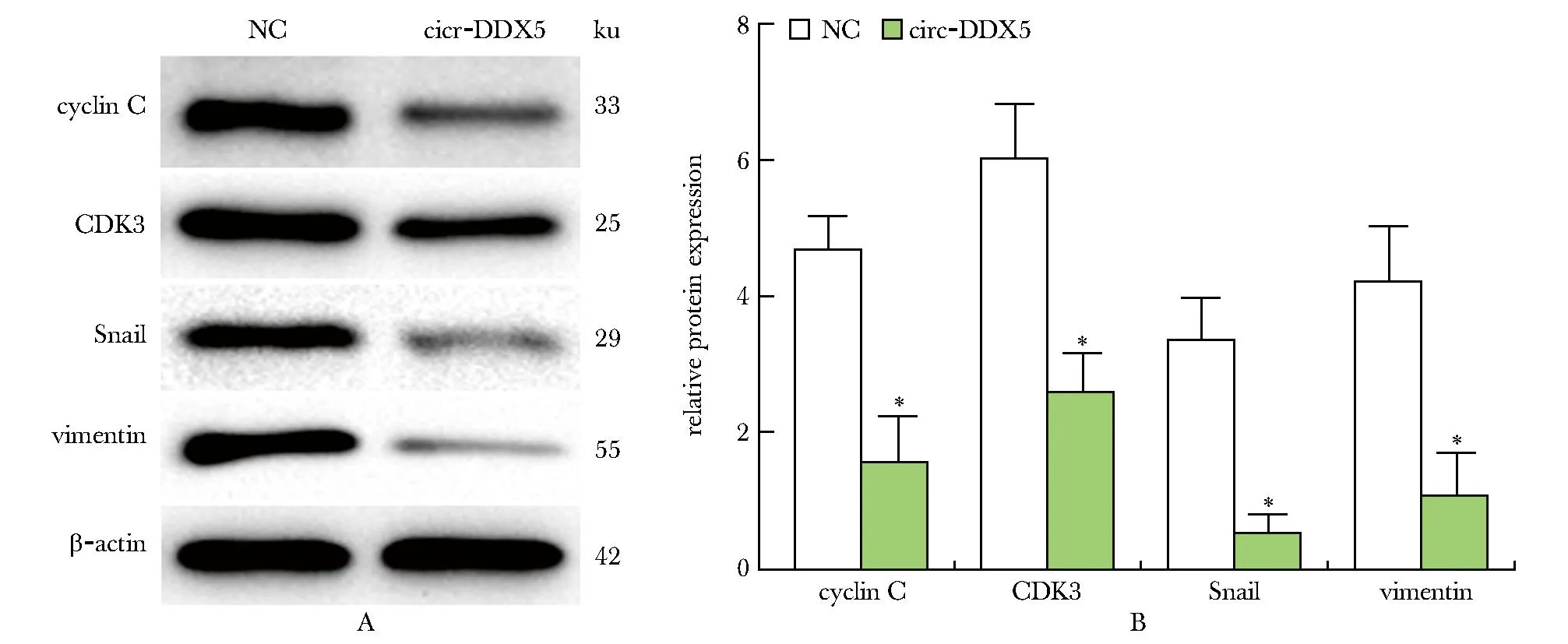
A.Western blot band; B.quantitative analysis of protein expression; *P<0.01 compared with NC.图8 过表达circ-DDX5抑制MDA-MB-231细胞增殖表型蛋白和侵袭表型蛋白表达的影响Fig 8 Effect of over-expression of circ-DDX5 inhibiting the expression of proliferation phenotype proteins and invasion phenotype proteins in MDA-MB-231 n=3)
3 讨论
CircRNA是一种无蛋白编码能力的环形RNA,参与染色质修饰、基因转录等生物过程,调节细胞的代谢、免疫应答、凋亡等活动[10]。近年来,circRNA在乳腺癌发生、进展中的功能已成为乳腺癌研究的热点[7-8]。例如,circ-KDM4B在乳腺癌组织中表达降低,过表达circ-KDM4B在体外和体内均抑制乳腺癌细胞迁移和侵袭,同时在体内抑制血管生成[11]。例如,在乳腺癌组织组织和细胞中circ-RPPH1表达上调,敲低circ-RPPH1通过上调miR-542-3p表达抑制乳腺癌细胞的增殖和转移,促进细胞凋亡[12]。例如,circ-KLHL24在乳腺癌组织和细胞中呈低表达,上调circ-KLHL24能够阻断乳腺癌细胞活力、集落形成、迁移、侵袭和糖酵解进程,miR-1204是circ-KLHL24在乳腺癌细胞中的靶基因[13]。目前, circ-DDX5在乳腺癌中的表达及作用机制尚不清楚。
本实验发现,circ-DDX5在乳腺癌组织中异常低表达,并且circ-DDX5表达水平与乳腺癌患者的临床分期呈负相关。同时,SK-BR-3、MDA-MB-231、BT-549、MCF-7、HCC-1937细胞中circ-DDX5的表达水平均明显低于正常乳腺上皮MCF-10A细胞,提示circ-DDX5的功能可能类似一个抑癌基因。本研究通过体外转染实验表明,过表达circ-DDX5后MDA-MB-231细胞增殖和侵袭能力均明显降低, 值得注意的是MDA-MB-231细胞增殖表型蛋白cyclin C、CDK3以及侵袭表型蛋白Snail、vimentin表达均明显下降,证实circ-DDX5类似一个抑癌基因。越来越多的研究表明,circRNA在细胞内可直接互补结合miRNA,通过调控miRNA的表达影响恶性肿瘤细胞的生物学行为[14]。生物信息学分析网站CSCD预测显示,miR-3940与circ-DDX5存在互补结合位点。miR-3940在乳腺癌组织中表达显著高于癌旁组织,并且miR-3940高表达与乳腺癌患者预后不良有关,敲低miR-3940能够抑制乳腺癌MDA-MB-231细胞和BT-549细胞的增殖、迁移和侵袭[15]。双荧光素酶报告基因实验证实miR-3940与circ-DDX5存在直接靶向关系。体外转染实验显示,过表达circ-DDX5可使MDA-MB-231细胞中miR-3940表达水平降低。值得注意的是,乳腺癌组织中miR-3940与circ-DDX5的表达呈明显负相关。以上研究证实,circ-DDX5通过靶向miR-3940发挥作用。
综上所述,circ-DDX5在乳腺癌组织和细胞中呈低水平表达,其表达水平与乳腺癌患者临床分期相关,circ-DDX5通过靶向抑制miR-3940表达降低乳腺癌MDA-MB-231细胞增殖和侵袭,circ-DDX5有望成为乳腺癌诊断标志物和治疗靶标。

