ATF6调控生殖相关基因HSPA1L表达的分子机制
汪媛媛,朱席琳,伍晓盼,刘 英
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系,北京 100005
男性不育是临床上常见的复杂疾病,多种因素都可能导致不育。当雄性生殖器官发育不良或生殖细胞发生障碍时,即可失去原有的正常生殖功能,造成不育[1]。活化转录因子6 (activating transcription factor 6, ATF6)在内质网应激(endoplasmic reticulum stress, ERS)期间激活未折叠蛋白反应(unfolded protein response, UPR)的靶基因。它通过顺式作用的内质网应激反应元件作为核转录因子发挥作用,该元件存在于编码ER伴侣的基因的启动子中。内质网应激会对睾丸和精子造成损害,导致不育[2]。
大多数热休克蛋白广泛表达并物种高度保守,严格表达对高热、炎性反应和感染等压力的反应[3]。热应激对睾丸最相关的后果是精子发生异常[4]。热休克蛋白A1样蛋白(heat shock protein family A member 1 like, HSPA1L)在睾丸中高度表达,顶体后段和精子中段是其主要表达部位[5]。有研究表明,HSPA1L在低运动精子中的表达显著下降,抑制HSPA1L可影响精子的形态和活力[6]。
本研究针对ERS过程的关键分子ATF6,探索ATF6调控生殖相关基因HSPA1L的分子机制。研究结果表明,ATF6 能结合生殖相关基因HSPA1L的启动子进而调控HSPA1L的表达。这有可能为预防或治疗与ERS有关的男性不育的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞系与质粒载体:人胚肾细胞系HEK-293T(中国医学科学院基础医学研究所细胞资源中心);ATF6过表达质粒载体为p3×-FLAG-CMV-14真核表达载体,TEX35 700、TSSK3 700、OAZ3 700、HSPA1L 700、SPATC1 700、HSPA1L 50启动子质粒的载体为pGL3-Basic,均由上海捷瑞生物工程有限公司构建。
1.1.2 主要试剂:DMEM培养基,胎牛血清FBS,非必需氨基酸NEAA(Gibco公司);Lipofectamine 3000转染试剂盒(Invitrogen公司);双荧光素酶报告基因检测试剂盒(Promega公司);超纯RNA提取试剂盒,RIPA Lysis Buffer(北京康为世纪生物科技有限公司);反转录试剂盒(东洋纺生物科技有限公司);RT-qPCR引物(天一辉远生物科技有限公司);抗ATF6抗体,抗HSPA1L抗体(Proteintech公司);抗GAPDH抗体(Affinity公司);山羊抗兔二抗(中杉金桥生物技术公司);细胞核/质蛋白质抽提试剂盒(爱必信生物科技有限公司);化学发光法EMSA试剂盒(上海碧云天生物技术公司);凝胶迁移或电泳迁移率实验(electrophoretic mobility shift assay,EMSA)探针(上海生工生物工程有限公司)。
1.2 方法
1.2.1 细胞的培养与转染:细胞培养使用含10% FBS的DMEM培养基+1%NEAA,在恒温37 ℃,5% CO2的培养箱中培养。取对数增殖期的HEK-293T细胞接种至24孔板,细胞汇合度70%时进行细胞转染,使用Lipofectamine 3000试剂按照说明书进行瞬时转染,将HEK-293T细胞分为对照组(转染空载对照质粒)和实验组(转染ATF6过表达质粒)。转染48 h后进行后续实验。
1.2.2 筛选ATF6下游生殖相关基因:取4周龄的雄性ATF6敲除小鼠和雄性野生型小鼠的睾丸组织,提取RNA,进行转录物组测序。转录物组测序由实验室前期研究完成。根据测序结果筛选受ATF6正向调控的生殖相关基因。
1.2.3 双荧光素酶报告基因实验(dual luciferase reporter gene assay):将HEK-293T细胞与SV40,Flag-ATF6,空载体和生殖相关基因的启动子质粒在24孔板中瞬时共转染。48 h后,使用双荧光素酶报告检测系统和Promega GloMAX 96微孔板发光仪分析荧光素酶活性。
1.2.4 生物信息学分析:使用在线网站Gene-Regulation ALiBaba2.1(http://www.gene-regulation.com)对目的生殖相关基因启动子结合的转录因子及其结合位点进行预测分析。
1.2.5 实时荧光定量PCR(RT-qPCR)检测RNA表达:采用Trizol法提取细胞总RNA,根据反转录试剂盒说明书反转录RNA为cDNA。 按照试剂盒说明书进行扩增,以GAPDH为内参检测ATF6和HSPA1LmRNA的相对表达。本实验所需引物如下:ATF6上游引物 5′-CCCAAGACTCAAACAAACT C-3′,下游引物 5′-GTGATTAGGGAGCTGTGTGA-3′;HSPA1L上游引物 5′-TTACCGTGCCAGCCTATTTCA-3′,下游引物 5′-AGCACATTAAGTCCAGCAATCA-3′;GAPDH上游引物 5′-TCTGACTTCAACAGCGACAC-3′,下游引物 5′-CAAATTCGTTGTCATACCAG-3′。
1.2.6 蛋白免疫印迹实验(Western blot)检测蛋白质表达:使用带有蛋白酶抑制剂的RIPA裂解液提取蛋白质。蛋白质样品用10% SDS-PAGE,然后采用湿转法转至PVDF膜上,并在室温下封闭在5%脱脂奶粉中2 h。之后,将膜与一抗(稀释比均为1∶1 000)在4 ℃下孵育过夜。第2天与HRP偶联的二抗(稀释比1∶10 000)进一步孵育2 h。使用ECL法曝光显影,检测ATF6和HSPA1L蛋白的表达。
1.2.7 凝胶迁移实验(electrophoretic mobility shift assay,EMSA)检测蛋白质与DNA的结合:提取细胞核蛋白质,根据1.2.4预测的结合序列设计相关EMSA探针。本实验所用探针如下:生物素标记的探针:HSPA1L启动子探针5′-biotin-TATAAGTCGTC ACGGAGACCCGCCTTTTCCCTT-3′,互补探针5′-biotin-AAGGGAAAAGGCGGGTCTCCGTGACGACTTATA-3′;未标记的探针:HSPA1L启动子冷竞争探针5′-TATA AGTCGTCACGGAGACCCGCCTTTTCCCTT-3′,互补探针 5′-AAGGGAAAAGGCGGGTCTCCGTGACGACT TATA-3′;突变的HSPA1L启动子冷竞争探针5′-TATAACGGAGACCCGCCTTTTCCCTT-3′,互补探针 5′-AAGGGAAAAGGCGGGTCTCCGTTATA-3′。将探针与互补探针1∶1混匀,生物素标记的探针终浓度为100 nmol/L,未标记的探针终浓度为10 μmol/L,100 ℃退火形成双链探针,自然冷却。将蛋白质与探针混合制样,样品在0.5×TBE中用4%的聚丙烯酰胺凝胶电泳,然后采用湿转法转至尼龙膜上,0.5×TBE作为转膜液,380 mA,转膜45 min。紫外交联仪选择在254 nm紫外波长处,120 mJ/cm2,交联50 s。 封闭洗涤后,采用化学发光法检测蛋白质与DNA的结合。
1.3 统计学分析
2 结果
2.1 ATF6过表达效率验证
HEK-293T细胞转染ATF6过表达质粒后,ATF6的mRNA表达水平显著升高(P<0.001)(图1A)。孵育ATF6抗体,与对照组的内源性ATF6相比,ATF6蛋白表达量也明显升高(P<0.05)(图1B, C)。

Flag.p3×-FLAG-CMV-14; Flag-ATF6.p3×-FLAG-CMV-14-ATF6; A.real-time PCR analysis of the mRNA expression of ATF6 *P<0.05, **P<0.01 compared with Flag group.图1 过表达ATF6后mRNA和蛋白表达水平的变化Fig 1 Changes in mRNA and protein expression after over-expression of n=3)
2.2 转录物组测序筛选出ATF6下游基因
根据本课题组前期转录物组测序结果(BioSample accession: SAMN18643078)[7],筛选出与精子发生功能相关的睾丸特异性表达基因。为进一步缩小筛选范围,按照差异的显著性小于0.05,选择受ATF6正向调控的下游基因。最后,本研究选择SPATC1、TEX35、TSSK3、OAZ3、HSPA1L作为候选基因。
2.3 双荧光素酶报告基因实验确定ATF6对HSPA1L启动子活性促进最显著
候选基因的启动子荧光质粒由5′UTR序列和其上游的700 bp启动子序列构成。其中启动子活性较高的2个基因为TEX35和HSPA1L(图2A)。 ATF6过表达显著增强了TEX35(P<0.001)和HSPA1L(P<0.001)的启动子荧光素酶活性,且ATF6对于HSPA1L启动子的促进效果最为明显(图2B),最终确定HSPA1L为所研究的ATF6下游靶基因。

SPATC1.pSPATC1-700; TEX35.pTEX35-700; TSSK3.pTSSK3-700; OAZ3.pOAZ3-700; HSPA1L.pHSPA1L-700; Flag.p3×-Flag-CMV-14; Flag-ATF6.p3×-Flag-CMV-14-ATF6; A.dual-luciferase reporter assay analysis of the relative promoter activity of five different promoters B.HEK-293T cells were co-transfected with ATF6 plasmids and TEX35, HSPA1L promoters; Luciferase assays in indicated cells *P<0.001 compared with Flag group.图2 双荧光素酶报告基因实验比较启动子活性Fig 2 Comparison of promoter activity by dual luciferase reporter gene n=3)
2.4 预测ATF6结合HSPA1L启动子的位点并检测ATF6对截短启动子活性的影响
Gene-Regulation ALiBaba2.1(http://www.gene-regulation.com)预测结果显示,在HSPA1L700启动子序列上与ATF结合位点的序列为aagtcgtcac(图3A)。根据预测到的结合序列,构建包含结合位点及其前后各20 bp的启动子50 bp质粒(图3B)。过表达ATF6对截短的50 bp启动子活性仍有显著的促进作用(P<0.001)(图3C)。
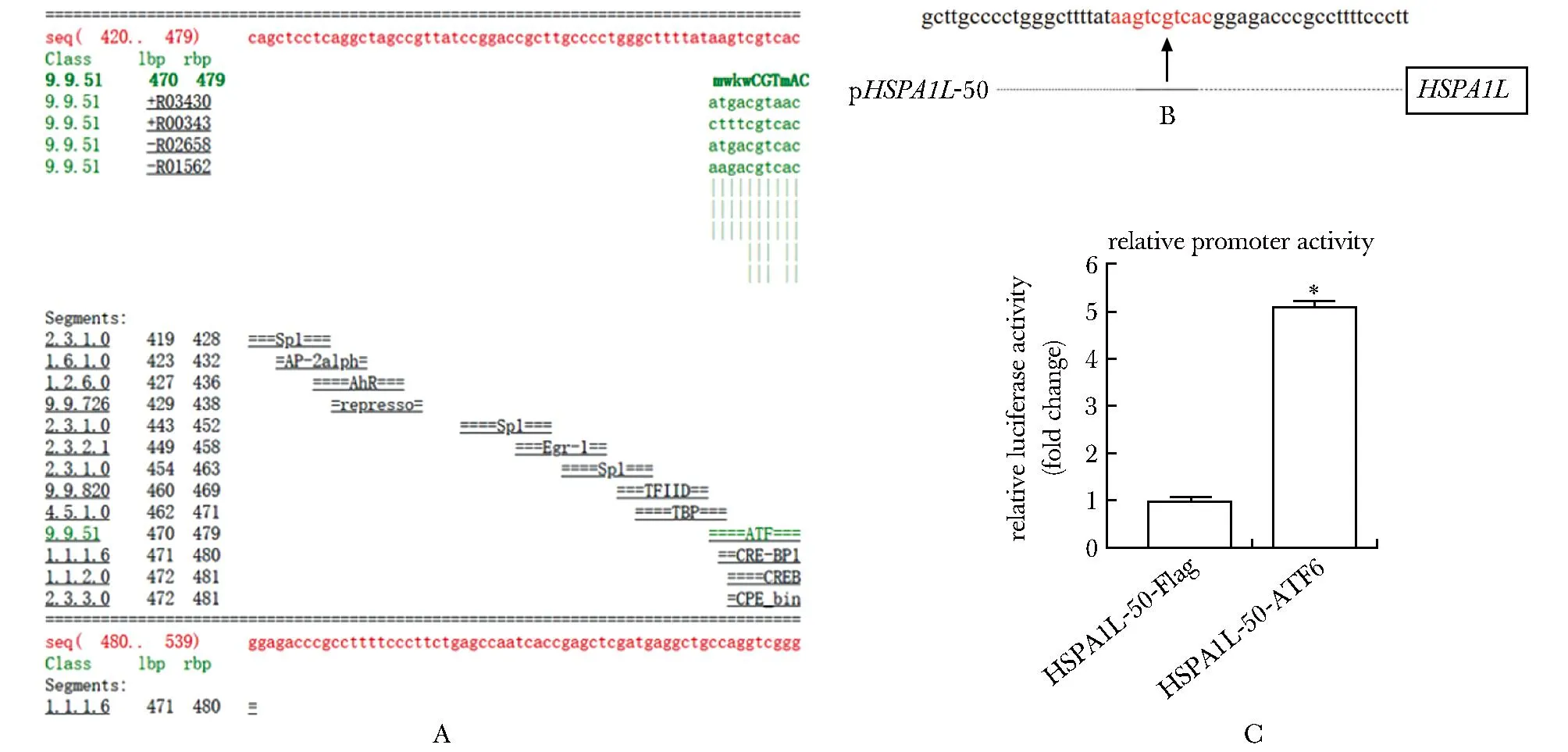
HSPA1L-50.pHSPA1L-50; Flag.p3×-Flag-CMV-14; Flag-ATF6.p3×-Flag-CMV-14-ATF6; A.the binding site of ATF to HSPA1L promoter; B.schematic diagram of HSPA1L 50 promoter plasmid; C.HEK-293T cells were co-transfected with ATF6 plasmids and truncated HSPA1L promoters; Luciferase assays in indicated cells; *P<0.001 compared with Flag group.图3 确定ATF与HSPA1L启动子的结合位点Fig 3 Determination of the binding site of ATF to HSPA1L n=3 )
2.5 过表达ATF6可使HSPA1L的表达上调
HEK-293T细胞转染ATF6过表达质粒后,与对照组相比,实验组HSPA1L的mRNA(P<0.001)(图4A)和蛋白(P<0.05)表达均显著增加(图4B, C)。这与前述ATF6促进HSPA1L启动子活性的趋势相一致。

Flag.p3×-Flag-CMV-14; Flag-ATF6.p3×-Flag-CMV-14-ATF6; A.real-time PCR analysis of the mRNA expression of B.Western blot showed the protein expression of HSPA1L, ATF6; C.relative protein levels of HSPA1L and ATF6 detected by densitometry *P<0.05, **P<0.01, ***P<0.001 compared with Flag group.图4 过表达ATF6促进HSPA1L的mRNA和蛋白表达Fig 4 Over-expression of ATF6 promoted the mRNA and protein expression of n=3)
2.6 ATF6 蛋白与HSPA1L的启动子DNA序列结合
ATF6与HSPA1L启动子aagtcgtcac序列产生结合条带,当加入冷竞争探针时结合条带消失,而加入突变的冷竞争探针时出现结合条带,证实了ATF6蛋白与HSPA1L启动子DNA有相互作用(图5)。

EMSA was used to detect the binding of ATF6 to HSPA1L promoter;wt.wild type; mut.mutant图5 ATF6蛋白与HSPA1L的启动子DNA序列相结合Fig 5 ATF6 protein bound to the promoter DNA sequence of HSPA1L
3 讨论
ERS通过调节不同应激条件下的自噬和细胞凋亡来维持生存与死亡之间的平衡。有研究表明,睾丸中的热应激是男性不育的主要原因之一,与活性氧(reactive oxygen species, ROS)过量产生和诱导睾丸精子凋亡有关[8]。持续热应激诱导睾丸 Leydig 细胞的ERS会阻断 Leydig 细胞中睾酮的合成,从而影响精子的发生[9]。这些研究结果证实内质网应激除了能影响精子,还能影响附睾中的生殖细胞和激素合成,从而导致男性不育。目前,ERS激活下游UPR信号通路已成为研究生殖细胞生存和凋亡的重要内容之一。
人类HSP70(HSPA)家族由13个成员组成,这些成员的氨基酸序列、亚细胞定位和表达水平各不相同[10]。在HSP70家族中,HSPA1L被认为是一种“睾丸特异性”热休克蛋白,在精子中高度表达[11]。同时,有研究表明,HSPA1L对于雄性生殖至关重要,HSPA1L磷酸化可保护雄性生殖细胞免受热应激诱导的细胞凋亡[12]。已有研究表明内质网应激在雄性生殖过程中发挥着重要的作用[2],但目前关于HSPA1L与内质网应激之间是否存在某种关联尚不清楚。
本研究以ERS的关键分子ATF6探讨其对生殖相关基因HSPA1L的调控作用,将为预防或治疗与ERS有关的男性不育的深入研究奠定基础。基于转录物组测序的结果,将HSPA1L定为研究对象,探究ATF6对下游基因HSPA1L表达的影响。在HEK-293T细胞中验证了ATF6 可以促进HSPA1L启动子的活性,并在瞬时转染ATF6真核表达质粒后,HSPA1L在mRNA 水平和蛋白质水平均随之上调。EMSA实验也显示,ATF6蛋白可以和HSPA1LDNA相互作用,这也进一步验证了HSPA1L的表达受到ATF6的调控。
本研究存在一定的局限性。由于转染效率问题,最终选择转染效率较高的HEK-293T细胞系进行关于ATF6 如何调控HSPA1L的分子机制研究。但实际上,HSPA1L主要在睾丸的精子细胞中表达,在肾脏、脾脏等器官中也有表达,但表达量较低。因此,HEK-293T 细胞不一定是本项研究中在细胞系上的最佳选择。但是在一定程度上可以推测,在HSPA1L表达程度更高的细胞中,ATF6对其调控的分子机制很有可能是相似的。
综上所述,本研究表明,在HEK-293T细胞中,过表达ATF6可以通过结合HSPA1L启动子上调HSPA1L的转录和翻译水平。这将为进一步研究预防或治疗与ERS有关的男性不育奠定基础。

