稳定表达FIP1L1-PDGFRA及其突变体细胞株的构建和耐药性评价
刘婧雯,宋昊昕,朱 蕾
中国医学科学院基础医学研究所 北京协和医学院基础学院 中国医学科学院医学表观遗传研究中心 药理学系,北京 100005
FIP1L1-PDGFRA(fip1-like 1-platelet-derived growth factor receptor alpha, F/P)是一种融合基因,其形成是由于染色体4q12的间隙性缺失,使其上游短缺的FIP1L1基因融合至断裂的PDGFRA基因上。该融合基因首先在高嗜酸性粒细胞综合征(hypereosinophilic syndrome, HES)中被鉴定,后续研究证实它是慢性嗜酸性粒细胞白血病(chronic eosinophilic leukemia, CEL)的主要病因[1-3]。来源于CEL患者的人急性髓细胞(嗜酸粒细胞)白血病细胞[human acute myeloid cells (eosinophils) leukemia cells, EOL-1]细胞系表达该基因,因此被作为研究F/P融合基因以及CEL的体外细胞模型[4]。此外,在系统性肥大细胞增多症、急性髓系白血病以及T淋巴母细胞性淋巴瘤等血液疾病中亦可出现该融合基因[5-6]。
F/P融合基因编码的F/P融合蛋白具有组成性酪氨酸激酶活性,可促嗜酸性粒细胞克隆性增殖,造成组织器官损害。酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)伊马替尼(imatinib)可以靶向PDGFR,对CEL等存在F/P融合基因的疾病具有较好疗效[7-8],但使用后出现的T674I和D842V突变致伊马替尼耐药问题较为突出。索拉非尼(sorafenib)和尼洛替尼(nilotinib)被报道对伊马替尼耐药的T674I突变有效,但D842V突变则对多种TKIs完全耐药,仅对阿法替尼(avapritinib)敏感[9-10]。另外,TKIs在使用中产生的毒副作用亦不容忽视。鉴于此,发现安全和高活性的靶向F/P融合蛋白及其突变体的新药是临床上迫切需要解决的难题。
本研究拟构建能稳定表达F/P及其突变体的转染细胞株BaF3-F/P、BaF3-F/P-T674I和BaF3-F/P-D842V,并通过检测它们对伊马替尼、索拉非尼和阿法替尼等TKIs阳性药的响应以评价其活性,以期为开发以F/P及其T674I、D842V突变为靶点的化合物提供良好的细胞模型。
1 材料与方法
1.1 材料
1.1.1 细胞系与细胞株:小鼠原B淋巴细胞系(BaF3中国医学科学院基础医学研究所细胞资源中心);BaF3-F/P、BaF3-F/P-T674I和BaF3-F/P-D842V稳定转染(稳转)细胞株(赛业生物科技有限公司构建)。
1.1.2 主要试剂: IMDM培养基和双抗(中国医学科学院基础医学研究所细胞资源中心);胎牛血清(FBS,Gibco公司);小鼠IL-3(CST公司);CCK8(兰杰柯科技有限公司);伊马替尼、索拉非尼和阿法替尼(MedChemexpress公司);其余试剂由赛业生物科技有限公司提供。
1.2 方法
1.2.1 细胞的培养:将BaF3细胞用含10% FBS和1 ng/mL IL-3的IMDM培养基(含双抗)于37 ℃、5% CO2培养箱中培养;BaF3-F/P、BaF3-F/P-T674I和BaF3-F/P-D842V细胞用含10% FBS的IMDM培养基(含双抗)培养,取对数增殖期的细胞做研究。
1.2.2 稳转细胞株的构建:构建慢病毒表达载体(LV-EFS>FIP1L1-PDGFRA-CMV>EGFP/T2A/Puro;LV-EFS>FIP1L1-PDGFRA-T674I-CMV>GFP/T2A/Puro;LV-EFS>FIP1L1-PDGFRA-D842V-CMV>EGFP/T2A/Puro;空载体为LV-CMV>EGFP/T2A/Puro),酶切并进行琼脂糖凝胶电泳鉴定,经测序(图1)比对,验证正确无误后,与包装质粒(pGag/Pol、pRev和pVSV-G)一起转染293T细胞,进行慢病毒包装并进行滴度检测。以重组慢病毒感染BaF3细胞,用嘌呤霉素筛选获得稳定表达的单克隆细胞。在荧光显微镜下可见细胞均发出绿色荧光(图2),荧光率在80%以上。经扩大培养鉴定后分别命名为BaF3-F/P、BaF3-F/P-T674I、BaF3-F/P-D842V和BaF3-empty vector细胞。
1.2.3 RT-qPCR检测mRNA:RNA提取、RNA反转录、RT-qPCR均按相应试剂盒说明书操作,基因定量表达采用2-ΔΔCt法。引物见表1。
1.2.4 CCK-8法检测细胞增殖:收集细胞并制备细胞悬液,以3×105个/孔密度接种于96孔板中,加入不同浓度伊马替尼、索拉非尼或阿法替尼,在37 ℃、5% CO2培养箱中分别孵育24 h和48 h后,加入CCK-8试剂。继续孵育1 h后,用酶标仪在450 mm处测定吸光度,并计算增殖抑制率。
1.3 统计学分析
2 结果
2.1 稳转细胞株中FIP1L1和PDGFRA mRNA的表达
3组细胞均表达FIP1L1和PDGFRA mRNA,而BaF3-empty vector细胞无表达(图3)。
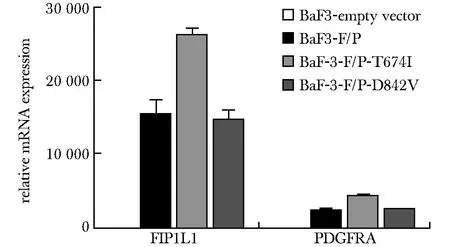
#P<0.05,##P<0.01 compare with BaF3-empty vector;*P<0.05,**P<0.01 compare with BaF3-F/P.图3 QPCR检测FIP1L1和PDGFRA的mRNA表达Fig 3 The mRNA expressions of FIP1L1 and PDGFRA were detected by n=3)
2.2 稳转细胞株对TKIs的敏感性
BaF3细胞的增殖需要依赖IL-3,而BaF3-F/P、BaF3-F/P-T674I和BaF3-F/P-D842V细胞在无IL-3培养条件下仍具有较强增殖能力。伊马替尼和索拉非尼在较低的浓度即可抑制BaF3-F/P细胞的增殖,伊马替尼作用24 h和48 h的IC50分别为0.3624 nmol/L和0.129 8 nmol/L,索拉非尼在2个时间点的IC50均低于0.01 nmol/L;索拉非尼和阿法替尼可抑制BaF3-F/P-T674I细胞增殖,索拉非尼作用24 h和48 h的IC50分别为24.7 nmol/L和476.3 nmol/L,阿法替尼作用24 h和48 h的IC50分别为4 376 nmol/L和434.8 nmol/L;而BaF3-F/P-D842V细胞仅对高浓度阿法替尼敏感,24 h和48 h的IC50分别为474.1 nmol/L和1 867 nmol/L(图4)。

图4 TKIs对BaF3-F/P、BaF3-F/P-T674I和BaF3-F/P-D842V 细胞的增殖抑制作用Fig 4 Inhibitory effects of TKIs on the proliferation of BaF3-F/P, BaF3-F/P-T674I and BaF3-F/P-D842V
3 讨论
在F/P融合基因中,FIP1L1基因断裂点多变,而PDGFRA基因的断裂点主要集中在第12号外显子,使跨膜决定区的第一个W(色氨酸)残基缺失,导致负性调控体的WW结构域被破坏,PDGFRA酪氨酸激酶的自我抑制作用消失而持续活化,进一步异常激活下游信号转导通路,包括RAS-RAF-ERK、PI3K-AKT以及JAK-STAT等,致使细胞增殖失控和肿瘤生成[11]。尤其在CEL中,F/P融合基因是其特征性基因,可以驱动外周血、骨髓和周围组织中嗜酸性粒细胞持续增多,释放细胞因子、酶或其他蛋白,导致靶器官损害,其中心、肺、中枢神经系统、皮肤和胃肠道最常受累,心肺功能衰竭是患者的主要死因。因此,F/P已成为CEL的药物探索靶标[8]。
鉴于F/P融合蛋白具有受体酪氨酸激酶活性,TKI伊马替尼是目前治疗F/P相关疾病的首选药物,但长期使用可引起骨髓造血紊乱,且不能缓解F/P融合蛋白过度活化引起的心脏损害,而靶细胞坏死释放大量毒素会加重心脏毒性并引起致死性心脏衰竭[7]。此外,T674I和D842V等位于ATP结合位点区域的点突变是造成伊马替尼获得性耐药的主要机制[11]。P/F-T674I属于gatekeeper突变,gatekeeper位置的苏氨酸(T)被替换为更大更亲脂的异亮氨酸(I),阻止伊马替尼进入ATP结合位点的疏水口袋[12]。索拉非尼和尼洛替尼在体外实验中显示对T674I突变的有效性[9],但临床效果有限[13]。P/F-D842V突变则影响ATP结合口袋中活化环的调控功能,不利于伊马替尼、索拉非尼等传统Ⅱ型TKIs的结合[14],阿法替尼是目前唯一针对PDGFRA D842V突变的靶向药物[8]。
针对上述临床治疗中面临的困境和挑战,构建合适的细胞筛选模型并在此基础上发现高活性、高选择性且毒副作用小的新型药物具有重要意义。本研究采用慢病毒转导技术构建了稳定表达F/P及其突变体的BaF3-F/P、BaF3-F/P-T674I和BaF3-F/P-D842V细胞系。选用的靶细胞是BaF3,其增殖是依赖细胞因子IL-3的,而转化F/P以及T674I、D842V突变体的BaF3细胞则能表现出不依赖IL-3增殖的恶性表型特征。进一步,检测3株细胞对相应TKIs的敏感性以评价其活性。结果发现,BaF3-F/P细胞对伊马替尼和索拉非尼敏感;BaF3-F/P-T674I细胞对伊马替尼耐药,对索拉非尼敏感;而BaF3-F/P-T674I细胞对伊马替尼和索拉均耐药,仅较高浓度的阿法替尼能抑制其增殖;上述结果与文献报道的F/P以及T674I、D842V突变对TKIs的响应是一致的。综上,本研究成功构建了靶向F/P及其T674I、D842V突变的化合物筛选细胞模型,为后续筛选和评价新型靶向药物奠定基础。

