木瓜籽肽-锌螯合物的制备、结构表征及稳定性研究
邓叶俊, 黄立新, 张彩虹, 谢普军
(中国林业科学研究院 林产化学工业研究所;江苏省生物质能源与材料重点实验室;国家林业和草原局林产化学工程重点实验室;林木生物质低碳高效利用国家工程研究中心;江苏省林业资源高效加工利用协同创新中心,江苏 南京 210042)
锌是人体所需的必需微量元素之一,具有重要的生理功能[1]。锌在机体内参与多种生物酶活性中心的组成,直接参与酶的催化与共催化,控制多种生理过程,包括大脑发育、行为反应、骨骼形成和伤口愈合等,是生长发育、性腺功能和调节新陈代谢必不可少的微量元素[2-3]。此外,锌对细胞的增殖分化、细胞膜结构的稳定和免疫系统调节等方面具有重要意义。可见锌在人体多种基本生理功能中扮演重要角色,缺锌可导致一系列疾病的发生,如免疫功能丧失、发育不良、代谢紊乱等,严重危害人体的生命健康[4-6]。据统计,目前我国居民缺锌现状依然严峻,儿童缺锌问题尤为突出[7]。造成人体缺锌主要有两方面原因:一是日常饮食中锌含量低,二是锌的吸收不足。膳食中的锌在消化系统中主要以锌离子的形式存在,膳食纤维等非消化性碳水化合物的吸附效应可降低锌在消化系统中的利用度。目前常见的锌补剂多以有机弱酸为配体,与无机锌相比,有机锌增补剂的口感有所改善,对胃肠道的刺激性降低,口服利用率稍有提升[8-9]。但有机锌增补剂存在合成工艺复杂、吸收率不高等局限性。因此,迫切需要研究开发稳定性强、吸收率高的锌补剂。
肽和锌离子构建的螯合物具有化学稳定性好、生物利用度高、安全无毒等特点[10],引起科研人员的广泛关注。肽-锌离子螯合物在消化道各pH值条件下溶解性良好,不仅能减少植酸等抑制剂与其结合形成不溶性复合物,还能降低膳食纤维对锌离子的吸附效应,从而有效增加锌的吸收率[11]。在前期工作中发现,木瓜籽蛋白含量丰富,水解后获得的小分子肽生物活性强[12],极具应用前景,但目前鲜见木瓜籽肽-锌离子螯合物相关的报道。本研究构建了高螯合率的木瓜籽蛋白水解肽-锌离子螯合物,同时对其结构进行表征,并评价肽-锌离子螯合物的稳定性,以期为木瓜籽肽的利用和新一代锌补剂的研究提供理论依据。
1 材料与方法
1.1 原料、试剂与仪器
皱皮木瓜籽,购买于安国大药房(产地为四川北川);硫酸锌七水合物、胃蛋白酶、碱性蛋白酶、木瓜蛋白酶、风味蛋白酶,美国Sigma-Aldrich公司;胰蛋白酶及菠萝蛋白酶,上海麦克林生化科技有限公司;乙二胺四乙酸二钠、铬黑T试剂,上海阿拉丁试剂公司;其他所用试剂均为分析纯,实验中使用的水均为蒸馏水。
电热恒温鼓风干燥箱;iS50型红外光谱(FT-IR)仪,美国Thermo Fisher公司;SpectraMax®i3x酶标仪,美国美谷分子公司;Wizard 2.0冷冻干燥机,美国Virtis公司;L-8800氨基酸自动分析仪,日本日立公司;TU-6紫外-可见(UV-Vis)分光光度计,德国耶拿仪器公司;AA300原子吸收分光光度计,美国PE公司。
1.2 实验方法
1.2.1木瓜籽肽的制备 干燥的木瓜籽粉碎后采用索氏提取法脱脂,脱脂木瓜籽粕采用碱溶解(pH值10.0)酸沉淀(pH值4.2)法制备分离蛋白。取一定量木瓜籽分离蛋白加入蒸馏水中使其质量分数为10%,搅拌均匀后分别加入1%(以分离蛋白质量计)的不同种类蛋白酶,充分混合后在各蛋白酶最适温度和pH值下水解4 h,水解过程中使用1 mol/L的NaOH或HCl维持体系的酸碱度。水解反应完成后,将反应液置于95 ℃下水浴10 min灭活。冷却至室温,水解液于8 000 r/min离心10 min除去不溶物,上清液冻干后获得不同酶水解木瓜籽肽(CQSP)。
1.2.2木瓜籽肽的超滤 将冻干得到的木瓜籽肽均匀分散于蒸馏水中,使其最终质量分数为8%。于8 000 r/min下离心10 min以除去不溶物,上清液依次通过截留分子质量为1 000、 3 000、 5 000和10 000 u的超滤膜后,冻干获得≤1 000 u、 >1 000~3 000 u、 >3 000~5 000 u、 >5 000~10 000 u和>10 000 u这5个不同分子质量范围的多肽组分。
1.2.3木瓜籽肽-锌螯合物的制备 参考Sun等[13]报道的方法,调节木瓜籽肽溶液(10 g/L)的pH值至6.0后,加入一定量硫酸锌七水合物,使硫酸锌浓度为9 mmol/L,充分混匀后于60 ℃下反应1 h。反应完成后,向溶液中加入3倍体积无水乙醇,4 ℃过夜,混合液于8 000 r/min下离心10 min,沉淀物使用50%乙醇洗涤3次后冻干,获得木瓜籽肽-锌螯合物(CQSP-Zn)。
1.3 分析方法
1.3.1锌离子螯合率测定 采用原子吸收分光光度计法测定。准确称取0.5 g的CQSP-Zn或CQSP于消解管中,加入10 mL硝酸静置过夜后,于电热板上加热(120 ℃)消解1 h,加热消解期间溶液变为黄棕色时适当加硝酸,至溶液透明样品完全消解,冷却后加蒸馏水定容至25 mL容量瓶中。利用原子吸收分光光度计进行检测,同时使用锌标准溶液建立标准曲线,得回归方程:y=0.135 1x+0.191 6,R2=0.999 4(质量浓度范围0.8~2.0 μg/L)。对螯合物中的锌进行定量分析,螯合率通过式(1)计算:
Y=(m1-m2)/m×100%
(1)
式中:Y—锌离子的螯合率,%;m1—CQSP-Zn中锌离子质量,g;m2—CQSP中锌离子质量,g;m—锌离子的使用量,g。
1.3.2氨基酸组成分析 CQSP及CQSP-Zn氨基酸组成的测定参考Rezig等[14]的方法加以调整。称取20 mg样品于干燥的试管中,加入4 mL的HCl溶液(6 mol/L),通入氮气赶走空气后封管,于110 ℃下水解24 h。水解完成后,冷却至室温,以蒸馏水定容至10 mL容量瓶。取2 mL水解液,旋蒸干燥,再以水溶解、旋蒸干燥,重复3次后,加入2 mL柠檬酸盐缓冲液(pH值2.2,0.55 mol/L)溶解样品,离心后上清液过0.22 μm滤膜。滤液上氨基酸自动分析仪进行检测,通过建立标准曲线,对样品中的氨基酸进行定量。
1.3.3紫外扫描分析 参考刘晶晶等[15]的方法,用蒸馏水配置质量浓度为0.1 g/L的木瓜籽肽溶液,向溶液中加入硫酸锌。以蒸馏水为空白,使用紫外分光光度计测定紫外光谱特征图谱,扫描范围为190~500 nm。
1.3.4红外光谱分析 取2 mg干燥的CQSP或CQSP-Zn粉末样品,与100 mg干燥的KBr于玛瑙研钵中研磨均匀(红外灯下进行)后,放入压片模具,抽气加压获得透明样品片,放入测定室内采用傅里叶变换红外光谱仪进行检测,扫描波数范围为4 000~500 cm-1。
1.3.5荧光光谱分析 参考Fang等[16]的方法略作调整。用蒸馏水配置质量浓度为0.05 g/L的木瓜籽肽溶液,向溶液中加入硫酸锌。设定激发波长为280 nm,于300~500 nm范围的发射波长内记录荧光强度变化。
1.4 酸碱度对锌溶解度影响分析
硫酸锌和CQSP-Zn在不同pH值下溶解性参考Eckert等[17]的方法测定。将50 mg硫酸锌和50 mg的CQSP-Zn充分溶于25 mL蒸馏水后,分别调节体系的pH值为2.0~8.0,摇床振荡(600 r/min)30 min后,于8 000 r/min离心10 min。上清液消解后,采用原子吸收分光光度计测定上清液中锌离子含量,通过式(2)计算锌离子溶解度:
S=m1/m0×100%
(2)
式中:S—锌离子的溶解度,%;m1—上清液中锌离子质量,g;m0—总的锌离子质量,g。
1.5 模拟胃肠道消化锌溶解度
硫酸锌和CQSP-Zn溶解度在模拟胃肠道消化的测定参照O’Loughlin等[18]的方法。将一定量胃蛋白酶加入到150 mmol/L的NaCl溶液中,使其质量浓度为4 g/L,作为模拟胃液。取0.45 g胰蛋白酶、 6.25 g NaHCO3及3 g胆盐溶于100 mL蒸馏水中,作为模拟肠液。称取2.00 g CQSP-Zn或硫酸锌于100 mL蒸馏水中搅拌均匀,于37 ℃孵育0.5 h。使用1 mol/L盐酸调节体系pH值至3.5后,加入5 mL模拟胃液后将体系pH值调节至2.0,模拟样品在胃部的消化(37 ℃消化90 min),分别在消化第0、 30、 60和 90 min 时移取5 mL消化液。随后,使用0.6 mol/L的Na2HPO4调节消化液pH值至7.5,按样品液与模拟胰液体积比10∶1加入模拟胰液,开始模拟样品在肠道中的消化过程,分别在该过程的第0、 30、 60、 90和150 min移取5 mL消化液。收集的消化液于100 ℃处理10 min灭活,于8 000 r/min下离心10 min,收集上清液消解后测定锌离子含量,锌离子溶解度按照式(2)计算。
1.6 数据处理与分析
所有数据均以3次试验结果的平均值±标准误差(mean±SD)表示,使用Excel软件进行显著性差异分析,当P<0.05时差异显著。
2 结果与分析
2.1 不同条件对Zn2+螯合率的影响
水解蛋白酶的种类及其水解物的分子质量是影响Zn2+螯合率的重要因素[19]。为提高CQSP对Zn2+的螯合率,分别对水解木瓜籽分离蛋白酶的种类及构建Zn2+螯合物较佳分子质量肽段进行了筛选,结果见表1。由表1可知,5种蛋白酶水解的木瓜籽肽均具有Zn2+螯合能力,但不同酶水解的多肽对Zn2+的螯合能力存在差异。其中风味蛋白酶水解肽Zn2+螯合率最低为24.01%,胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶水解肽Zn2+螯合率相似,碱性蛋白酶水解肽Zn2+螯合率最高为70.84%。这可能是酶的专一性导致的,不同酶在同一蛋白上的酶切位点不同,导致水解释放出肽段的N端和C端氨基酸组成不同、肽段的长度有差异和氨基酸序列有区别等,都会影响肽对Zn2+的螯合[20]。由上述分析可知,碱性蛋白酶水解肽的Zn2+螯合率最高,因此选择碱性蛋白酶为较佳水解酶。

表1 不同条件对Zn2+螯合率的影响
进一步将碱性蛋白酶水解的CQSP根据分子质量大小分为≤1 000 u、>1 000~3 000 u、>3 000~5 000 u、 >5 000~10 000 u及>10 000 u这5种不同分子质量的组分,各组分对Zn2+的螯合率见表1。由表可知,分子质量对CQSP螯合Zn2+能力有重要影响,分子质量越小的肽段对Zn2+螯合率越高,其中分子质量≤1 000 u的CQSP对Zn2+螯合率达到83.26%,显著高于其他组分,这与O’Loughlin等[18]的研究结果相同。因此选择分子质量≤1 000 u的CQSP构建Zn2+螯合物进行深入研究。综上所述,选择碱性蛋白酶水解得到的CQSP,以及分子质量≤1 000 u的CQSP构建CQSP-Zn进行后续研究。
2.2 产物的结构表征
2.2.1氨基酸组成分析 经碱性蛋白酶水解得到的分子质量≤1 000 u木瓜籽肽的氨基酸组成见表2。

表2 CQSP和CQSP-Zn的氨基酸组成
由表可知,CQSP氨基酸含量丰富、种类全面,包含人体所需的全部必需氨基酸,营养价值高。其中,谷氨酸(21.88%)和天冬氨酸(10.46%)为主要氨基酸。根据Sun等的报道[13],富含谷氨酸和天冬氨酸的多肽往往具有较强的金属离子螯合能力,因此CQSP对Zn2+的螯合率高可能与其谷氨酸、天冬氨酸含量高有关。当CQSP对Zn2+产生螯合时,由于肽段上氨基酸的极性、亲水或疏水性及侧链基团的差异,对Zn2+的亲和能力会有所区别,Zn2+会与具有较强亲和能力氨基酸上氨基的N原子和羧基的O原子形成配位键。单位空间中的氨基酸与Zn2+配位后,氨基酸组成会发生变化。CQSP螯合Zn2+后的氨基酸组成见表2,CQSP-Zn的谷氨酸及天冬氨酸的量上升,分别由21.88%和10.46%上升至23.45%和12.37%,表明这两种氨基酸可能参与了对Zn2+的螯合。此外,CQSP-Zn中组氨酸、赖氨酸、精氨酸的量增加明显,这与之前的研究结果相似,配位肽中组氨酸、赖氨酸和精氨酸对金属离子的螯合具有重要作用[13,21]。


图1 CQSP和CQSP-Zn的红外光谱
2.2.3紫外光谱分析 多肽中的生色基团具有紫外吸光能力,当这些含有生色基团或助色基团的多肽作为配体与金属离子发生键合时,其构象发生变化,进而造成配体在光吸收时电子跃迁所需的能量有所差异,因此多肽及其金属离子螯合物的光学性能存在差异[13]。采用紫外光谱扫描的方法对CQSP及其Zn2+螯合物的特征吸收峰强度和位移进行分析,以确认是否发生了螯合反应,结果见图2。

图2 CQSP和CQSP-Zn的紫外吸收光谱

2.2.4荧光光谱分析 荧光光谱能有效反映蛋白或多肽与其他分子间的相互作用。蛋白质或多肽中含有的芳香型氨基酸,如酪氨酸及苯丙氨酸,在一定激发波长下可产生内源性荧光。对氨基酸组成的分析发现CQSP中含有酪氨酸(2.55%)和苯丙氨酸(4.40%),因此可通过观察荧光强度的变化,探究Zn2+与CQSP间的相互作用。图3为CQSP及加入不同量Zn2+后CQSP的荧光光谱,如图所示所有测试样品在350 nm附近出现最大吸收峰,这与Sun等[13]研究结果相似,可能是CQSP中芳香型氨基酸在280 nm激发波长下,于350 nm发射波长有最大吸收。随着Zn2+用量逐渐增加,CQSP的荧光强度呈逐渐降低趋势。Wu等[24]研究发现金属离子与多肽发生螯合时,金属离子可作用于多肽中的芳香型氨基酸,导致荧光强度改变。CQSP荧光强度的降低,表明Zn2+可能与CQSP发生螯合,形成了CQSP-Zn复合物,发生荧光猝灭。Beyer等[30]认为金属离子与多肽螯合时,可形成配位键造成氨基酸结构的折叠与聚集,最终引起内源性荧光猝灭,荧光强度降低。因此,可推断CQSP能与Zn2+间发生配合反应,形成CQSP-Zn螯合物。

图3 CQSP和CQSP-Zn的荧光光谱
2.3 pH值对锌离子溶解度的影响
溶解度是影响Zn2+在机体内有效性和生物利用度的关键因素,而体系的酸碱度对Zn2+溶解度有重要影响。人体胃、肠消化道的pH值存在明显差异,胃液的pH值一般为2.0,而肠液的pH值则偏弱碱性(7.0~8.0)。因此,研究了无机ZnSO4和CQSP-Zn在不同pH值(2.0~8.0)下Zn2+的溶解度,结果见图4。
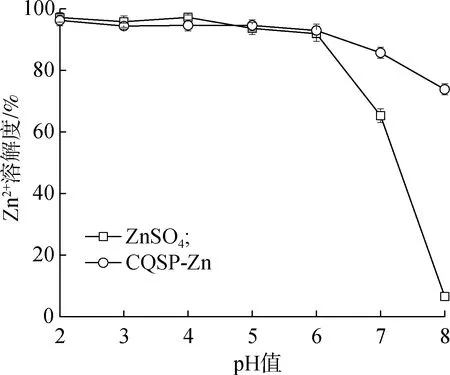
图4 pH值对Zn2+溶解度的影响
由图可知,当pH值为2.0~6.0时,ZnSO4和CQSP-Zn的Zn2+溶解度均较高,这与Eckert等[17]结果一致,表明Zn2+在酸性条件下能稳定存在,有利于其转移至吸收部位(小肠)。当pH值进一步上升至7.0~8.0时,ZnSO4和CQSP-Zn的Zn2+溶解度均出现显著降低,尤其是ZnSO4在pH值为8.0时溶解度降低至6.60%。这是由于Zn2+在弱碱性条件下可与OH-结合形成沉淀物,导致溶解度的下降[10]。然而,CQSP-Zn在弱碱性条件下的Zn2+溶解度显著(P<0.05)高于ZnSO4,当pH值为8时溶解度为73.85%,是ZnSO4的11.19倍。Wang等[22]报道了相似的结果,牦牛酪蛋白水解物-铁离子螯合物在碱性条件下具有较高的溶解度,这可能是多肽的螯合作用提高了金属离子的稳定性,避免锌的沉淀。由于Zn2+的吸收主要集中在小肠,pH值接近8.0,溶解度越高越有利于其吸收,因此CQSP-Zn可能具有更高的生物利用度。
2.4 体外消化模拟结果分析
除pH值外,胃肠道的消化环境包括各种蛋白酶和肽酶等,也会使口服锌补充剂中的Zn2+暴露,影响其溶解度和生物利用度。因此,进一步研究了ZnSO4和CQSP-Zn在模拟胃肠道消化过程中Zn2+的溶解度,结果见图5。由图可知,在模拟胃消化阶段(0~90 min),Zn2+溶解度维持在较高水平,这与2.3节的结果一致。然而进入模拟肠道消化阶段(95~245 min)后,ZnSO4和CQSP-Zn的Zn2+溶解度均出现显著下降(P<0.05),特别是ZnSO4的Zn2+溶解度在模拟肠道消化的第0 min时下降至16.24%,显著低于CQSP-Zn的65.86%。这可能是因为模拟肠液的pH值为弱碱性(7.5),ZnSO4中的Zn2+易形成沉淀物导致溶解度降低,而CQSP-Zn的稳定性相对更高,因此溶解度更高。值得注意的是在模拟肠道消化的第30 min,CQSP-Zn中Zn2+溶解度出现上升趋势,推测可能是胰蛋白酶进一步对分子质量≤1 000 u的CQSP发生了水解作用,产生了分子质量更低的小肽,这些小肽对Zn2+的螯合作用更强,因此提高了Zn2+的稳定性[31]。综上可知,CQSP-Zn中Zn2+的溶解度更高,增加了可溶性Zn2+的数量,有利于Zn2+穿过肠道黏膜,提高Zn2+的生物利用率,强化补锌功效。

图5 模拟胃肠道消化对Zn2+溶解度的影响Fig.5 Effect of simulated gastrointestinal digestion on the Zn2+ solubility
3 结 论
3.1以皱皮木瓜籽为原料,通过蛋白酶水解制备木瓜籽肽,经超滤获得5个不同分子质量范围的多肽组分,并制备CQSP-Zn螯合物,考察了蛋白酶种类和多肽分子质量对Zn2+螯合率的影响。结果表明:利用碱性蛋白酶水解木瓜籽分离蛋白,经超滤获得分子质量≤1 000 u的CQSP对Zn2+的螯合能力较强,螯合率可达83.26%。

3.3与无机ZnSO4相比,CQSP-Zn在pH值2.0~8.0范围以及模拟胃肠道消化各阶段中的溶解度更高,具有更好的稳定性,因此能提高Zn2+的生物利用度。本研究制备的CQSP-Zn极具作为高效Zn2+增补剂的应用前景。

