玉米低聚肽螯合铁(II)的制备和结构表征
张新雪,卢知浩,刘家生,刘 放,付少委,刘文颖,
(1.中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京 100015;2.广东中食营科生物科技有限公司,广东东莞 523122)
植物基食品原料绿色、环保、健康理念深入人心,以植物为基础的食品开发将成为食品行业的主流趋势[1]。玉米为我国主要的农作物,以其为原料的加工利用多针对玉米淀粉,玉米蛋白研究较少。研究发现,玉米蛋白含有较高比例的支链氨基酸,且玉米蛋白链的功能区可通过酶解技术被释放[2],具有较高的利用价值。玉米低聚肽是以玉米蛋白粉为原料,通过现代生物酶解技术制备的小分子短肽混合物[2],具有抗氧化[3]、降血压[4]、护肝[5]、解酒[5-7]等多种功能。相比于大分子蛋白,小分子肽类物质具有良好的体外消化稳定性。Wei等[8]、王憬等[9]以大豆肽、卵白肽、玉米肽、乳清肽、海洋骨原肽、海洋胶原肽、海洋蛋白肽7种食源性低聚肽为原料,通过体外模拟消化实验发现,95%以上的低聚肽未被胃蛋白酶消化,90%以上的低聚肽未被胰蛋白酶消化,因此低聚肽更容易被人体吸收和发挥其生理功能。
铁是人体必需的微量元素,作为血红蛋白的重要部分,影响人体生长发育和新陈代谢[10],铁缺乏会导致人体贫血,抵抗力下降,容易疲劳[11]。目前,铁补充剂主要通过无机铁盐(如FeSO4),但长期服用会引起肠胃不适,且稳定性差,生物利用率低[12]。有研究指出,以海洋鱼皮低聚肽、酪蛋白肽以及乳清蛋白肽为主要原料制备铁螯合物,具有作为新型食源性铁补充剂的潜力[13],但目前以玉米低聚肽为原料进行铁螯合物制备的研究较少。
本研究以玉米低聚肽和氯化亚铁为原料制备玉米低聚肽螯合铁(II),评价其氨基酸组成和相对分子质量,以得率和螯合率评价螯合效果,通过单因素实验、响应面中心组合设计和验证实验确定最佳工艺,通过液相-质谱联用仪(LC-MS)测定玉米低聚肽螯合铁(II)的氨基酸组成,并通过傅里叶变换红外光谱(FTIR)和扫描电镜(SEM)对玉米低聚肽螯合铁(II)的结构进行表征,以期为食源性肽铁补充剂的开发提供基础技术支持,为玉米低聚肽的高值化利用及植物基食品品质提升提供理论基础。
1 材料与方法
1.1 材料与仪器
玉米低聚肽 北京中食海氏生物技术有限公司提供;氯化亚铁、硫酸亚铁铵、邻二氮菲、抗坏血酸、无水乙醇、盐酸、氨水等化学试剂 均为分析纯,北京化学试剂公司;溴化钾(分析纯) 国药集团化学试剂有限公司;乙腈(色谱纯) 美国Fisher公司。
HH型数显恒温水浴锅 金坛区富华仪器有限公司;LRH-99-250型恒温箱 上海一恒科技有限公司;CD 4-2型离心机 北京医用离心机厂;SJ-3 F型pH计 上海精密仪器有限公司;SHZ-3型循环水多用真空泵 郑州朋来仪器有限公司;Pl403型天平梅特勒-托利多仪器公司;Nicolet 6700型傅立叶变换红外光谱仪 赛默飞世尔科技公司;LC-20A高效液相色谱仪 日本SHI-MADZU公司;A300全自动氨基酸分析仪 德国曼默博尔公司。
1.2 实验方法
1.2.1 玉米低聚肽螯合铁(II)的制备 准确称取一定量的玉米低聚肽粉,用蒸馏水溶解,制备成一定浓度的玉米低聚肽溶液,并加入抗氧化剂。根据后续不同实验参数条件,调节pH,按照一定的肽盐比(w/w)加入FeCl2,在恒温水浴振荡器中恒温螯合,反应结束后蒸发浓缩,醇沉(乙醇)得到粗螯合物。对粗螯合物进行抽滤、洗涤、干燥,制备得到玉米低聚肽螯合铁(II)。
1.2.2 玉米低聚肽螯合铁(II)螯合效果评价 采用宋莎莎等[14]的方法,利用分光光度法测定螯合前反应体系中铁的含量以及反应生成的玉米低聚肽螯合铁(II)中铁的含量。通过公式(1)和公式(2)测定铁的螯合率和玉米低聚肽螯合铁(II)的得率,以评价玉米低聚肽螯合铁(II)的螯合效果。
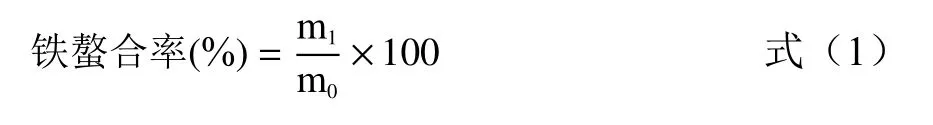
式中:m1为螯合物中铁的量,mg;m0为加入反应体系中铁的总量,mg。
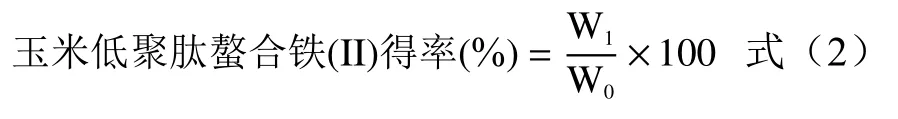
式中:W1为玉米低聚肽螯合铁(II)的总质量(II),mg;W0为玉米低聚肽与铁盐的总质量,mg。
1.2.3 玉米低聚肽螯合铁(II)制备工艺单因素实验采用单因素实验设计肽盐比、pH、螯合温度、螯合时间探究制备玉米低聚肽螯合铁(II)的最佳工艺,具体实验参数如下:
选用pH6.0,螯合温度为65 ℃,螯合时间为45 min,肽盐比为2:1、4:1、6:1、8:1和10:1,探究肽盐比对玉米低聚肽螯合铁(II)螯合效果的影响;
选用螯合温度为65 ℃,螯合时间为45 min,肽盐比为8:1,pH为4.0、5.0、6.0、7.0、8.0,探究pH对玉米低聚肽螯合铁(II)螯合效果的影响;
选用pH6.0,螯合时间为45 min,肽盐比为8:1,螯合温度为35、45、55、65、75 ℃,探究螯合温度对玉米低聚肽螯合铁(II)螯合效果的影响;
选用pH6.0,螯合温度为65 ℃,肽盐比为8:1,螯合时间为15、30、45、60 min,探究螯合时间对玉米低聚肽螯合铁(II)螯合效果的影响。
1.2.4 玉米低聚肽螯合铁(II)制备工艺响应面试验在单因素实验的基础上,以肽盐比、pH、螯合时间、螯合温度和为考察因素,采用Box-Benhnken中心组合设计4因素3水的响应面试验,以玉米低聚肽螯合铁(II)的得率和铁的螯合率为响应值,分析影响螯合效果各因素的交互作用,确定最佳工艺条件。中心组合实验水平如表1所示。
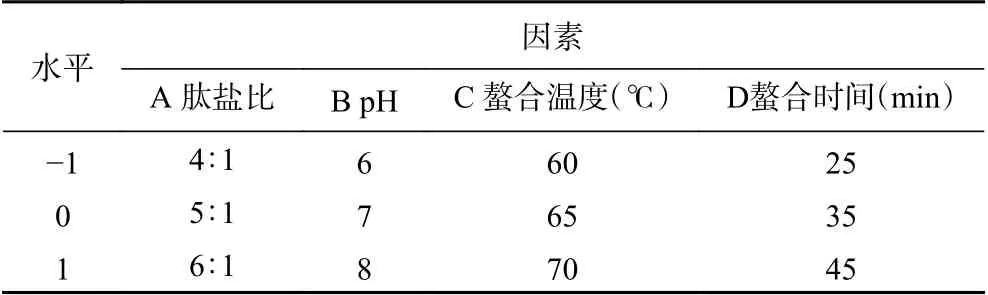
表1 中心组合实验水平表Table 1 Center combination experiment level
1.2.5 玉米低聚肽螯合铁(II)的氨基酸组成分析利用全自动氨基酸分析仪,参考GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》方法,对玉米低聚肽螯合铁(II)的水解氨基酸和游离氨基酸组成进行分析[15]。
1.2.6 玉米低聚肽螯合铁(II)相对分子质量分布测定配制玉米低聚肽螯合铁(II)溶液的质量浓度为1 mg/mL,经过0.2 μm聚四氟乙烯膜过滤,使用高效液相色谱仪测定样品分子量。同时,分别配制0.1%乙氨酸-乙氨酸-乙氨酸(分子质量189 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451 u)、杆菌酶(分子质量1450 u)、细胞色素C(分子质量12500 u)4种肽标准品溶液,经过0.2 μm聚四氟乙烯膜过滤后进样,制作校正曲线。色谱条件:色谱柱:TSKgel G2000 SWXL 300 mm×7.8 mm;流动相:V乙腈:V水:V三氟乙酸=45:55:0.1;流速:0.5 mL/min;检测波长:220 nm;柱温:30 ℃[16]。
1.2.7 玉米低聚肽及玉米低聚肽螯合铁(II)的FTIR表征 利用傅里叶变换红外光谱对玉米低聚肽及玉米低聚肽铁(II)进行结构表征。具体为:准确称取5 mg玉米低聚肽螯合铁于玛瑙研钵中,在其中加入500 mg KBr。打开红外灯,在干燥环境下研磨并混合均匀,将均匀粉末置于模具中压片处理,获得均匀透明样品后采用傅里叶变换红外光谱仪扫描,扫描范围为4000~500 cm-1,分辨率为4 cm-1,扫描次数为32次。
1.2.8 玉米低聚肽及玉米低聚肽螯合铁(II)的微观形貌表征 采用SEM对玉米低聚肽及玉米低聚肽螯合铁(II)的微观形貌进行表征。具体为:取适量玉米低聚肽和玉米低聚肽螯合铁(II)分别均匀涂抹于样盘,喷金镀膜处理,加压3 kV,于电镜下捕捉500×倍的均匀清晰图像。
1.3 数据处理
采用Design Expert 12进行响应面分析,采用SPSS 18.0统计分析软件进行方差分析,采用Origin 2019软件绘制图像。
2 结果与分析
2.1 玉米低聚肽螯合铁(II)制备工艺单因素实验结果
2.1.1 肽盐比对螯合效果的影响 玉米低聚肽螯合铁(II)的制备是以玉米低聚肽和FeCl2的螯合反应为基础,因此反应底物的相对含量是影响螯合效果的重要因素。选用5组不同肽盐质量比研究螯合效果,结果如图1所示。由图1a可知,随着肽盐质量比的增加,玉米低聚肽螯合铁(II)的得率呈现先增长后下降的趋势,在肽盐质量比为4:1时得率呈现最大值,为45.30%。铁的螯合率取决于反应体系中肽反应基团的含量以及FeCl2和肽的反应程度。当肽盐质量比较低时,过量的FeCl2无法充分与玉米低聚肽螯合,螯合率均较低,螯合效果差且所得螯合物不稳定。随着玉米低聚肽含量的增加,FeCl2和肽的反应更充分,螯合率上升。但玉米低聚肽含量继续增加,肽与肽之间会发生相互反应,从而影响肽与FeCl2的反应,又会导致螯合率的下降,同时造成得率降低,大量玉米低聚肽的浪费,成本提高[17];由图1b可知,铁的螯合率最高时肽盐质量比为4:1和6:1。综合得率和螯合率结果,后续优化试验中选择肽盐质量比为4:1~6:1,这与宋莎莎等[14]结果相似。
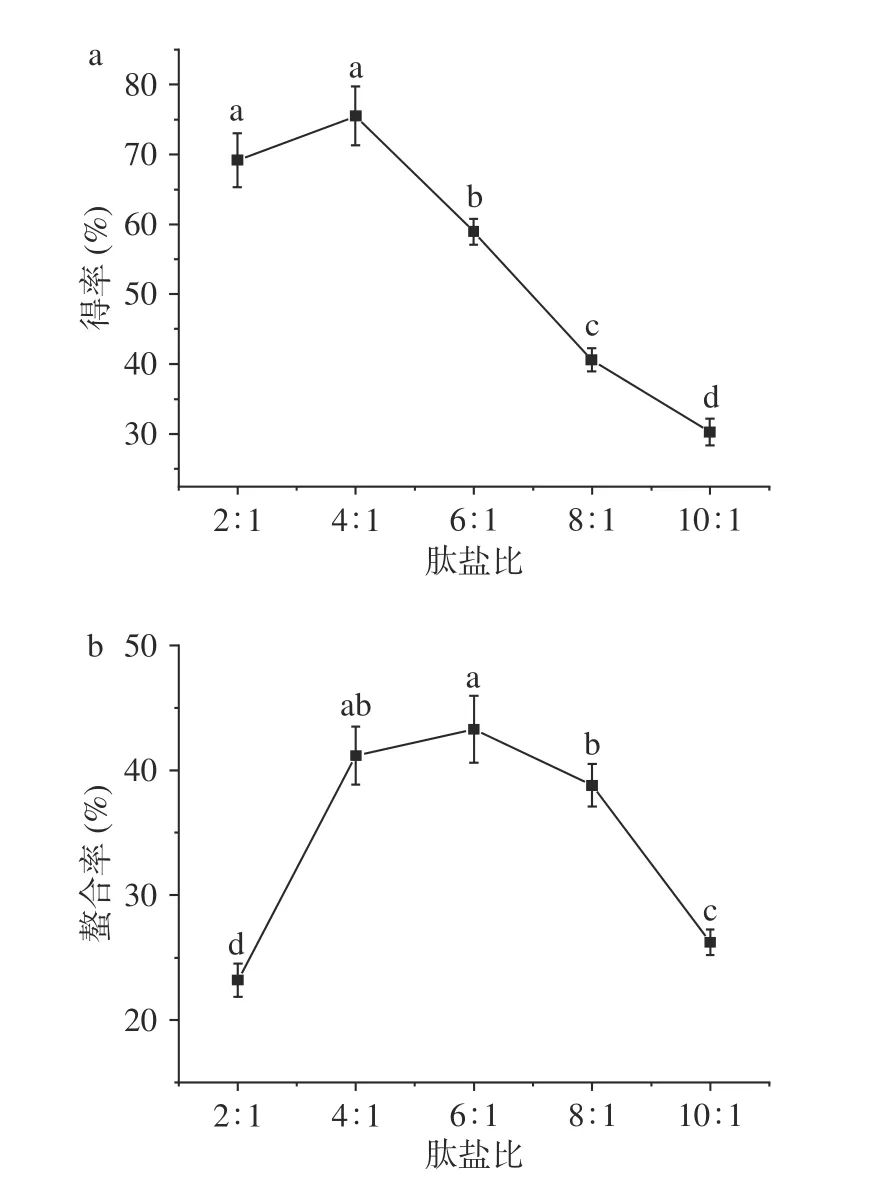
图1 肽盐比对螯合效果的影响Fig.1 Effect of peptide-salt ratio on the chelating effect
2.1.2 pH对螯合效果的影响 选用pH4.0~8.0来探究其对螯合效果的影响,结果如图2所示。随着pH的提高,玉米低聚肽螯合铁(II)的得率呈现先上升后下降的趋势,当pH为7.0时,得率最大为46.11%;而铁的螯合率呈现逐渐上升趋势,当pH为8.0时,螯合率最大为57.82%,但此时的螯合率和pH为7.0时(56.58%)的螯合率无显著差异(P>0.05)。研究发现,在酸性环境中,过量的H+会与Fe2+争夺电子基团;而在碱性环境中,OH-会与Fe2+生成氢氧化物沉淀,影响螯合效果。因此,一般中性环境中螯合效果最优。但当大量多肽处于等电点附近时,其螯合效果受H+和OH-影响较小,供电子基团可以充分与金属离子通过配位键形成螯合物[18-19]。这与宋莎莎等[14]制备乌鸡肽铁(II)螯合物所选择的pH6结果不同,说明在玉米低聚肽螯合铁的制备工艺在中性环境螯合效果更好。
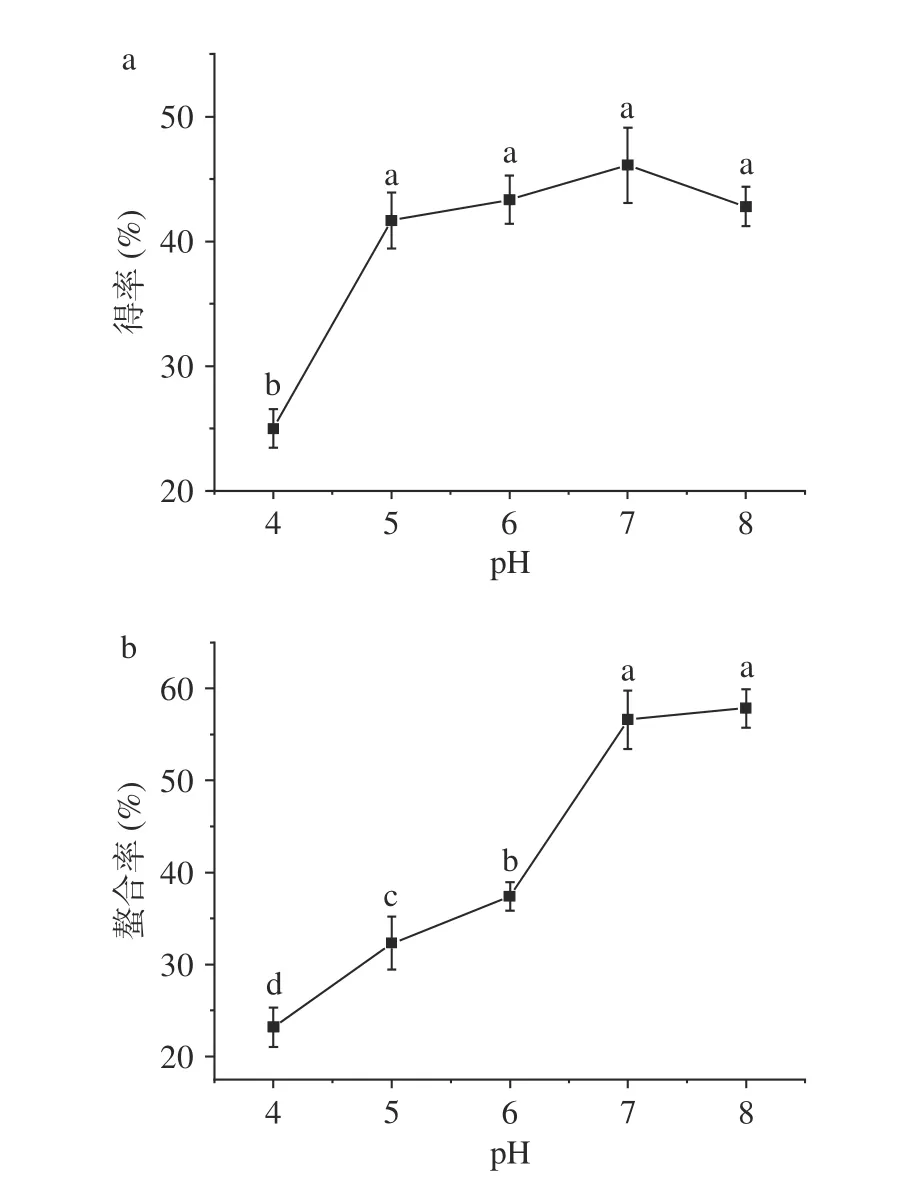
图2 pH对螯合效果的影响Fig.2 Effect of pH on the chelating effect
2.1.3 螯合温度对螯合效果的影响 螯合温度不仅影响反应速率,也是影响螯合效果的重要因素之一。如图3所示,随着螯合温度的提升,得率和螯合率均整体上呈现先上升后下降的趋势,当螯合时间为65 ℃时,得率和螯合率取得最大值,为55.28%和54.98%。玉米低聚肽与FeCl2的螯合反应是吸热反应,随着温度的提高,玉米低聚肽的溶解度逐渐增强,Fe2+与肽基团的接触面积增大,螯合反应更彻底,得率和螯合率提高。但是,温度继续升高,会导致玉米低聚肽之间发生副反应,与Fe2+形成竞争,且螯合物在高温下不稳定,极易分解,影响螯合效果,导致得率和螯合率下降[20]。
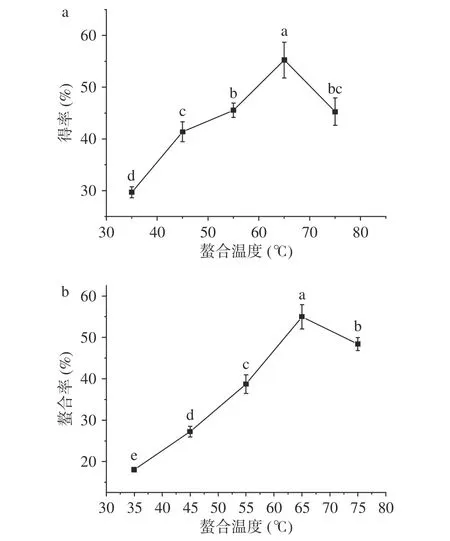
图3 螯合温度对螯合效果的影响Fig.3 Effect of chelatng temperature on the chelating effect
2.1.4 螯合时间对螯合效果的影响 螯合时间是影响螯合反应的重要因素之一,选择螯合时间为15~60 min,探究其对螯合效果的影响,结果如图4所示。结果显示,螯合时间为15~30 min时,得率呈现上升趋势。螯合反应达到30、45 min时,得率均达到50%,螯合时间为60 min时,螯合率略有下降。而铁的螯合率整体呈现先上升后下降的趋势,当反应时间为30 min时,螯合率达到最大值51.88%。这是因为当反应时间过短时,螯合反应不彻底,反应体系中存在大量游离的Fe2+和玉米低聚肽配体,原料利用率低下;反应时间过长,螯合反应发生解离作用,且可能产生副产物,得率和螯合率过低,螯合效果差。综合考虑得率和螯合率结果,选择25~45 min进行后续优化试验。
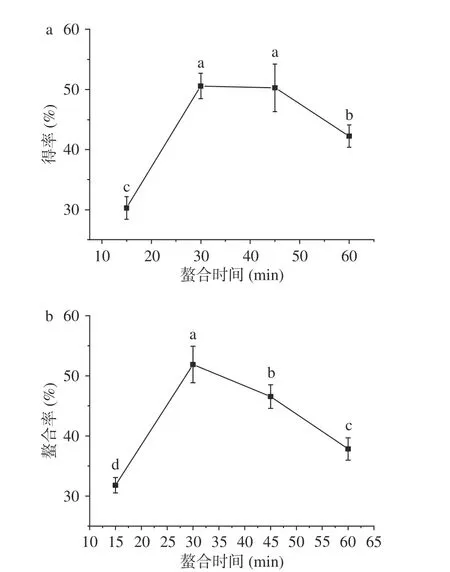
图4 螯合时间对螯合效果的影响Fig.4 Effect of chelating time on the chelating effect
2.2 响应面设计试验结果及分析
根据单因素实验的结果,设计肽盐比、pH、螯合温度和螯合时间4因素3水平响应面试验探究各影响因素对螯合效果的交互影响,所得结果如表2所示。采用Design Expert 8.0.6软件拟合回归多项参数,得到玉米低聚肽螯合铁(II)得率(f(x))及螯合率(g(x))对肽盐比(A)、pH(B)、螯合温度(C)、螯合时间(D)的二次多项回归模型方程分别为:


表2 响应面试验设计及结果Table 2 Response surface experimental design and results
对回归模型进行方差分析,结果如表3和表4所示。结果表明,两个模型的回归项显著(P<0.05),且失拟项均为不显著(P>0.05),说明模型拟合程度较好,可用于对响应值的预测和分析。表3中结果显示,二次项A2、C2、D2均对玉米低聚肽螯合铁(II)得率有极显著性影响(P<0.01),而二次项B2对玉米低聚肽螯合铁(II)得率有显著影响(P<0.05),其他项对得率无显著影响。综合F值结果,可得各因素对玉米低聚肽螯合铁(II)得率影响主次顺序为:C(螯合温度)>D(螯合时间)>A(肽盐比)>B(pH)。表4结果显示,二次项A2、B2、C2、D2均对铁螯合率有极显著性影响(P<0.01),综合F值结果,可得各因素对铁螯合率的影响主次顺序为:D(螯合时间)>B(pH)>C(螯合温度)>A(肽盐比)。

表3 以玉米低聚肽螯合铁(II)得率为响应指标的回归模型方差分析Table 3 Variance analysis of the regression model with the yield of corn oligopeptide chelated iron (II) as the response index
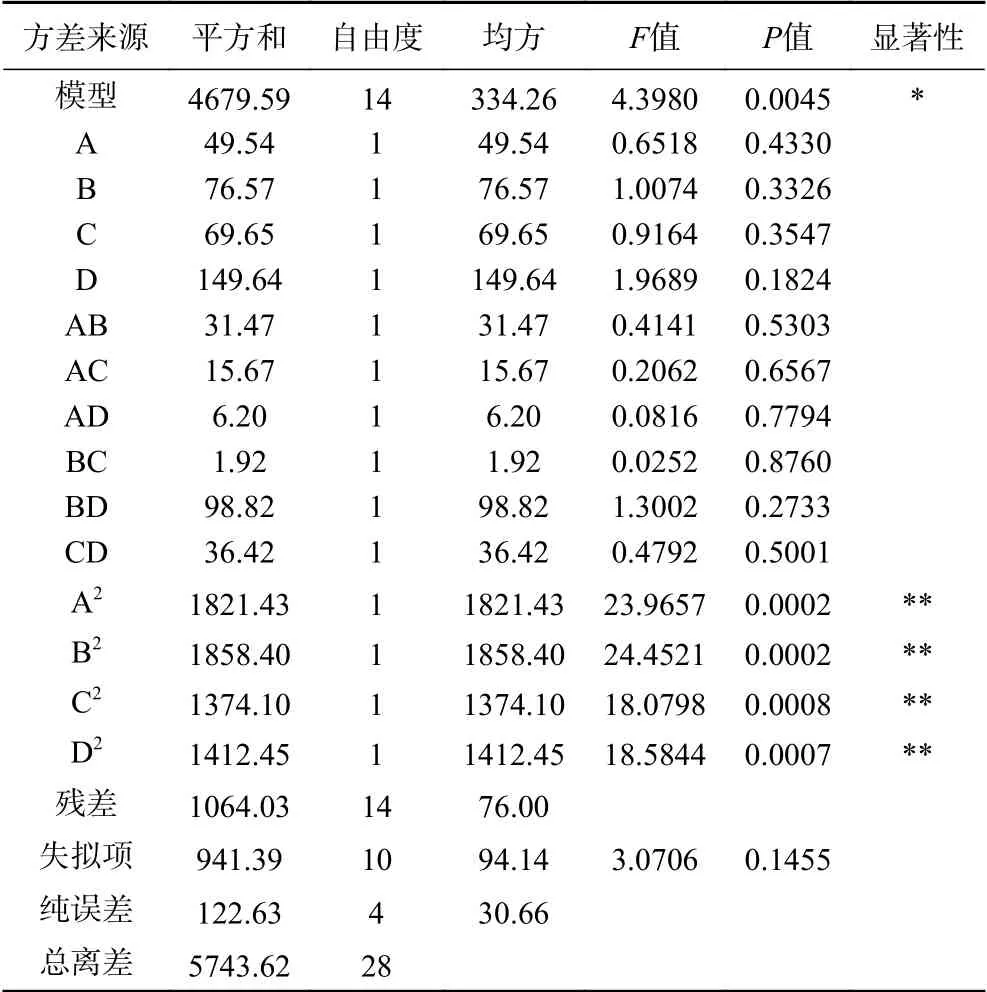
表4 以铁螯合率为响应指标的回归模型方差分析Table 4 Analysis of variance of the regression model with iron chelation as the response index
根据实验结果和回归模型,利用Design Expert 8.0.6软件绘制肽盐比、pH、螯合温度和螯合时间4因素对螯合效果影响的响应面图,结果如图5所示,响应面坡度和颜色的变化能反映各因素交互作用对结果影响的显著性。结果表明,肽盐比和pH、肽盐比和螯合温度、肽盐比和螯合时间、螯合温度和螯合时间的交互作用对玉米低聚肽螯合铁(II)的得率影响较小,而对铁螯合率影响较大。在肽盐比相同的情况下,pH是玉米低聚肽螯合铁得率最主要的影响因素,这说明螯合反应过程中,螯合体系中的H+、OH-以及等电点的因素会较大程度上影响Fe2+与肽的螯合反应[16-17];在肽盐比相同的情况下,螯合温度是铁(II)螯合率最主要的影响因素,这说明对于螯合反应(吸热)而言,高温下存在的副反应,且螯合物不稳定,极易分解[20]。
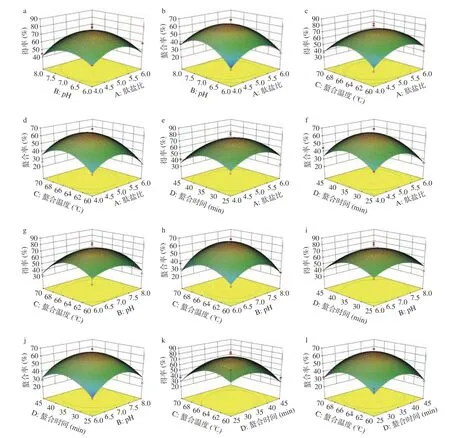
图5 各因素交互作用对螯合效果影响的响应面图Fig.5 Response surface diagram of the interaction of various factors on the effect of chelation
综上分析,利用Design Expert 8.0.6软件得出玉米低聚肽螯合铁(II)得率(48.80%)最高的工艺参数为:肽盐比为5.05:1,pH6.93,螯合时间为33.77 min,螯合温度为64.21 ℃;铁螯合率最高(52.86%)的工艺参数为肽盐比为4.99:1,pH7.02,螯合时间为35.10 min,螯合温度为64.89 ℃。根据螯合效果的最优参数和实际制备的可操作性,确定玉米低聚肽螯合铁(II)的制备工艺为肽盐比5.0:1,pH7.0,螯合时间35 min,螯合温度65 ℃。
2.3 工艺验证
通过响应面的回归模型得到玉米低聚肽螯合铁(II)的最佳工艺条件为为肽盐比5.0:1,pH7.0,螯合时间35 min,螯合温度65 ℃。此条件下模型理论值得率为48.64%,螯合率为52.16%,通过验证试验,可知在此条件下玉米低聚肽螯合铁(II)的得率为46.59%±1.69%,铁的螯合率为51.75%±2.10%,与理论值差异较小,该模型得到的优化参数准确性较高。
2.4 玉米低聚肽螯合铁(II)氨基酸组成
对以上最优工艺下制备的玉米低聚肽螯合铁(II)进行氨基酸组成分析,结果如表5所示。玉米低聚肽螯合铁(II)中谷氨酸(Glu)、天冬氨酸(Asp)、脯氨酸(Pro)、丙氨酸(Ala)含量较高,总量达到了14.86 g/100 g,甲硫氨酸(Met)和缬氨酸(Val)含量最低,含量分别是0.530和0.673 g/100 g。在这些氨基酸中,必需氨基酸含量占氨基酸总和的25.58%,说明玉米低聚肽螯合铁(II)必需氨基酸含量较为丰富,营养价值较高。此外,谷氨酸(Glu)和天冬氨酸(Asp)含量较高,这有助于玉米低聚肽螯合铁(II)呈现良好风味,在食品工业广泛应用[21]。
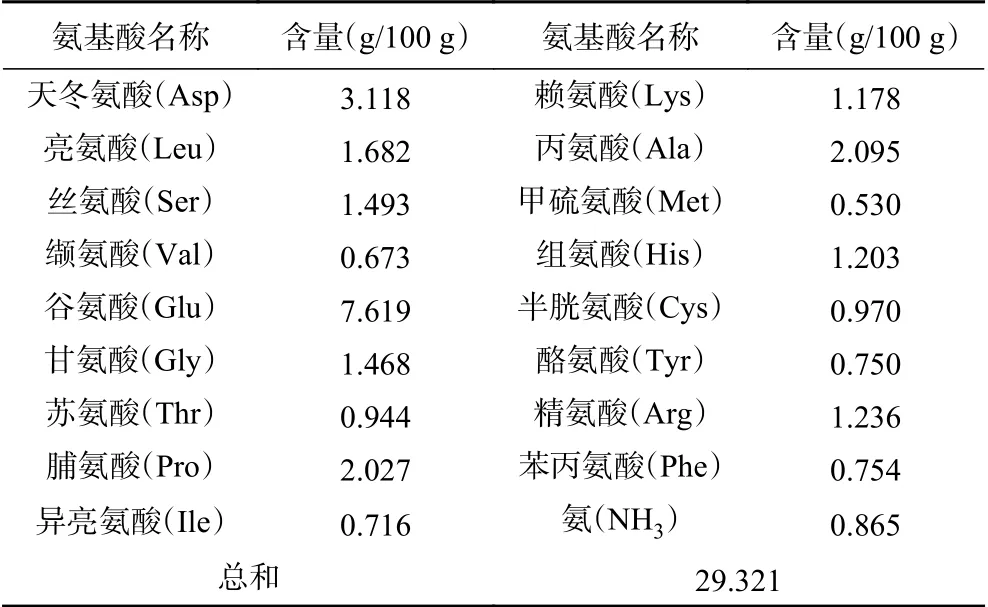
表5 玉米低聚肽螯合铁(II)氨基酸组成Table 5 Amino acid composition of iron (II)-chelating corn oligopeptides
2.5 玉米低聚肽螯合铁(II)相对分子质量分布
采用HPLC对玉米低聚肽螯合铁(II)相对分子质量分布进行了测定,结果如表6所示。在R2为0.9979,标准曲线方程为lg MW=-0.2142t+6.8866(MW为相对分子量,t为时间)的条件下,玉米低聚肽螯合铁(II)中多为小分子肽混合物,且相对分子质量小于1000 u的水解物占比高达89.77%。相对分子质量分布于1000~2000 u和2000~3000 u的水解物占比分别为8.22%和1.09%,而相对分子质量高于3000 u的水解物占比为0.93%。研究发现,玉米低聚肽的相对分子质量分布在150~1000的比例达到90%以上,其水解物多为小分子肽混合物[22]。这说明玉米低聚肽螯合铁(II)相对分子质量分布和玉米低聚肽相似。
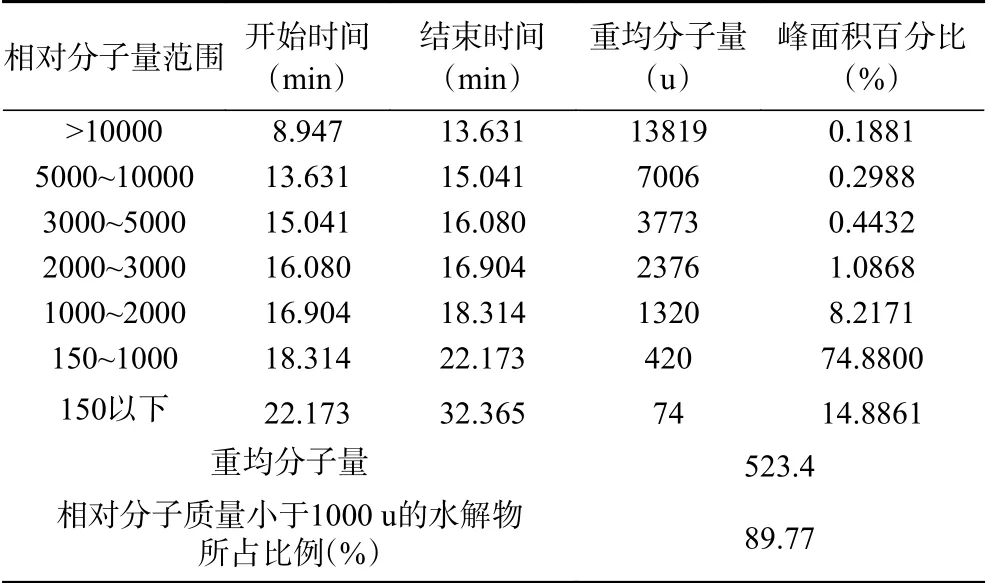
表6 玉米低聚肽螯合铁(II)相对分子量分布Table 6 Molecular weight distribution of iron (II)-chelating corn oligopeptides
2.6 玉米低聚肽螯合铁(II)结构表征
2.6.1 玉米低聚肽及玉米低聚肽螯合铁(II)的FTIR结果分析 采用FTIR对玉米低聚肽及玉米低聚肽螯合铁(II)的结构进行表征,结果如图6所示。由结果可知,玉米低聚肽螯合前后的FTIR图发生了明显变化,尤其在1000~1650 cm-1波段。在玉米低聚肽的FTIR图中,3276 cm-1处(酰胺A带)出现了N—H伸缩振动引起的宽吸收峰[23],1640 cm-1处(酰胺I带)出现了C=O伸缩振动引起的吸收峰[24-25],1529 cm-1处(酰胺II带)出现了N—H弯曲振动和C-N伸缩振动引起的吸收峰[26],1394 cm-1处出现了氨基酸残基侧链基团—COO—伸缩振动引起的吸收峰,1246 cm-1处出现了C—O单键伸缩振动引起的吸收峰,表明玉米低聚肽中含有—COOH结构[27],1044 cm-1处出现了NH2吸收峰[28]。而在玉米低聚肽螯合铁(II)的FTIR图中,也在3276 cm-1处(酰胺A带)出现了N—H伸缩振动的吸收峰,1608 cm-1处出现了C=O伸缩振动引起的吸收峰,但相比螯合前发生了蓝移,且未出现玉米低聚肽在1529 cm-1处出现的N—H弯曲振动和C—N伸缩振动引起的吸收峰,这说明肽中的N原子是铁螯合反应的配位原子[28];1394、1044 cm-1处的吸收峰发生了蓝移,且1246 cm-1处吸收峰的强度明显减弱,这说明肽中的—COOH也是发生螯合反应的主要部位[29]。周名洋等[30]通过钙螯合鹅骨胶原蛋白制备鹅骨胶原蛋白钙螯合肽,探究螯合机理发现螯合反应主要发生在氨基酸的羧基和氨基上,王孟丽等[31]总结了肽金属离子螯合物的螯合机理指出,肽与金属离子的螯合位点是肽的羧基、氨基和肽键,这与本实验研究结果一致,说明铁主要通过与玉米低聚肽末端羧基或氨基中的氮原子、氧原子形成配位键,从而形成螯合物。
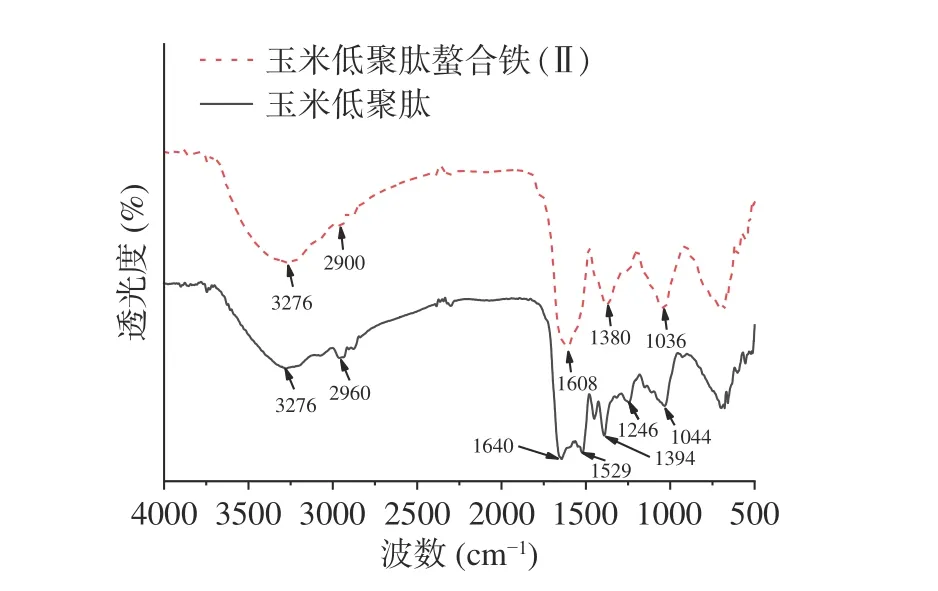
图6 玉米低聚肽及玉米低聚肽螯合铁(II)傅里叶变换红外光谱图Fig.6 FTIR of corn oligopeptides and iron (II)-chelating corn oligopeptides
2.6.2 玉米低聚肽及玉米低聚肽螯合铁(II)的SEM结果分析 采用SEM对玉米低聚肽及玉米低聚肽螯合铁(II)的微观形貌进行表征,结果如图7所示。玉米低聚肽表面粗糙,存在明显的圆球状和球状破裂体的形貌,圆球形物体表面凹凸不平,可能与真空干燥过程中的失水有关[20],球状破裂体的表面光滑。而玉米低聚肽螯合铁(II)的形貌与螯合前相差较大,其结构中无圆球状结构存在,微观形貌更为疏松。通过铁螯合后,玉米低聚肽螯合铁的微观形貌中存在聚集体,这可能是由于铁在螯合过程中破坏了玉米低聚肽的微观结构,通过离子键和配位键生成了玉米低聚肽螯合铁小颗粒[32-33],且玉米低聚肽螯合铁的SEM图中可发现冰晶状物质存在,这可能是吸附在玉米低聚肽上的铁晶体[20]。

图7 玉米低聚肽(A)及玉米低聚肽螯合铁(B)扫描电镜图Fig.7 SEM of corn oligopeptides (A) and iron (II)-chelating corn oligopeptides (B)
3 结论
本研究利用玉米低聚肽与氯化亚铁螯合制备玉米低聚肽螯合铁(II),综合考虑得率和螯合率确定最佳制备工艺为:肽盐比5:1,pH7.0,螯合时间35 min,螯合温度65 ℃,得到的玉米低聚肽螯合铁(II)得率为46.59%±1.69%,铁(II)的螯合率为51.75%±2.10%。玉米低聚肽螯合铁(II)中必需氨基酸含量占氨基酸总和的25.58%,富含谷氨酸(7.619 g/100 g)和天冬氨酸(3.118 g/100 g)。且其相对分子质量小于1000 u的水解物占比高达89.77%。进一步,对玉米低聚肽及玉米低聚肽螯合铁(II)进行傅里叶变换红外光谱扫描和扫描电镜表征,结果表明玉米低聚肽与铁主要通过肽末端羧基或氨基中的氮原子、氧原子形成配位键,进而形成稳定的环状结构,两者微观形貌存在明显差异,属于不同的物质,证明玉米低聚肽螯合铁(II)的成功制备。关于肽螯合铁的研究可进一步探究其安全性,为金属离子螯合肽的制备和表征提供技术支持,拓展铁补充剂的来源,为其在食品、医药行业的应用奠定基础。

