基于Golden Gate高效构建psiCHECK双荧光素酶报告基因的方法及应用
杜雅婷 于文君 李 燕 付元磊 孙考祥
1. 烟台大学药学院, 山东 烟台 264000; 2. 烟台药物研究所, 山东 烟台 264000;3. 烟台新药创制山东省实验室,中科环渤海(烟台)药物高等研究院, 山东 烟台 264000
双荧光素酶报告基因检测系统是指细胞内同时转入2种荧光素酶基因,分别作为内参基因和报告基因,通过对不同底物的氧化作用,使2种荧光素酶产生互不干扰的可量化荧光信号进行检测[1]。因其高效、灵敏和易定量等特点,已被广泛应用于基因表达和药物筛选研究[2-5]。psiCHECK-2载体是Promega公司近年来开发的一种双荧光素酶报告基因表达载体,以海肾荧光素酶基因为主要报告基因,以萤火虫荧光素酶基因为内参基因,用于监测与报告基因融合的目的基因表达变化。使用psiCHECK-2载体验证哺乳动物细胞系中RNA干扰(RNAinterference, RNAi)与靶基因的相互作用,在RNAi药物的筛选与开发领域获得广泛应用[6-10]。
由于psiCHECK-2载体中可用酶切位点少,使用传统方法将目的基因克隆至psiCHECK-2载体中步骤繁琐且连接效率较低。而Golden Gate是一种高效且高通量的新型分子克隆策略,主要依赖于IIS型限制性核酸内切酶(BsaI、BsmbI等),无论在阳性率、反应时间、实验效率、操作难度还是在实验成本上都要优于传统酶切连接手段[11]。IIS型限制性核酸内切酶通过识别目标序列,在识别序列外部切割产生粘性末端,在正确设计切割位点的情况下,用IIS型限制性内切酶可实现2个片段甚至多个片段同时连接成没有原始限制位点的产物,因此在连接处不会产生序列突变[12]。
当内切酶的切割效率较低时,psiCHECK-2载体存在假阳性的问题。目前已有一些方法可以提高阳性率,例如蓝/白斑筛选,通过破坏报告基因(或其启动子)筛选出不具有该报告基因表型的克隆[13],这种方法所有的载体都可以转化到宿主细胞中,并产生表现出报告基因表型的克隆,可能会导致非重组克隆的高背景。因此,针对这一问题开发了几种对宿主细胞致毒的基因,用于提高连接效率[14-16],其中利用CcdB致死基因对重组克隆进行阳性筛选具有显著优势,几乎不产生背景克隆。
CcdB基因是大肠杆菌F质粒的毒素-抗毒素系统的一部分,该系统可用于控制细胞死亡[17]。Ccd(control of cell division or death)系统编码生成一种靶向DNA促旋酶的A亚单位基因的CcdB毒素,毒化细菌促旋酶-DNA复合体,致使DNA双链发生断裂[18-19]。鉴于该系统在克隆方面的潜力,包含CcdB致死基因的系统已被构建,作为筛选的克隆载体进行运用[20-21]。含CcdB基因的载体能够在突变的大肠杆菌中保存(如大肠杆菌DB3.1);没有切开或者自身环化的含ccdB基因空质粒转化后,普通大肠杆菌(DNA促旋酶未发生突变或不含F质粒,如大肠杆菌DH5α)不能生长;当外源DNA成功插入载体的CcdB基因中,CcdB基因阅读框被打断,不再产生毒素蛋白,转化后大肠杆菌能够正常繁殖。因此,若利用CccdB基因作为克隆载体的筛选标记,有望降低非重组质粒的菌落数,使克隆的筛选过程更加高效。
本研究将具有筛选机制的氯霉素基因、CcdB致死基因以及IIS型限制性内切酶BsmBI酶切位点的扩增片段插入至Promega公司的psiCHECK-2载体中,探索该克隆方法的效果。
1 材料与方法
1.1 载体、菌株、细胞与试剂
含前蛋白转化酶枯草溶菌素(proprotein convertase subtillisin/kexin type 9, PCSK9)基因片段的质粒pPCSK9购自南京金斯瑞生物科技有限公司,psiCHECK-2质粒购自普洛麦格(北京)生物技术有限公司,含有CcdB致死基因的质粒pZ11、F2 siRNA、F3 siRNA、F16 小干扰RNA(small interfering RNA,siRNA)及无序siRNA委托生工生物工程(上海)股份有限公司合成。大肠杆菌DH5α感受态细胞购自天根生化科技(北京)有限公司,大肠杆菌DB3.1感受态细胞购自北京博迈德基因技术有限公司。HEK293T细胞株购自美国ATCC细胞库。Phanta Super-Fidelity DNA Polymerase、2*Taq Master Mix(Dye Plus)购自南京诺唯赞生物科技股份有限公司,LipofectamineTM2000购自Invitrogen公司,DMEM培养基、新生胎牛血清、胰酶自GIBCO公司,FuniCut™XhoI、FuniCut™ NotI、DNA Marker、辉光型双荧光素酶报告基因检测试剂盒购自翌圣生物科技(上海)股份有限公司,BsmBI-v2购自英国New England Biolabs,快速DNA连接试剂盒及LB培养基购自上海碧云天生物技术有限公司,琼脂糖凝胶DNA回收试剂盒(增强型)购自天根生化科技(北京)有限公司,小量质粒DNA一步磁珠法提取试剂盒购自长春市志昂生物科技有限公司,引物合成及基因测序由生工生物工程(上海)股份有限公司完成。
1.2 主要仪器
ChemiDoc MP型凝胶成像分析系统、T100型PCR扩增仪、PowerPac Basic型电泳仪,伯乐生命医学产品有限公司;SpectraMax M2型酶标仪,美国分子仪器(上海)有限公司;3111型二氧化碳培养箱,美国赛默飞世尔有限公司;IS-RSV1型振荡培养箱,美国精骐仪器有限公司。
1.3 BsmBI酶切位点、氯霉素基因与CcdB基因的扩增
使用表1中的引物CcdB-CM-F和CcdB-CM-R,以含CcdB基因的质粒pZ11为模板,使用Phanta Super-Fidelity DNA Polymerase酶,进行基因扩增。按照以下程序进行聚合酶链反应(polymerase chain reaction,PCR)扩增:预变性95 ℃ 3 min,变性95 ℃ 10 s,退火55 ℃ 30 s,延伸72 ℃ 45 s,30个循环,终末延伸72 ℃ 5 min。用1%琼脂糖凝胶电泳检测PCR产物,并回收。
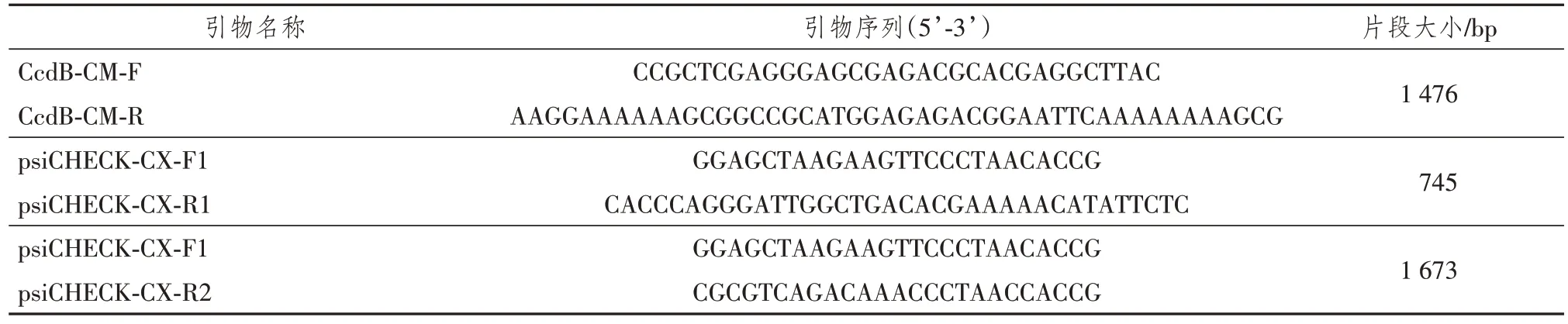
表1 引物序列及片段大小
1.4 载体psiCHECK-CcdB的构建
分别取75 ng的质粒psiCHECK-2和53 ngCcdB的PCR产物回收片段,加入0.5 μL FuniCut™ XhoI、0.5 μL FuniCut™ NotI以及5 μL 2 × T4 缓冲液后,37 ℃酶切30 min。酶切结束后,降温至4 ℃,向体系中加入0.5 μL Rapi-d T4 DNA Ligase,混匀,16 ℃连接30 min。连接结束后,取10 μL连接产物加入至100 μL大肠杆菌DB3.1感受态细胞中,冰浴30 min,42 ℃ 热激90 s,冰浴3 min,加入900 μL LB液体培养基,37 ℃ 200 r/min震荡培养1 h,涂布含氯霉素抗性的LB固体平皿,37 ℃过夜培养。从转化平板中挑取单克隆菌落,使用psiCHECK-CX-F1、psiCHECK-CX-R1引物进行菌落PCR鉴定,将阳性菌落提质粒后送样测序,命名正确的重组质粒为psiCHECK-CcdB。
1.5 psiCHECK-CcdB致死检测及外源片段连接验证
选用大肠杆菌DH5α和DB3.1感受态细胞,用psiCHECK-CcdB质粒分别转化二者,转化产物涂布含氯霉素抗性的LB平板上过夜培养,隔天观察平板上的菌落生长情况,检测致死效果。
为确定psiCHECK-CcdB载体的连接效率,分别取100 ng psiCHECK-CcdB载体与100 ng含PCSK9基因的质粒(PCSK9基因片段大小1 387 bp),加入10 μL T4连接酶缓冲液与1 μL限制性酶切酶BsmBI-v2,反应体系补水至20 μL,55 ℃酶切20 min,降温至4 ℃,加入Rapid T4 DNA Ligase 1 μL,混匀,16 ℃连接30 min。反应结束后,将10 μL组装产物转化至100 μL大肠杆菌DH5α感受态细胞后涂板过夜培养。从转化平板中挑取单克隆菌落,使用psiCHECK-CX-F1、psiCHECK-CX-R2引物进行菌落PCR鉴定,将阳性菌落提质粒后送样测序,命名正确的重组质粒为psiCHECK-PCSK9。
1.6 psiCHECK-PCSK9载体荧光素酶活性的测定
针对插入psiCHECK-CcdB的目的基因PCSK9设计了3条siRNA:F2、F3及F16,并设计了一个无序siRNA作为阴性对照,序列信息见表2。将HEK293T细胞以 1 × 104个/孔接种于96孔板上,37 ℃培养16 h后,使用Lipofectamine 2000转染试剂将80 ng的psiCHECK-PCSK9载体分别与4 nmol/L的siRNA F2、siRNA F3、siRNA F16以及阴性对照无序siRNA共转染细胞,孵育4 h后补加含血清的DMEM培养基继续培养。转染24 h后,使用辉光型双荧光素酶报告基因检测试剂盒检测荧光素酶活性,以萤火虫荧光素酶为内参,以载体psiCHECKPCSK9 + 无序siRNA的表达为对照(100%),观察siRNA F2、F3及F16对PCSK9基因表达的影响,实验重复3次。

表2 siRNA序列信息
1.7 统计学方法
采用Prism 9软件进行数据分析。荧光素酶报告实验采用独立样本t检验,检验水准α= 0.05。
2 结果与分析
2.1 重组质粒psiCHECK-CcdB的鉴定与分析
载体psiCHECK-CcdB的构建示意图如图1所示,将目的基因插入至海肾荧光素酶基因编码区与3'末端多聚A尾之间的多克隆位点处。含BsmBI酶切位点的CcdB基因的高保真PCR扩增片段电泳检测结果如图2所示,与预期片段大小一致。将PCR片段纯化回收后与psiCHECK-2载体共同进行双酶切、连接,连接产物转化至大肠杆菌DB3.1中。采用siCHECK-CX-F1和siCHECK-CX-R1引物进行菌落PCR检测,结果如图3所示,挑取的单菌落均为阳性。从其中随机选择3个菌落进行测序,测序结果如图4所示,在psiCHECK-2的XhoI和NotI位点之间,BsmBI酶切位点及CcdB基因均准确插入。

图1 psiCHECK-CcdB载体构建示意图

图2 含BsmBI酶切位点的CcdB基因的PCR产物电泳检测

图3 重组质粒psiCHECK-CcdB的PCR验证

图4 重组质粒psiCHECK-CcdB的测序结果
2.2 重组质粒psiCHECK-CcdB的致死效率检测
选用大肠杆菌DH5α和DB3.1,将psiCHECKCcdB质粒分别转化二者。培养一段时间后大肠杆菌的生长情况如图5所示,质粒转化至大肠杆菌DB3.1的LB平板上有大量的菌落生长,而转化至大肠杆菌DH5α的LB平板上无任何菌落生长。说明对于不耐受CcdB毒素的大肠杆菌DH5α,psiCHECK-CcdB质粒具有显著性的致死效果,是一个具备阳性筛选功能的载体。

图5 psiCHECK-CcdB质粒在DH5α及DB3.1的致死性比较
2.3 重组质粒psiCHECK-CcdB连接外源片段验证
PCSK9基因与重组质粒psiCHECK-CcdB连接后,随机挑取10个单菌落,用psiCHECK-CX-F1及psiCHECK-CX-R2引物进行PCR验证,电泳结果如图6所示,挑取的菌落均为阳性克隆。再从其中任意选择3个阳性菌落提取质粒后测序,测序结果与目标基因序列吻合,证实了目的片段通过Golden Gate方法成功重组至psiCHECK-CcdB双荧光素酶报告基因载体,psiCHECK-PCSK9重组质粒构建成功。psiCHECK-CcdB载体可高效连接外源片段,阳性率显著性提高且背景克隆较低。
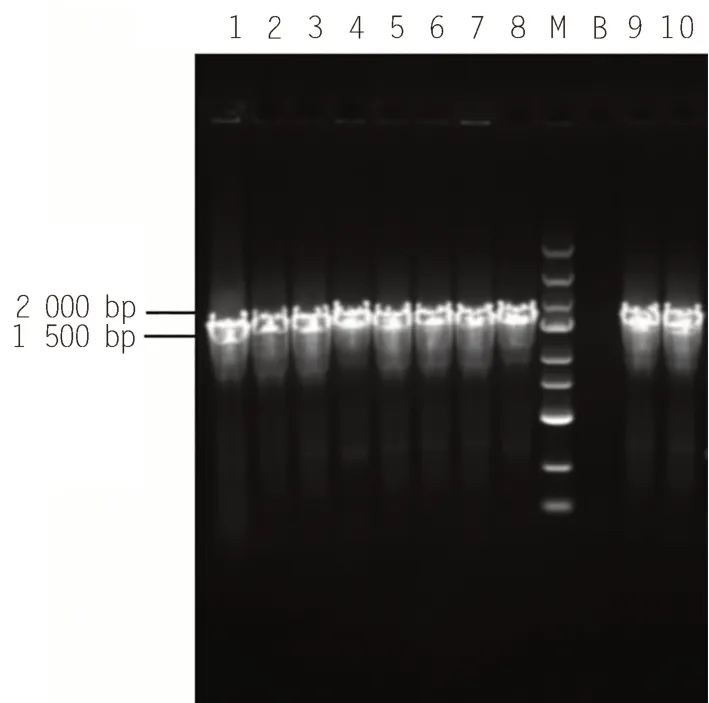
图6 重组质粒psiCHECK-CcdB连接PCSK9基因的阳性克隆筛选
2.4 重组载体psiCHECK-PCSK9用于siRNA药物筛选功能验证
HEK293T细胞共转染重组载体psiCHECKPCSK9与siRNA 24 h后,双荧光素酶报告基因检测结果如表3所示。结果证明,外源转染的siRNA成功靶向psiCHECK-PCSK9载体中的PCSK9基因并与其结合,下调了海肾荧光素酶的表达。故重组载体psiCHECK-CcdB具备监测目的基因表达变化的功能,可用于siRNA药物筛选。
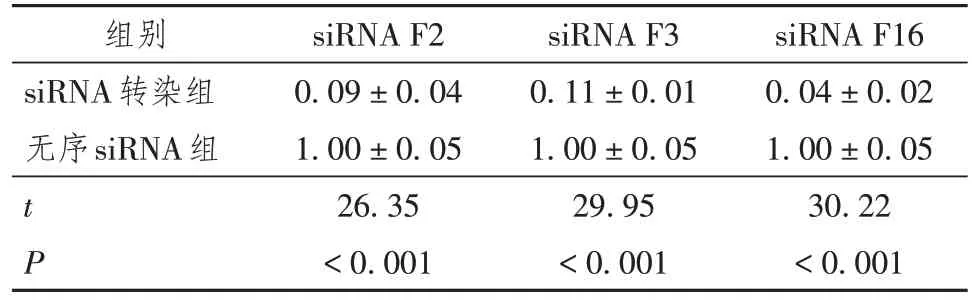
表3 双荧光素酶报告基因实验的相对荧光强度
3 讨 论
psiCHECK-2载体因其同时含有萤火虫荧光素酶和海肾荧光素酶2个报告基因的特性,已被广泛地应用于监测活细胞中的RNA干扰。但是该载体的限制性酶切位点较少、连接效率低等问题限制了其应用。当目的基因为多个不同片段时,psiCHECK-2载体需经过多次酶切连接将其构建在一起,或者通过多次PCR将目的基因先整合到一起,步骤繁琐且增加了基因突变的风险。本研究对psiCHECK-2载体进行改造,增加了IIS型限制性酶切位点,为酶切位点提供更多可选择性。应用Golden Gate组装技术,通过合理设计酶切位点、粘性末端与目的基因的位置,可实现采用单片段的构建方法完成多片段的同时组装,耗时短,突变几率小,可应用范围更广。故构建的psiCHECK-CcdB载体可快速高效地连接外源片段,显著提高载体psiCHECK-2的应用范围,为研究小干扰RNA与靶基因的相互作用提供更多的便利。
为了提高阳性克隆筛选效率,避免转化后空载体现象,本实验以CcdB致死基因作为阳性选择的标志物,构建出新型双荧光素酶报告载体psiCHECK-CcdB。即使克隆过程中因单酶切产生质粒自连,自连后的非重组质粒会表达CcdB毒性蛋白,杀死大肠杆菌DH5α、TOP10等不耐受CcdB蛋白的宿主,因此不存在含空载体的转化子,阳性率较高。但发生突变的大肠杆菌DB3.1可保存构建的psiCHECK-CcdB载体,用于后续克隆实验。
psiCHECK-CcdB载体可以与目的基因在同一反应体系中进行酶切,且无需切胶回收就可直接进行后续的连接转化工作。该方法操作简单,节约时间成本与经济成本,大大提高了连接成功率。此外,本研究还发现,在外源片段与该载体连接时使用的T4连接酶缓冲液可兼容NEB的BsmBI-v2酶以及 T4 DNA快速连接酶,故在载体质粒与插入片段线性化后再加入T4 DNA快速连接酶即可进行连接,无需在酶切后进行切胶回收再连接。本方法仅需1 h即可完成外源片段连接到克隆载体上,大大缩短了实验时间,简化传统克隆的实验步骤,且实验成本低廉。
综上所述,本研究优化了psiCHECK-2双荧光素酶报告基因表达载体的序列,在其基础上增加了氯霉素基因、BsmBI酶切位点与CcdB基因,获得了连接效率更高、操作更简单的psiCHECK-CcdB重组双荧光素酶报告载体。该载体大大简化了实验流程,缩短了实验时间,显著性提高阳性率,具备双荧光酶报告系统监测目的基因表达变化的功能及无缝克隆的潜力,在RNAi药物筛选领域具有广阔的应用前景。
利益冲突所有作者均声明不存在利益冲突