复合酶法改性糯麦A-、B-型淀粉及对其结构和消化特性的影响
张 昀,赵 迪,张康逸,郭东旭,闫美慧,张国治,*
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.河南省农业科学院农副产品加工研究中心,河南 郑州 450002)
淀粉广泛存在于大米、高粱和小麦等谷类作物中,约占原谷物质量的60%~70%[1]。淀粉由直径10~35 μm的A-型淀粉和直径小于10 µm的B-型淀粉组成[2]。淀粉有直链淀粉和支链淀粉之分。不含直链淀粉或含量极少的小麦称为蜡质小麦或糯麦[3]。糯麦在成分含量、理化特性和加工特性等方面与普通小麦明显不同[4]。适量添加糯麦粉能够改良面条品质。刘锐等[5]发现,添加了10%糯麦粉制成的面条有着更好的色泽、弹性、光滑程度。但使用纯糯麦粉制作的面制品质量较差,且过多的支链淀粉能够使食物快速被人体消化,导致血糖迅速上升,容易引起糖尿病等慢性疾病。因此糯麦在食品行业中的应用受到了一定限制,需要对糯麦淀粉进行改性。
物理、化学法都能使淀粉变性,但物理法费时耗能,化学法缺乏环保性和安全性[6]。所以近年来生物酶法受到广泛关注。酶法高效专一、绿色安全,且制备成本比物理化学法更低,能够节约资源[7]。淀粉的消化特性受到淀粉分子链结构、直支比、颗粒大小等因素的影响[8-9]。淀粉酶通过特异性修饰淀粉分子改善其抗酶解能力[10-11]。淀粉具有刚性结构,增加支链淀粉中的直链淀粉含量或支链长度能使其迅速形成双螺旋和晶体结构,从而增强刚性[12]。Xu Jinchuan等[13]发现,高直链玉米淀粉的抗酶解性更强。因为该淀粉具有更大的颗粒和更强的刚性。酶法改性中常用的酶有α-淀粉酶[14]、β-淀粉酶[15]、普鲁兰酶[16],此外还有以分支酶为代表的转苷酶类[11]。单一酶和复合酶都可以应用于酶法改性。Liu Wei等[17]指出,蜡质玉米淀粉用普鲁兰酶处理后,其慢消化淀粉(slow digesting starch,SDS)和抗性淀粉(resistant starch,RS)含量均大幅度提高。Li Yadi等[18]表明,用分支酶修饰木薯淀粉改变了支链淀粉的链长,使直链淀粉发生重结晶。淀粉水解酶和转苷酶是一种常见的复合酶组合。肖瑀等[19]认为,红薯淀粉经过α-淀粉酶、β-淀粉酶和葡萄糖苷转移酶复合改性后,短链比例、分支密度均显著增加,相对结晶度(relative crystallinity,RC)降低。Zhong Yuyue等[20]通过热乙醇预处理,α-淀粉酶和分支酶协同处理玉米淀粉,降低了回生率,提高了RC和抗酶解能力。
本研究以高直链玉米淀粉作为供体,糯麦淀粉作为受体,分别采用普鲁兰酶和分支酶单酶处理,和这两种酶协同作用的方式进行淀粉改性。改性的主要目的是提高糯麦的消化特性,同时探索经复合酶修饰后,淀粉颗粒形态、分子结构、理化性质和消化速率的变化,以期扩大糯麦的应用市场,提升糯麦的附加值,并为复合酶法改性淀粉颗粒的研究提供理论参考。
1 材料与方法
1.1 材料与试剂
糯麦籽粒、高直链玉米淀粉 河南恒瑞淀粉科技有限公司;普鲁兰酶(1 000 U/g) 上海麦克林生化科技有限公司;分支酶(660 U/mL) 丹麦诺维信公司;唾液淀粉酶、胃蛋白酶、胰酶、淀粉葡糖苷酶Megazyme国际有限公司;除溴化钾为光谱级外,其他化学物质和试剂均为分析纯。
1.2 仪器与设备
XMTD-702磁力搅拌油浴锅 上海恩谊科技有限公司;JJ-1精密定时电动搅拌器 常州越新仪器制造有限公司;PHS-3C型数显酸度计 杭州雷磁分析仪器厂;JW-1044R高速冷冻离心机 安徽嘉文仪器装备有限公司;FD-100S真空冷冻干燥机 北京惠诚佳仪科技有限公司;07J200标准试验筛 新乡市千振机械有限公司;QUANTAFEG250型扫描电子显微镜 日本FEI有限公司;A590紫外-可见分光光度计 翱艺仪器上海有限公司;尼科拉iS5型傅里叶变换红外光谱仪 美国Thermo Fisher公司;D8Advance型X射线衍射仪 德国布鲁克公司;NutraScan GI 20体外模拟消化仪 澳大利亚NI有限公司;GM 9葡萄糖分析仪 美国阿纳洛克斯仪器有限公司。
1.3 方法
1.3.1 糯麦淀粉的提取及其A-、B-型淀粉的分离
糯麦淀粉的提取方法参考Zhang Kangyi等[21]的方法,并加以改进。首先将糯麦籽粒完全浸泡在纯水中,静置过夜后用豆浆机将糯麦打成均匀细腻的浆液,用纱布过滤。滤液在3 000 r/min离心10 min。除去最上层的灰色杂质后,再次离心并除杂,直到得到干净的白色沉淀物,即为糯麦淀粉。用45 ℃烘箱对糯麦淀粉干燥24 h至其完全烘干,粉碎后用筛孔直径为0.15 mm的标准筛过筛,留用。
A-和B-型糯麦淀粉的分离参考Zhang Kangyi等[21]的方法。首先向1 L烧杯中加入100 g糯麦淀粉,准确加入800 mL纯水,均匀搅拌。让其自然放置1 h,收集500 mL上层悬浮液。重复上述操作8次左右,直至上层悬浮液变得透明澄清。用过筛孔直径为0.01 mm的标准筛过滤悬浮液,滤液在3 000 r/min离心10 min,沉淀即为B-型糯麦淀粉。将1 L烧杯中的剩余沉淀低速离心10 min,倒掉上清液后再高速离心,沉淀即为A-型糯麦淀粉。将A-、B-型淀粉于45 ℃烘箱中干燥,并用筛孔直径为0.15 mm的标准筛过筛,备用。
1.3.2 糯麦淀粉改性
参考Guo Li等[22]的方法并稍作修改。体系中的供体为高直链玉米淀粉,受体为糯麦淀粉,受体∶供体的质量比例固定为2∶1。称取20 g糯麦A-、B-型淀粉于1 L烧杯,再分别加入10 g高直链玉米淀粉和750 mL的纯水,搅拌均匀备用。在进行酶处理之前,将糯麦A-、B-型淀粉和高直链玉米淀粉的混合淀粉分别配制成淀粉乳,其质量浓度均为4 g/100 mL。
普鲁兰酶单独改性:用2 mol/L的氢氧化钠和盐酸将淀粉乳的pH值调至4.5左右,沸水浴30 min后迅速冷却。向该体系中加入1.8 g普鲁兰酶,于53 ℃水浴搅拌4 h。反应完成后,沸水浴灭酶10 min。冷却后加入2 倍体积的50%乙醇溶液,醇洗2次后再水洗2次。将沉淀物冷冻干燥即为普鲁兰酶改性淀粉,命名为PEAS和PEBS。
分支酶单独改性:使用上述酸碱将淀粉乳的pH值调至6.5左右,沸水浴糊化30 min,冷却后向其中加入600 μL分支酶,60 ℃水浴搅拌24 h后沸水灭酶10 min。冷却后用50%乙醇溶液进行醇洗和水洗。将沉淀物冷冻干燥后即为分支酶改性淀粉,命名为BEAS和BEBS。
复合酶改性:首先采用上述普鲁兰酶改性的方法,加入1.8 g普鲁兰酶在53 ℃反应4 h。然后将淀粉乳灭酶但不离心,迅速冷却后用酸碱调节pH 6.5,加入600 μL分支酶进行分支酶改性,制得复合酶改性糯麦淀粉,命名为CEAS和CEBS。
将不经过任何酶法改性操作处理的糯麦原淀粉命名为NAS和NBS;将糯麦淀粉和高直链玉米淀粉的混合淀粉命名为NAMS和NBMS。
1.3.3 颗粒形态观察
将一层淀粉粘在双面胶带上,双面胶带粘在铝制短柱上并涂上薄薄的金钯。使用扫描电子显微镜,观察糯麦原淀粉及酶法改性淀粉的颗粒形态特征。
1.3.4 表观直链淀粉含量测定
根据Li Hui等[23]的方法,并有所修改,使用碘结合法测定表观直链淀粉含量。
1.3.5 溶解度和膨胀力测定
参照Jiang Qianqian等[24]的方法,并进行修改。称取0.2 g淀粉,记为m,向已称量的离心管m1中加入10 mL纯水,分别在50、60、70、80、90 ℃的恒温水浴锅中保持1 h,冷却至室温后在3 000 r/min离心20 min。培养皿m2质量恒定后盛装上清液,置于105 ℃烘箱中再次烘干至质量恒定,记为m4。将离心管倒扣沥干水分后称量,记作m3。溶解度和膨胀力按照式(1)和(2)计算:

式中:m为样品质量;m1为离心管质量;m2为培养皿质量;m3为离心后离心管和沉淀的总质量;m4为烘干上清液后培养皿的质量。
1.3.6 X射线衍射测定
X射线衍射仪表征内部的结晶特性。设定程序:起始角4°、终止角60°、扫描速率2 °/min、步长0.02°。
1.3.7 红外光谱测定
参考Thangavel等[25]的方法,按照淀粉与溴化钾质量比1∶200,充分混合后研磨10 min,对样品进行压片和全波长扫描处理。每组样品平行测定3次,计算1 047 cm-1/1 022 cm-1峰强度比值。
1.3.8 预测血糖指数(predict glycemic index,pGI)值测定
目前通过体外模拟消化碳水化合物水解预测食物血糖生成指数(glycemic index,GI)的方法已广泛应用[26]。本研究使用NutraScan GI 20体外模拟消化系统进行血糖指数的预测,这与Zou Jian等[27]的测定方法一致。在消化管中称取50 mg淀粉样品,向其中依次加入适量不同pH值的缓冲液、唾液淀粉酶、胃蛋白酶、胰酶、淀粉葡萄糖苷酶等。GI 20体外消化模拟系统能够模拟食物依次通过口腔、胃和小肠的阶段,总消化时间为300 min,样品在每个阶段消化得到的葡萄糖由葡萄糖分析仪测定,它能够将葡萄糖读数转换为葡萄糖反应单位,并通过软件计算不同样品的pGI,计算见式(3):

式中:C为葡萄糖分析仪分析的葡萄糖质量浓度/(mg/mL);V为保留体积/mL;A为葡萄糖当量(碳水化合物总可用性/0.9)/mg。
1.4 数据处理
用SPSS 21.0和Origin 8.0对实验数据进行处理,P<0.05,差异显著。
2 结果与分析
2.1 微观结构分析
从图1可以看出,NAS、NBS多为球形或椭圆形,表面光滑,但在某些淀粉颗粒表面布有裂痕和沟槽,这是小麦淀粉的特征。由于玉米淀粉颗粒显示无规则状,将其与糯麦淀粉混合后,NAMS、NBMS的形态与NAS、NBS相比也变得不规则。PEAS和PEBS表面呈现许多裂纹,淀粉颗粒大小不均,被酶破坏的程度较大。这可能是由于普鲁兰酶在颗粒内部形成了隧道或孔穴,从而对其结构产生破坏作用。BEAS和BEBS表面出现了较多孔洞,但是淀粉颗粒外部仍保持较为完整的状态。这与王水林[28]的研究结果一致。CEAS和CBES的破坏程度较大,淀粉颗粒大小与NAMS、NBMS相比有所减小,颗粒趋于均一,表面也出现了一些孔洞和颗粒附着物。这表明两种酶协同作用于淀粉后,淀粉的颗粒形态结合了两种酶单独处理的特征。可能是普鲁兰酶先作用于淀粉内部形成了孔穴,并切割无定形区域支链淀粉内的α-1,6-糖苷键,便于分支酶随机切割淀粉分子内的α-1,4-糖苷键,并将产生的具有非还原端的低聚糖链通过α-1,6-糖苷键转接到受体糯麦淀粉的测链。
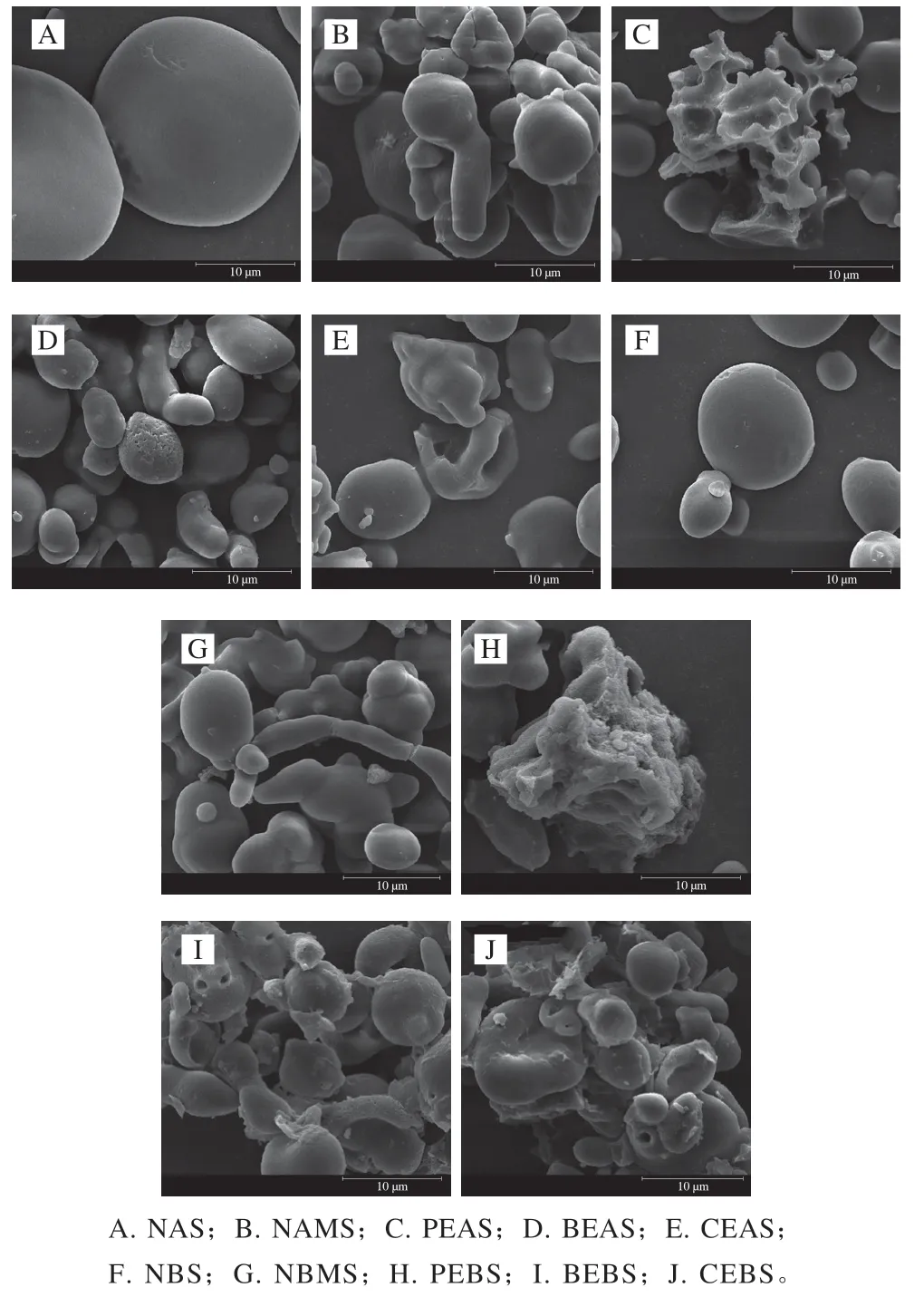
图1 不同酶处理对淀粉微观结构的影响Fig. 1 Effects of different enzymatic treatments on the microstructure of starch
2.2 表观直链淀粉含量分析
表观直链淀粉含量的测定原理是碘比色法。除了直链分子,部分非典型的支链淀粉分子的长B链也能够与碘结合发生显色反应,导致测出的结果高于实际的直链淀粉含量[29]。本实验测得的表观直链淀粉含量标准曲线方程为Y=0.011 8X+0.078 5,R2=0.999(X为表观直连淀粉含量,Y为吸光度)。不同酶处理后样品的表观直链淀粉含量如表1所示。其中NAS、NBS的表观直链淀粉质量分数在5%左右,NAMS和NBMS的表观直链淀粉质量分数接近26%,PEAS和PEBS的表观直链淀粉质量分数均在45%左右,BEAS和BEBS的表观直链淀粉质量分数均达到了50%,CEAS和CEBS的表观直链淀粉质量分数均在55%左右。物理混合后的样品与糯麦原淀粉相比,表观直链淀粉含量增加了20%左右,这是因为原体系中加入了高直链玉米淀粉。与糯麦原淀粉相比,酶处理后淀粉的表观直链淀粉含量均有显著提高,其中CEAS和CEBS的表观直链淀粉质量分数最高,约为55%。这表明用普鲁兰酶协同分支酶处理改性淀粉的效果要优于普鲁兰酶和分支酶单独酶解淀粉。这可能是因为,普鲁兰酶作用于α-1,6-糖苷键,切断淀粉分子形成短链,故糯麦淀粉的直链淀粉含量有所增加。而分支酶作用于α-1,4-糖苷键,先切断供体高直链玉米淀粉分子链,再通过α-1,6-糖苷键将其连接到受体糯麦淀粉的侧链,使其侧链排列增加,外链变长;同时分支酶也可能使支链分子的侧链发生了断裂,产生了类似于直链淀粉性质的短链分子,导致样品碘结合能力的增强,有更高的表观直链淀粉含量[30]。
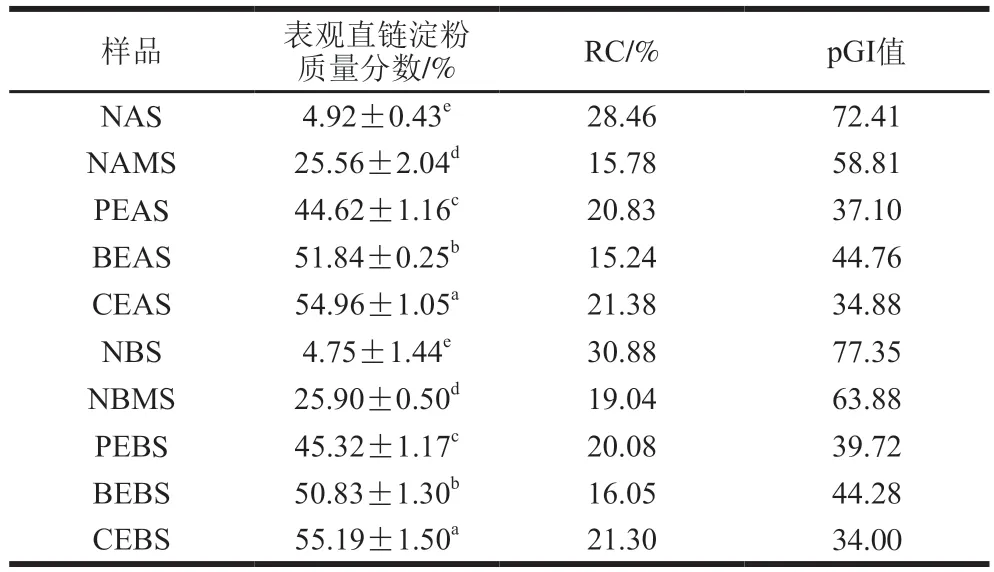
表1 不同酶处理淀粉的表观直链淀粉含量、RC及pGI值Table 1 Apparent amylose content, RC and pGI values of starch treated with different enzymes
2.3 溶解度和膨胀力分析
溶解度和膨胀力能够反映淀粉在加热过程中结晶区和非晶区的淀粉分子链之间的相互作用程度,高温会导致直链淀粉的迁移并增加直链淀粉的浸出,从而增加溶解度[31-32]。改性前后糯麦淀粉的溶解度见图2。所有淀粉样品的溶解度均随温度的升高而增加。这说明水分子在温度的作用下,大量渗入淀粉分子内部的结晶区,破坏分子间的氢键,使直链淀粉和部分支链淀粉逐渐逸出。在50~70 ℃时,酶法改性淀粉的溶解度高于NAS、NBS的溶解度,其中BEAS和BEBS溶解度最大。在70~90 ℃时,酶法改性淀粉的溶解度也呈增加趋势。但NAS、NBS的溶解度远高于酶法改性淀粉的溶解度。这可能是由于酶处理淀粉后,直链淀粉和直链淀粉、直链淀粉和支链淀粉之间的相互作用增强,水分子更不容易渗透到稳定的晶体结构中,使溶解受到限制[33]。这些因素都可能导致酶处理样品中的不溶性直链淀粉含量增加,从而使溶解度降低[34]。

图2 不同酶处理A-(A)、B-型(B)淀粉的溶解度Fig. 2 Solubility of A-type (A) and B-type (B) starch treated with different enzymes
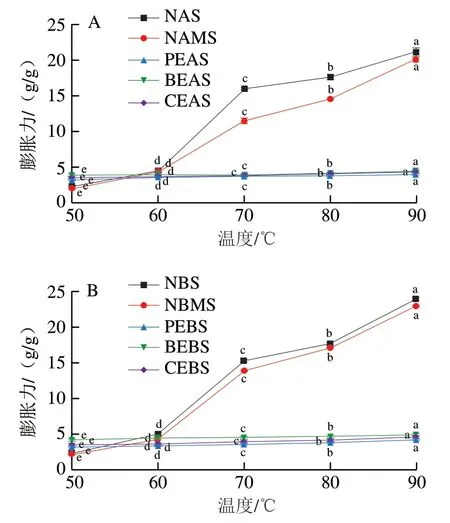
图3 不同酶处理A-(A)、B-型(B)淀粉的膨胀力Fig. 3 Swelling power of A-type (A) and B-type (B) starch treated with different enzymes
由图3可知,NAS、NBS、NAMS、NBMS与酶法改性淀粉的膨胀力在不同温度下的变化趋势各不相同。NAS、NBS和NAMS、NBMS的膨胀力随着温度的升高而增加,这可能是由于糯麦原淀粉和物理混合淀粉的糊化温度较低,升温使淀粉充分吸水膨胀。与NAS、NBS相比,NAMS和NBMS的膨胀力有所降低。这是由于混合粉中加入了一部分糊化温度较高的高直链玉米淀粉,削弱了淀粉与水分子之间的相互作用[35]。PEAS和PEBS、BEAS和BEBS、CEAS和CBES的膨胀力随着温度的升高变化趋势并不明显。当温度从70 ℃升高到90 ℃时,酶处理淀粉的膨胀力远低于原淀粉。研究发现若淀粉中的支链淀粉含量较高能够促进淀粉颗粒膨胀,含量降低则能够抑制其膨胀[36]。因此糯麦原淀粉更容易膨胀。而原淀粉经过普鲁兰酶和分支酶处理之后,结晶区的分子链进行重排,支链淀粉分子发生了降解,部分分支出现了断裂,直链淀粉分子间的相互作用在逐渐增强,水合能力减弱,因而酶法改性淀粉有着较低的膨胀力。这与糯麦经改性后直链淀粉含量增加的结果一致。
2.4 X射线衍射分析
如图4所示,NAS、NBS、NAMS、NBMS在2θ为15°、17°、23°表现出较强的衍射峰,在18°、23°处出现主衍射双峰,显示出典型的A型晶体结构[37]。因为糯麦淀粉和高直链玉米淀粉的晶型均为A型,物理混合并不会改变样品的结构。酶法修饰后,PEAS、PEBS、BEAS、BEBS、CEAS、CEBS在2θ为20°左右出现了较强的衍射峰,在15°、17°、23°的衍射峰消失,在18°的双峰变成了单峰,且峰强和峰高都有所降低。此处代表V-型结构,它的形成一般与有序的单螺旋葡聚糖有关,或者是内源性脂肪脂复合物的线性葡聚糖[38]。说明酶处理使淀粉的双螺旋结构打开,淀粉分子链发生重排,结晶结构被破坏,结晶区被转变为无定形区,这也从侧面印证了酶处理使淀粉的RC降低。
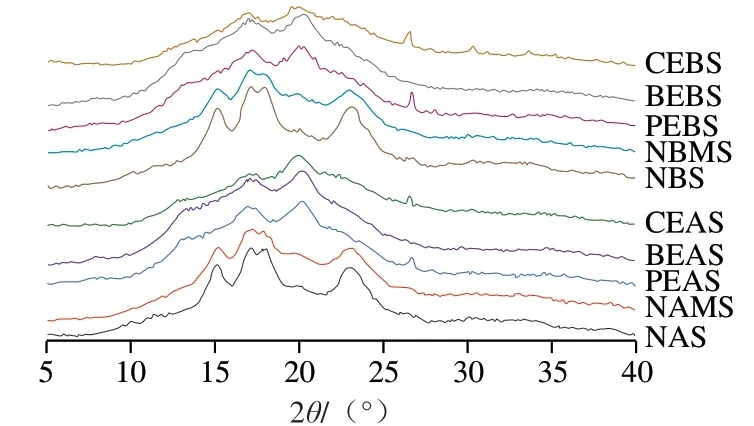
图4 不同酶处理淀粉的X射线衍射图谱Fig. 4 X-ray diffraction patterns of starch treated with different enzymes
RC代表了聚合物中结晶区域所占的比例,RC越高表明分子链的排列越规律。通常来说支链越长,形成的双螺旋结构越稳定,若支链太短不能形成双螺旋结构,则无法促使淀粉结晶[39]。从表1可以看出,PEAS、PEBS、BEAS、BEBS、CEAS、CEBS的RC均低于NAS、NBS,这说明酶法修饰使淀粉的双螺旋结构被破坏,改变淀粉颗粒的微晶取向,可以推测出经酶处理后淀粉的长程有序结构减少,从而导致淀粉的RC减小。相比于NAMS、NBMS,PEAS、PEBS和BEAS、BEBS的RC分别出现了升高和降低趋势。这可能是由于普鲁兰酶水解发生在淀粉的无定形区,使得结晶区在淀粉颗粒中所占比例增大[40]。分支酶可能将从受体上切下的短链转移并连接到了供体上,导致短链比例的降低,RC下降。CEAS、CEBS的RC相比于PEAS、PEBS进一步升高。这可能是因为普鲁兰酶通过水解淀粉中的α-1,6-糖苷键,去除了支链上的侧链,消除了空间位阻,为分支酶将短线性链的非还原端转移到内部葡萄糖残基的C-6羟基位置提供了空间,进一步提高了淀粉的结晶度。
2.5 红外光谱分析
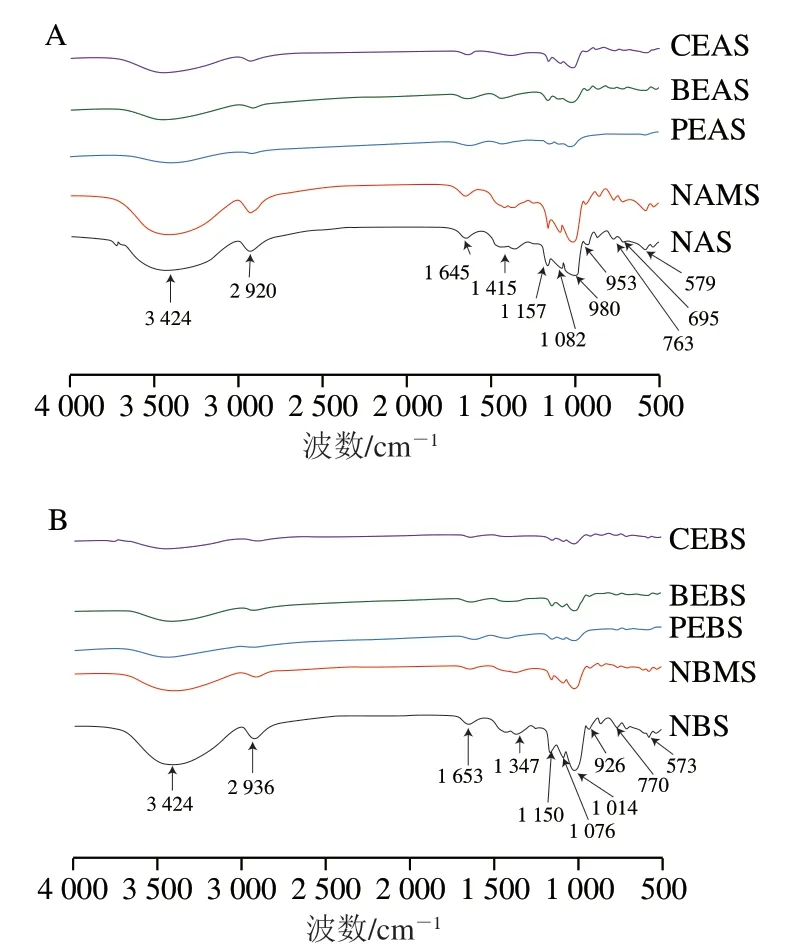
图5 不同酶处理A-(A)、B-型(B)淀粉的红外光谱图Fig. 5 Infrared spectra of A-type (A) and B-type (B) starch treated with different enzymes
由图5可知,NAS、NAMS、NBS、NBMS均在3 424 cm-1处出现了一个强且宽的吸收峰,可能是由于O—H的伸缩振动引起;分别在2 920、2 936 cm-1处出现一个较强的吸收峰,这可能是由于C—H的伸缩振动;分别在1 645、1 653 cm-1有一个较强的吸收峰,可能是由于体系吸附水中的H—O—H弯曲振动;分别在1 415、1 347 cm-1处出现了较弱的吸收峰,可能是因为—CH2OH中—CH的弯曲振动;分别在1 157、1 150 cm-1处出现了一个较强的吸收峰,这可能是由于伯醇羟基C—O的伸缩振动;分别在1 082、1 076 cm-1处有一个较弱的吸收峰,这可能是因为伯羟吡喃糖环C—O的伸缩振动导致;NBS、NBMS在1 014 cm-1处出现了P—O—C面内弯曲振动的吸收峰;NBS、NBMS在926 cm-1处出现了吡喃环的环非对称伸缩振动峰;NAS、NAMS、NBS、NBMS分别在763、770 cm-1出现吡喃环的环对称伸缩振动吸收峰。糯麦原淀粉与混合粉以及酶法改性制备淀粉相比较,红外光谱图没有出现明显不同的吸收峰,只是峰的强度和宽度有所缩小,这说明酶处理过程中没有形成新的取代基团,其化学结构没有变化。
表2显示了糯麦原淀粉和酶法改性淀粉的峰强度比值。1 047 cm-1和1 022 cm-1代表了淀粉结晶区和无定形区的峰值强度,两者比值为淀粉中有序的晶体相对无定形区的量,能够反映晶体结构[41]。该比值越大,说明淀粉的有序度越高。从表2可见,混合粉NAMS、NBMS在1 047 cm-1和1 022 cm-1比值相较原淀粉NAS、NBS有所增加,高直链玉米淀粉的添加增加了分子的短程有序性。糯麦淀粉经酶法改性后,PEAS、PEBS、BEAS、BEBS、CEAS、CEBS在1 047 cm-1和1 022 cm-1的比值再次增加,这说明酶法改性进一步增强了分子的短程有序性。其中用PEAS、PEBS的比值最高。这可能是因为分支酶提高了淀粉的分支度,使淀粉分子链之间重新排列,能够发生更多的相互作用,更容易形成有序结构。

表2 淀粉样品在红外光谱1 047 cm-1/1 022 cm-1处的峰强度比值Table 2 Ratio between intensities of peaks at 1 047 and 1 022 cm-1 of starch samples
2.6 pGI值分析
高GI食物的GI值不低于70,低GI食物则在55以下[23]。GI值越低越利于人体健康。糯麦原淀粉、混合粉及酶法改性淀粉样品的消化曲线如图6所示。由图6可知,所有酶法改性的样品的GI值均低于原淀粉NAS,NBS和混合粉NAMS、NBMS。这表明普鲁兰酶和分支酶处理能够显著增加糯麦淀粉对消化酶的抵抗力。在不同的消化阶段,不同淀粉样品的GI值大小和增速有所区别。当消化时间在0~60 min时,CEAS和CEBS的GI值低于PEAS和PEBS、BEAS和BEBS,酶法改性样品远小于原淀粉和混合粉。当消化时间在60~180 min时,NAS和NBS的GI值增加速度最快,增幅最大,远高于酶法改性淀粉的GI值;CEAS和CEBS的GI值增加速度最慢;PEAS和PEBS、BEAS和BEBS的GI值增长速度较为适中。当消化时间在180~300 min时,所有淀粉GI值的增速均放缓,消化结束时CEAS和CEBS的GI值最低,NAS、NBS的GI值最高。淀粉样品的消化时间一共为300 min,该机器模拟的是人体内部的环境。淀粉在人体内的消化阶段主要是口腔、胃、肠。与酶法淀粉相比,未经改性的原淀粉NAS和NBS和混合粉NAMS和NBMS从进入口腔开始就迅速被唾液淀粉酶消化;然后进入胃里,在胃酸的作用下淀粉可能会发生部分水解作用,生成环状糊精;最后进入小肠,在胰酶及糖化酶作用下淀粉分解为小分子还原糖,消化率迅速增加。随着消化时间的延长,淀粉分子逐渐被水解,酶的作用位点越来越少,导致反应速率下降,还原糖的生成速率减缓,但总体的还原糖量仍在增加,所以GI值在不断增加。而酶法改性改善了淀粉分子的结构,使淀粉的抗酶解性增强,因此在3个阶段的水解程度和GI值也明显小于原淀粉和混合粉。
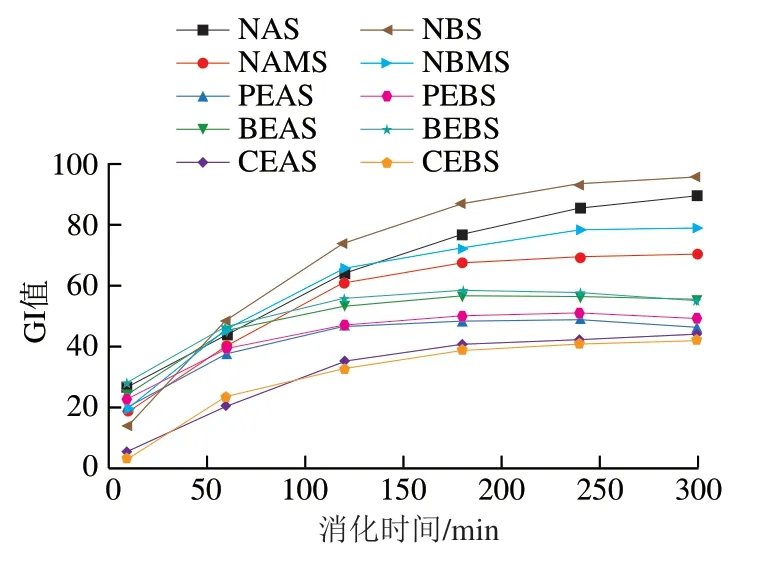
图6 体外模拟消化过程中不同酶处理淀粉的GI值Fig. 6 GI values of starch treated with different enzymes in simulated digestion in vitro
由表1可知,NAS、NBS的pGI值分别为72.41和77.35,NAMS、NBMS的pGI值分别为58.81和63.88。混合粉GI值低于原淀粉是因为加入了少量GI值很低的高直链玉米淀粉。PEAS和PEBS的pGI值分别为37.10和39.72,BEAS和BEBS的pGI值分别为44.76和44.28,CEAS、CEBS的pGI值分别为34.88和34,pGI值最低。这表明采用普鲁兰酶和分支酶两种酶复合改性糯麦淀粉并降低GI值具有显著效果。这可能是因为采用普鲁兰酶预处理后,支链淀粉外链断裂为小而多的短链,降低了空间位阻,有利于更多的线性链被分支酶转移到内部葡萄糖残基的C-6羟基位置,从而使侧链的数量增加,导致淀粉的分支密度增加,从而提高淀粉的抗酶解特性[31]。
3 结 论
通过采用普鲁兰酶对糯麦淀粉先进行预处理,再经过分支酶修饰的方法制备得到的糯麦改性淀粉与原淀粉相比,pGI值显著降低,分子结构、理化特性也发生了变化。而糯麦A-、B-型淀粉经复合酶处理之后,在各方面的差异并不明显,尤其是GI值,均远低于糯麦原淀粉。说明这种制备改性淀粉的方法同时适用于A-、B-型淀粉。普鲁兰酶和分支酶对糯麦淀粉进行结构上的修饰后,短链有所增加,大幅度提高了直链淀粉含量;酶处理提高了淀粉分子的有序性,减少了淀粉分子的长程有序结构,导致改性淀粉溶解度、膨胀力和RC的变化,而这些结构的改变促使改性淀粉的抗酶解能力大幅度提高。因此,普鲁兰酶协同分支酶处理糯麦A-、B-型淀粉能够显著改善糯麦淀粉的消化特性。这一发现可能会扩大糯麦的应用市场,开发出具有较低GI值的糯麦淀粉基础产品,该产品可能适用于结肠疾病、肥胖症和糖尿病等患者。

