新型冠状病毒E基因真核表达载体的构建及表达
于雯,郑亮,王宏宇,高鑫誉,吴志军1,,曹宏伟1,,张华1,
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院;3.黑龙江八一农垦大学生物技术中心)
2019年12 月以来,新型冠状病毒(SARS-CoV-2)感染所引起的新型冠状病毒肺炎已经成为近世纪以来最严重的全球大流行传染病,在将近两个月的时间里,疫情迅速蔓延至全球200多个国家和地区,对人们的生命安全和全球的经济造成了巨大的影响[1]。新冠病毒所引起的症状以发热、肺部炎症、干咳、呼吸困难等为主要临床表现,具有高传染性,潜伏期较长,但死亡率相对较低的特点[2-3]。
新型冠状病毒具有冠状病毒家族的特征,属于β冠状病毒谱系,基因组与SARS-CoV具有79.5%的序列同一性[4-5]。SARS-CoV-2的基因组长约为29.7 kb,在5’和3’端有一个非翻译区(UTR)。SARSCoV-2基因组编码刺突蛋白(Spike,S)、包膜蛋白(Envelope,E)、膜蛋白(Membrane,M)、核衣壳蛋白(Nu cleocapsid,N)、ORF1a、ORF1b、ORF3、ORF6、ORF7a、ORF7b、ORF8和ORF9b。此外,SARS-CoV-2基因组编码的一个大型开放阅读框(ORF1a及ORF1b)被木瓜样蛋白酶(Nsp3)和3-C样蛋白酶(Nsp5)进一步分裂成16个非结构蛋白(Nsp1-16)。与SARS-CoV不同的是SARS-CoV-2基因组编码完整的ORF8,但不编码ORF8b[6-8]。
E蛋白是由SARS-CoV-2所编码的最小的结构蛋白,由三个结构域组成,分别为7-12个氨基酸组成的短亲水性氮末端结构域、长约25个氨基酸的疏水跨膜区和长亲水性碳末端区域[9-10]。E蛋白位于病毒的外表面,在复制过程中,E蛋白的一部分会整合到病毒颗粒包膜中,并且能够参与病毒的组装和出芽;E蛋白还可以作为病毒膜孔蛋白,可在宿主细胞膜上形成选择性离子通道,介导特殊离子的运输,离子通道活性对病毒复制和增殖等功能可以造成一定的影响[11]。在哺乳动物细胞中,新型冠状病毒E蛋白拓扑结构的研究证实了E蛋白是一种单跨膜蛋白,其N端跨膜转运,而C端暴露于细胞质侧。这可以为理解E蛋白与宿主成分的相互作用提供一个理论依据,并且为解析新型冠状病毒的发病机制奠定基础[12]。
该研究从NCBI网站上获取SARS-CoV-2 Wuhan-Hu-1毒株E基因序列,进行密码子优化后,合成该基因。通过PCR扩增技术获得E基因,将该基因连接到真核表达载体pCMV-Myc后,转染至HEK-293T细胞,通过Western Blot和间接免疫荧光检测技术检测重组载体pCMV-Myc-SARS-CoV-2-E的表达和亚细胞定位情况。Western Blot结果显示,SARS-CoV-2 E重组表达蛋白大小表达正确;间接免疫荧光结果显示,SARS-CoV-2 E重组表达蛋白主要分布于HEK-293T细胞胞质,少数分布于胞核。这些结果说明,pCMV-Myc-SARS-CoV-2-E重组表达载体构建成功,为之后研究SARS-CoV-2 E蛋白的功能以及特性奠定了基础。
1 材料与方法
1.1 细胞和载体
DMEM培养基购自Gibco生物公司,含10%的胎牛血清(FBS)、100 μg·mL-1青霉素和链霉素;感受态细胞DH5α、人胚胎肾上皮细胞(HEK-293T)、pCMV-Myc载体由实验室保存。
1.2 试剂
LipofectamineTM2000购于Invitrogen公司;DNA胶回收试剂盒、质粒提取试剂盒购自Omega公司;PCR试剂盒、一步克隆同源重组试剂盒购于诺唯赞公司;EcoR I和KpnⅠ核酸内切酶购自TaKaRa公司;小鼠抗Myc标签单克隆抗体,辣根酶标记山羊抗小鼠IgG购自中杉金桥生物技术有限公司;引物合成和重组质粒序列测定由擎科生物(天津)公司完成。
1.3 引物设计及表达载体的构建
根据已发表在NCBI网站上的SARS-CoV-2 Wuhan-Hu-1(NC_045512)毒株基因序列报道,通过擎科生物技术公司进行密码子优化后,并根据所得到的序列合成该基因。设计具有特异性的E基因上游引物和下游引物,上游引物:5’-TATGGCCATGGAGGCCCGAATTATGTACAGCTTCGTGAGCG-3’,下游引物:5’-CTGGATCCCCGCGGCCGCGGTACCTACA CCAGCAGGTCGGGCAC-3’,将E基因插入EcoR I和KpnⅠ位点之间,构建pCMV-Myc-SARSCoV-2 E蛋白真核表达载体。
1.4 目的基因的获取
利用基因合成及PCR扩增等技术获取目的基因,体系为20 μL:模板1 μL,Extaq聚合酶0.1 μL,Taq buffer 3.0 μL,dNTP 2 μL,上游引物0.2 μL,下游引物0.2 μL,ddH2O 13.5 μL。PCR扩增温度设定的程序为:94℃预变性5 min;94℃变性30 s;60℃退火30 s;72℃延伸20 s(30次循环);72℃保温10 min;反应结束后,获得的产物经过1%琼脂糖凝胶电泳,目的条带进行胶回收纯化,置于-20℃保存备用。
1.5 SARS-CoV-2-E真核表达载体的构建及鉴定
将pCMV-Myc载体进行双酶切,经过EcoR I和KpnⅠ切割12 h后,纯化回收载体片段。将纯化所得到的产物进行连接,连接体系为基因片段与载体酶切片段按照物质的量比为3∶1的比例加入到PCR管中,用移液枪混匀,放入PCR仪中50℃保温15 min。反应结束后,将连接产物加到感受态细胞中,进行转化实验,涂布平板,放置37℃培养箱中培养10 h。次日挑取单菌落置于37℃、180 r·min-1摇床中培养10 h后,使用试剂盒提取质粒。之后进行酶切验证,选择正确的质粒测序,取10 μL质粒进行测序,将其命名为pCMV-Myc-SARS-CoV-2-E,其余质粒放于-20℃保存。

图1 真核表达载体构建路线Fig.1 Construction route of eukaryotic expression vector
1.6 间接免疫荧光法检测
接种细胞至24孔板中,并且进行细胞爬片,当细胞的汇和度达到60%时,用LipofectamineTM2000将800 ng的pCMV-Myc和pCMV-Myc-SARS-CoV-2-E质粒转染至HEK-293T细胞中,37℃、5% CO2条件下培养细胞24 h。弃掉旧的培养液,用已灭菌的PBS洗3次,孔中加入500 μL的4%多聚甲醛溶液,静置20 min;PBS洗3次,加入0.1% Triton X-100,静置20 min;PBS洗3次,使用5% BSA封闭2 h;PBS洗3次,加入一抗小鼠抗Myc标签单克隆抗体,依据抗体说明书1∶1000稀释,孵育2 h;PBS洗3次,再加入对应的荧光标记的二抗FITC标记的山羊抗小鼠,按照1∶200稀释,避光孵育2 h;二抗孵育后,PBS洗3次,加入DAPI染液对细胞核染色15 min,使用封片剂封片,荧光显微镜下观察结果。
1.7 Western Blot
将细胞接种于24孔板中,当细胞的汇合度达到80%时,进行转染实验,先将板中的10% FBS的DMEM培养液更换为400 μL无血清DMEM培养液,然后将质粒和LipofectamineTM2000混合液加到相应的孔中,转染后4-6 h,将无血清DMEM培养液更换为500 μL含10% FBS的DMEM培养液,放置细胞培养箱中。使用已灭菌的PBS冲洗2次,每个孔中加入30 μL的RIPA裂解液,放置冰上裂解30 min。用已经处理过的枪头将细胞刮下放入EP管中,4℃、12000×g离心10 min,收集上清,然后加入5×Loading Buffer,100℃煮沸10 min,恢复室温之后12000×g离心10 min,将所得的混合物经15% SDSPAGE胶分离。电泳结束后,使用5%脱脂奶粉孵育2 h后,使用1×TBST缓冲液洗膜,然后用一抗小鼠抗Myc标签单克隆抗体摇床孵育2 h,1×TBST缓冲液洗膜2 h,再用二抗山羊抗小鼠辣根酶标记IgG,稀释倍数1∶3000,摇床孵育2 h,1×TBST缓冲液洗膜2 h,配制曝光液,上机曝光拍照。
2 结果与分析
2.1 E基因的获取
利用重组质粒pcDNA3.1-SARS-CoV-2-E为模板进行PCR扩增,获取目的基因,得到大小约为5400 bp的载体片段和228 bp的E基因片段,结果如图2。

图2 E基因的获取Fig.2 Acquisition of E Gene
2.2 重组质粒pCMV-Myc-SARS-CoV-2-E双酶切鉴定
为了鉴定重组质粒是否成功构建,进行双酶切鉴定,加入EcoR I和KpnⅠ两种酶,置于37℃水浴锅中2 h,得到片段大小约为5400 bp和228 bp的两条目的条带,与预期结果符合,结果如图3。测序结果显示,SARS-CoV-2 E基因成功连接至pCMV-Myc载体。

图3 重组质粒pCMV-Myc-SARS-CoV-2-E质粒双酶切鉴定Fig.3 Identification of pCMV-Myc-SARS-CoV-2-E plasmid by double enzyme digestion
2.3 E蛋白在HEK-293T细胞中的表达及亚细胞定位情况
将800 ng的重组质粒pCMV-Myc-SARS-CoV-2-E转染至HEK-293T细胞,利用间接免疫荧光技术对其分布情况进行鉴定。结果显示,重组表达载体pCMV-Myc-SARS-CoV-2-E成功表达,主要分布于HEK-293T细胞的细胞质区域。研究进一步利用间接免疫荧光技术检测pCMV-Myc、pCMV-Myc-SARSCoV-2-E质粒与内质网标示蛋白的共定位情况。实验结果发现,重组质粒pCMV-Myc-SARS-CoV-2-E在细胞中表达后,SARS-CoV-2 E蛋白与内质网标示蛋白发生共定位情况。这些结果说明,SARS-CoV-2 E蛋白亚细胞定位于内质网区域,其结果如图4和图5所示。
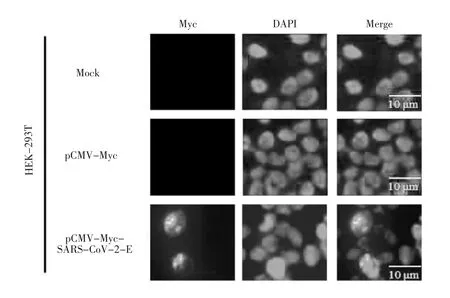
图4 间接免疫荧光技术检测重组质粒的表达Fig.4 The expression of recombinant plasmid by IFA
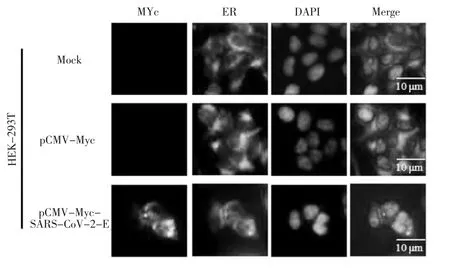
图5 SARS-CoV-2 E蛋白亚细胞定位于内质网Fig.5 SARS-CoV-2 E protein can colocalize with ER
2.4 SARS-CoV-2 E蛋白的Western Blot检测
将800 ng的重组质粒pCMV-Myc-SARS-CoV-2-E转染至HEK-293T细胞,RIPA裂解及收集细胞。经SDS-PAGE胶分离后,使用小鼠抗Myc单抗和山羊抗小鼠二抗检测载体pCMV-Myc及重组表达载体pCMV-Myc-SARS-CoV-2-E的表达情况,内参(β-actin)抗体为小鼠抗β-Actin单克隆抗体。其结果如图6所示,转染重组表达载体的样品中出现与预期大小一致的条带,对照组和空载体均未观察到相关条带,说明SARS-CoV-2 E蛋白在HEK-293T细胞中成功表达。

图6 Western Blot技术检测重组质粒的表达Fig.6 The expression of recombinant plasmid by Western Blot
3 讨论
SARS-CoV-2属于巢病毒目、冠状病毒科成员,属于单股正链RNA病毒。新型冠状病毒的爆发对全球的公共卫生造成了威胁,也给全球的经济带来了损失。现有关于SARS-CoV-2的研究文献较多,但是对于SARS-CoV-2 E基因的研究相对来说比较少。通过比对SARS-CoV-2和SARS-CoV的E基因序列发现,SARS-CoV-2与SARS-CoV的E基因同源性很高,只有4个氨基酸的差异,离子通道活性位点Asn15和Val25完全保守[13-14];在SARS-CoV中,E蛋白缺失后,受感染细胞中应激和凋亡标记物表达增加,从而导致病毒的传染性降低[15];缺失E蛋白的重组病毒,会导致病毒滴度显著降低以及病毒成熟发生缺陷。这些结果说明,E蛋白在病毒的成熟和出芽过程中发挥着重要的作用;此外,E蛋白还可以激活炎症小体的形成,促进炎症反应[16-18];已有相关的研究表明,冠状病毒E蛋白在膜中形成五聚体,而不是选择性离子通道;Sarkar等[19]利用SARS-CoV核磁共振结构作为模板模拟了SARS-CoV-2 E蛋白,通过鉴定排列在SARS-CoV-2 E蛋白内腔侧的关键氨基酸残基,随后的膜插入以及E蛋白模型的变形表明五聚体结构能够形成动态的封闭和开放状态,但是跨膜区的E蛋白突变保持了PDZ结合序列(PDZbinding motif,PBM)的完整,能够结合多个宿主蛋白,和病毒的致病性相关。
E蛋白已经被确定在SARS-CoV-2中具有最高的抗原性,可被用于鉴定B细胞和T细胞表位。对于细胞融合来说,其抗原肽是由人类主要组织相容性复合体(MHC)提供,SARS-CoV-2 E蛋白通过离子键和氢键与MHC-I相互作用,而且比MHC-II作用次数要多。Tyr42和Tyr57在与MHC-I的相互作用中起着主导作用,与其他的E蛋白相比,SARS-CoV-2 E蛋白与MHCs的相互作用更强。因此,E蛋白能够作为抗SARS-CoV-2的潜在疫苗靶点可以为开发新冠减毒活疫苗、灭活疫苗以及其他治疗策略提供一定的理论基础[20]。
通过基因合成及PCR方法扩增出SARS-CoV-2 E基因,利用pCMV-Myc作为E基因的表达载体,成功构建pCMV-Myc-SARS-CoV-2-E重组载体,并验证了E蛋白的成功表达和亚细胞定位情况,为后续研究E基因在抗病毒反应中的功能以及开发拮抗SARS-CoV-2药物等奠定了一定基础。
——一道江苏高考题的奥秘解读和拓展

