左心室Summit起源室性心律失常标测及消融进展
林加锋 胡有东 李进
近年来特发性室性心律失常(ventricular arrhythmias,VAs)消融成功率明显提高。但左心室Summit(left ventricular summit,LVS)起源 VAs(LVS-VAs)的消融仍面临成功率较低、难度较大,复发率及风险较高等困扰。本文将近年来国内外相关研究进展作一阐述。
1 LVS的解剖特点
LVS是左心室最高部分,位于左心室出口外侧,为左心室流出道(left ventricular outflow tract,LVOT)的组成部分,1974年由MeAlpine首次提出,解剖学上有狭义和广义之分。狭义的为心外膜三角形区域,其顶点为左主干发出左前降支(left anterior descending coronary artery,LAD)与左回旋支(left circumflex coronary artery,LCX)分叉处,底部为LAD的第一间隔支与LCX外侧前方之间的弧形连线(图1)。广义的还包含右心室流出道(right ventricular outflow tract,RVOT)间隔部、主动脉瓣-二尖瓣连接区(aortomitral continuit,AMC)及左冠状动脉窦(left coronary cusp,LCC)。LVS常指狭义,心大静脉远端(distal great cardiac vein,DGCV)将其分成两个区域:(1)靠近左心室基底部,因毗邻冠状动脉(coronary artery,CA)且覆有较厚的脂肪层,常无法消融(不可达区);(2)靠近三角形外侧和下部区域,距CA有一定距离,可经冠状静脉(coronary vein,CV)或心外膜途径行标测和消融,称可达区[1]。
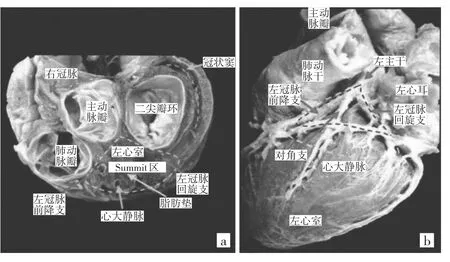
图1 左心室Summit区解剖结构(引自刘元生,2017年)
心大静脉(great cardiac vein,GCV)为冠状静脉窦(coronary sinus,CS)的延伸,位于冠状沟,其远端邻近二尖瓣环前间隔心外膜,经冠状沟向左,绕过心左缘至心后面注入CS的左端,DGCV有2个分支,其中向前下行走于前室间沟与LAD伴行者为前室间静脉(anterior interventricular vein,AIV),另一根起源于DGCV与AIV交点,为DGCV延伸向右行走于RVOT与LVOT之间间隔的为左心室顶部穿间隔静脉(Summit-CV),GCV由后向前有3个分支,分别为后侧静脉(posterior lateral vein,PLV)、侧静脉(lateral vein,LV)及前侧静脉(anterior lateral vein,ALV),并将GCV分为近、中、远3段,DGCV(图2)又分为DGCV1和 DGCV2(与 AIV交界处)。
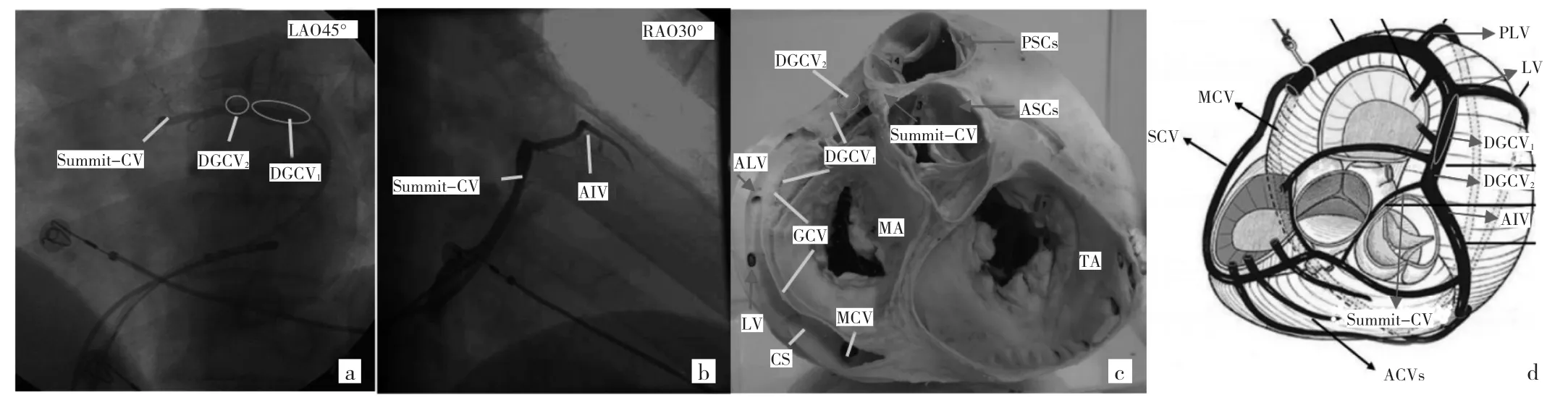
图2 冠状静脉各主要分支X线影像、实体解剖及其示意图
LVS是心外膜VAs的好发部位,其解剖及毗邻结构复杂,如 DGCV、AIV、LCC、右冠窦(right coronary cusp,RCC)、AMC和RVOT等,不同部位VAs的电生理特点相近又各有特殊性,其机制可能与此处纤维骨架、心肌及血管平滑肌的肌袖交错有关,亦或与心肌纤维化相关。因其上述毗邻关系,也为LVS-VAs标测与消融提供了多种途径。
2 LVS-VAs的心电图特点
LVS-VAs的特征包括起源于心内膜与心外膜两种表现形式。共同特征为右束支传导阻滞型,Ⅱ、Ⅲ、aVF呈高大的R波,RⅢ/RⅡ比值>1.25[2]。少数呈左束支传导阻滞型,胸导联移行早于窦性心律。假性δ波时间>34 ms,类本位曲折时间≥85 ms,QRS时间>200 ms,RS时间>120 ms,最大偏转指数≥0.55。
Santangeli等[3]研究显示,LVS-VAs可达与不可达区起源者心电图有差异:(1)可达区QaVL/QaVR比值更高,>1.85;(2)RV1/SV1比值>2;(3)消融成功者V1均呈q波,而失败者仅1/3呈q波。不可达区无法消融的原因为损伤CA风险;脂肪层较厚,消融能量不能有效传递。
Lin等[4]发现QaVL/QaVR比值对预测成功消融靶点很重要,其在LCC、主动脉瓣下、GCV/AIV和经皮心外膜途径的截值分别为≤1.43、1.43~1.54、1.54~1.74 和>1.74。其比值越大,提示VAs起源点距LCC越远,越偏向LVS的侧壁。
2.1 DGCV-VAs的心电图特征 因起源点为房室沟心室较高位,下壁呈高大R波,且RⅢ>RⅡ;aVL和aVR呈QS型(QSaVL>QSaVR);Ⅰ呈rS或qs型;除极的初始向量指向V1并呈R波,胸导联移行<V1。与DGCV2比较,DGCV1更靠左侧,向左除极向量变小,故DGCV2V4~V6呈R型而DGCV1呈Rs型(图3)。既往研究显示,RV1时间>75 ms为起源于DGCV-VAs心电图特征[5]。此外,RⅢ升降支双切迹(“尖顶军盔”征)是预测DGCV-VAs的高度特异指标(图4)[6]。
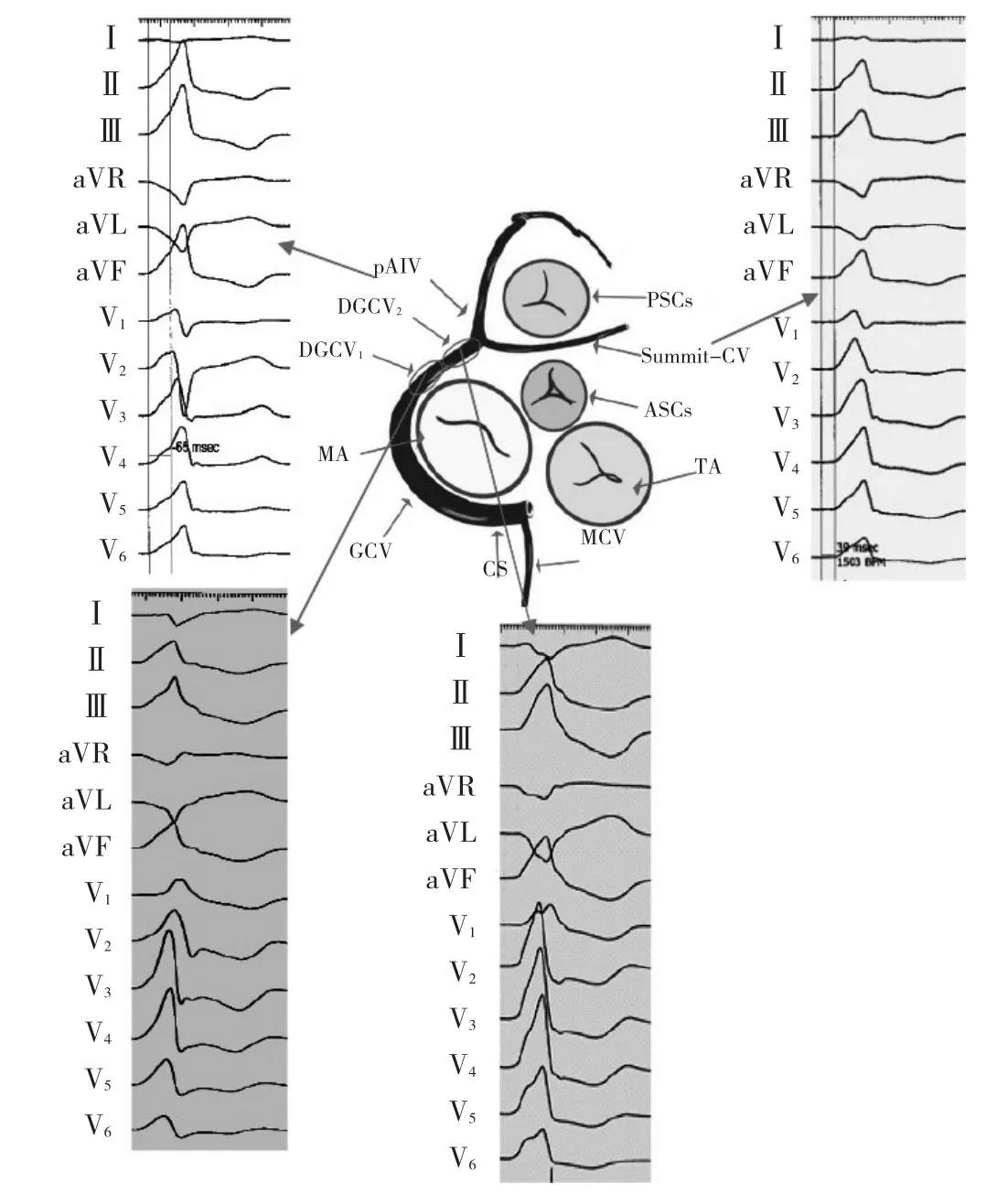
图3 不同部位DGCV-VAs的心电图特征
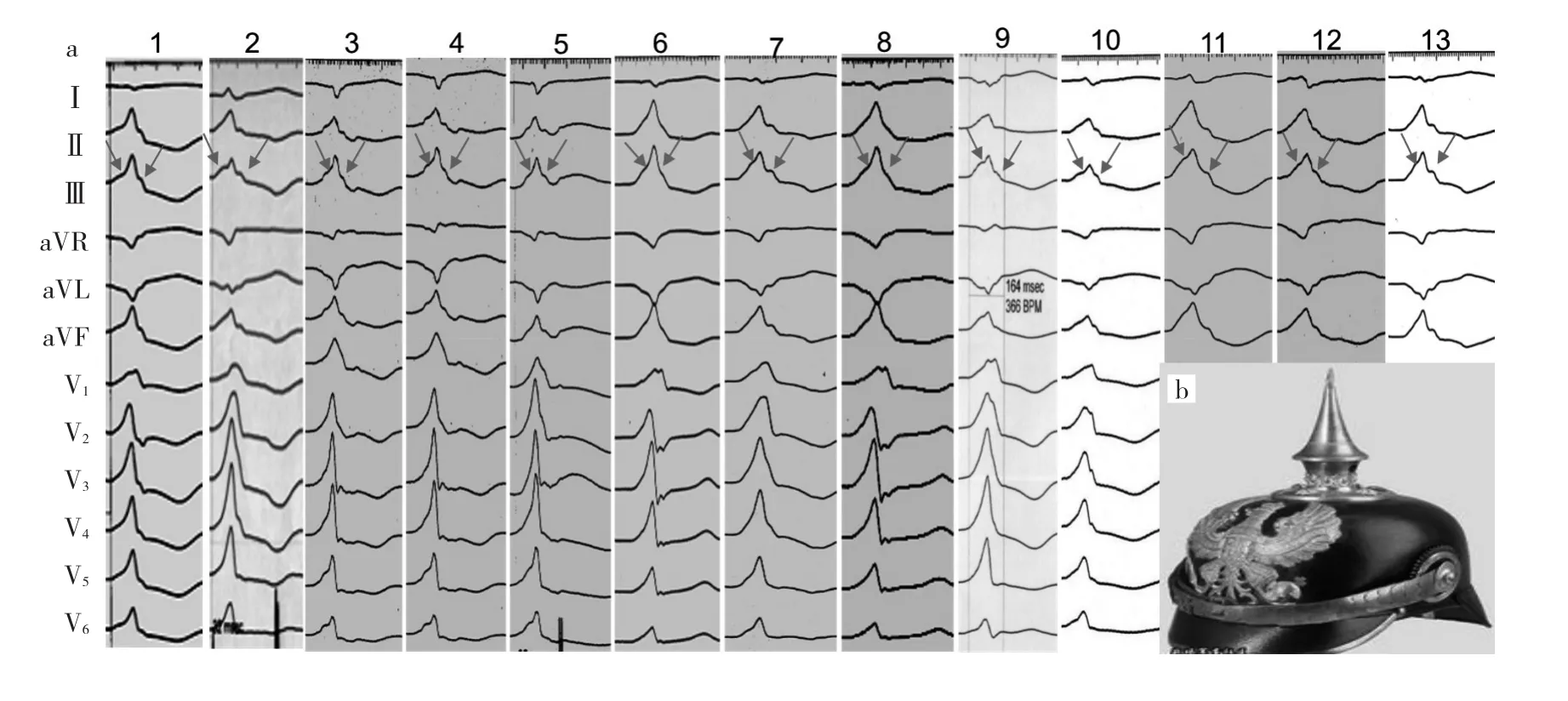
图4 邻近DGCV-PCVs的体表心电图特征(a:13例DGCV-PVCs的体表心电图特征,箭头示RⅢ呈升降支双切迹形态;b:RⅢ呈升降支双切迹形态似德国普鲁士战盔)
2.2 AIV-VAs的心电图特征 下壁呈高大R波,RⅢ>RⅡ;Ⅰ呈qr或rS型;aVL,aVR呈QS型,QSaVL>QSaVR,其比值>1.1,因AIV移行于前室间沟内,靠近V2,故其R波振幅相对偏低,若RV1>RV2,高度提示AIV起源;V5~V6呈R型(无S波);胸导联移行常在V2~V3[7-8]。
2.3 Summit CV-VAs的心电图特征 其起源点在心脏上部且相对偏右;下壁呈R波,RⅡ>RⅢ,aVL和aVR呈QS型;Ⅰ以负向波为主,但在Summit-CV的中远段可呈正向R波(图3),V1呈r波或rs型,r/s比值平均为0.67±0.33;移行区在V3之前;V5~V6呈R型(无S波)[8]。
3 LVS-VAs的标测
激动标测是LVS-VAs的标准方法。因其解剖的特殊性,其标测有心内和外膜途径。此外,其起源可能是心外膜下方的壁内,故也可从LCC、AMC或RVOT等邻近结构消融。Yamada等[9]报道,25%起源于主动脉窦(aortic sinus cusps,ASC)的VAs存在RVOT优先传导,在RVOT起搏比ASC起搏匹配更好,但ASC起搏的SR间期更长,故起搏标测不可靠。故单和(或)双极腔内电图识别“最早”激动点更为重要。
对LVS-VAs标测和消融分两步:(1)仔细分析其12导联心电图,初步确定其起源部位;(2)对起源部位未明者先行RVOT再行LVOT,最后经冠状静脉窦(coronary vein sinus,CVS)标测。在三维电解剖标测系统(Carto,Biosense Webster或 NavX,美国圣犹达公司)指导下行详细的激动标测寻找“最早”激活部位,结合起搏标测寻找合适的靶点。必要时行心腔内超声心动图构建心室和流出道的三维解剖图,与Carto sound模块融合,有助于指导LVS-VAs标测和消融。
近年来随着科技的进步,系统软件、导管及操作技术提高,经验不断积累,手术安全性更高,X线照射时间更短。如Carto Univu模块结合冠状动脉造影(coronary angiography,CAG)可避免CA损伤;而Carto Segmentation可将心脏三维CT重建与电解剖标测结合,并使主动脉根部、冠状血管和LVS可视化,无需重复的CAG。其他如高精密度标测、可调弯鞘等使用,对LVS-VAs标测或导管到位均有良好的辅助作用。
4 LVS-VAs消融
因解剖的特殊性,消融路径也较特殊,可分为心内膜和心外膜途径,前者包括经ROVT和经LOVT心内膜消融;后者包括CVS、冠状动脉窦(coronary arterial sinus,CAS)和心包穿刺途径。考虑LVS-VAs的复杂性,有时单一途径无效,可多种途径相结合进行消融。
4.1 经CVS导管消融 经CVS标测与消融常用两种导管操作方法。(1)传统方法:直接经CS将消融导管送至DGCV行标测和消融(图5a、b)。(2)Swatz鞘支撑法:若导管深入困难可加用R0 Swatz鞘,在消融导管的引导下,从CS口依次进入到达DGCV移行区,行标测和消融(图5c、d)。若上述方法均失败(多数因Vieussens阻挡),但在消融导管引导下R0 Swatz鞘可以进入CS,此时可用其先行冠状静脉造影(图5e),并在其导引下,先将亲水涂层导丝送至DGCV,随后将Judkins L4 CAG导管跟进并行冠状静脉造影(coronary venography,CVG)(图5f);在两者双重引导下将R0 Swatz鞘送达GCV中段,最后撤出亲水涂层导丝及CAG导管,在Swatz鞘支撑下将消融导管送达目标区域(图5g、h)。对可能Summit-CV起源的VAs,其血管管径极细,可尝试2F微导管协助标测[10]。
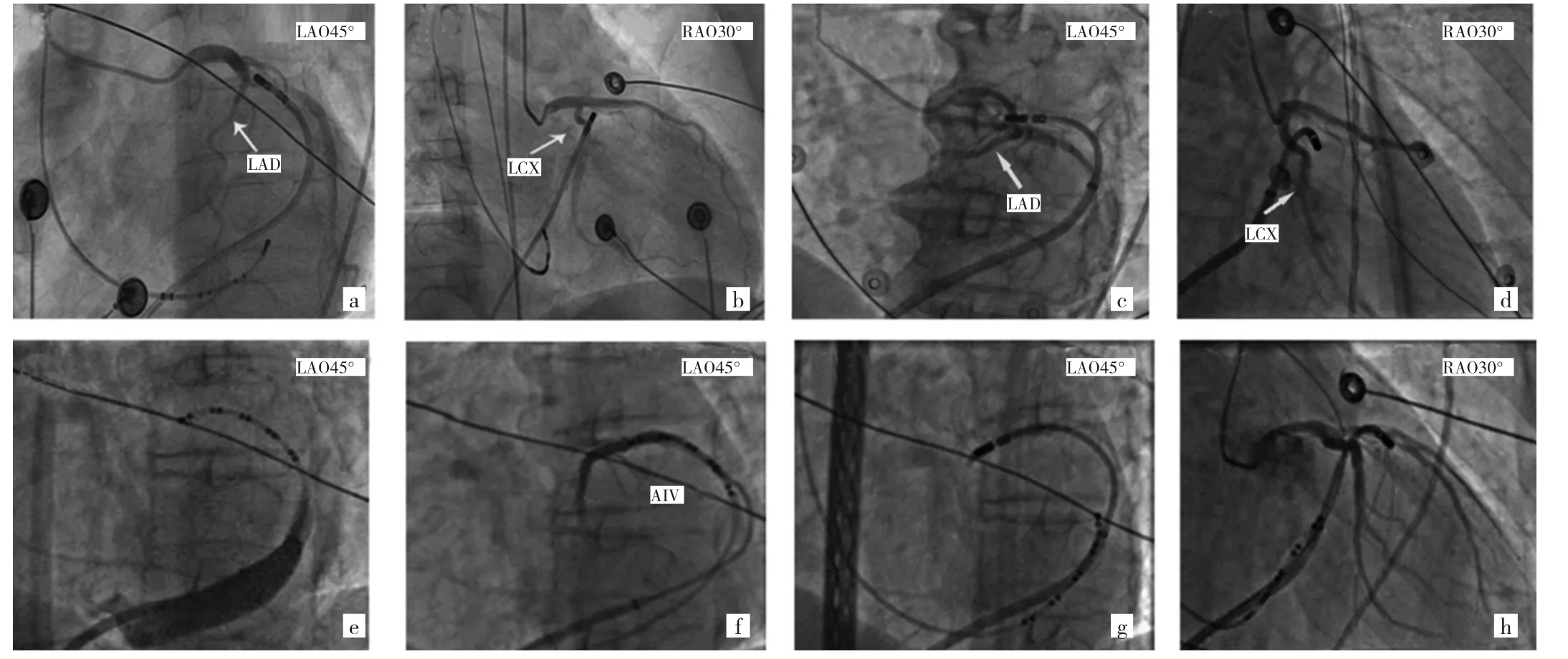
图5 消融导管操作示意图(a-b:导管头端直接从冠状窦口进入DGCV2;c-d:导管头端在GCV内Swatz鞘的支撑下被送入Summit-CV;e:由于Vieussens瓣阻挡,即使有Swatz鞘的支撑,导管也不能到位;f:亲水涂层导丝与Judkins L4导管在Swatz鞘支撑下,通过Vieussens瓣到达DGCV2;g-h:在亲水涂层导丝和Judkins L4导管的引导下,将Swatz鞘交替推进,通过Vieussens瓣,将导丝和Jukins导管与消融导管互换,进行DGCV标测和消融)
理想靶点单极电图呈QS型,双极电图标测到领先的长程多峰碎裂的心室前电位亦提示为潜在消融靶点[11]。对VAs是否壁内起源,可经激动标测结合CVS内冷盐水灌注后若自发VAs一过性消失,提示壁内起源(灵敏度90%,特异度88%)。各研究的领先度不一,一项研究显示47例在CVS内标测到“最早”激动点的领先时间为(-39±18)ms。因存在优势传导现象[12],起搏标测可能受限,即使在心室激动提前很多或成功消融靶点,起搏与自发的VAs形态也未必吻合,故起搏相似度<95%亦可试消融。但笔者的经验是在DGCV移行区起搏,绝大多数相似度≥95%,甚至达99%。近来一些新的标测技术,如心磁图联合CT标测具有非接触、准确度高等特点,当传统标测技术难以锁定靶点时可尝试。少数经心内膜及CVS反复消融失败者,可经剑突下穿刺至心包腔行心外膜标测。
消融前均行CAG,明确靶点与CA的关系,放电过程中连续透视观察消融导管位置,一旦移位,立即停止放电,消融成功后再次行CAG了解其血运状况。此区域阻抗很高,常高于200 Ω,故均选择盐水灌注导管,预设温度43℃,预置能量25~35 W,阻抗300 Ω(如放电困难则关闭),盐水流速30~60 ml/min,有效靶点定义为放电15 s内VAs终止,或放电中出现与自发VAs形态相同的频发室性期前收缩(premature ventricular contractions,PVCs)或短阵室性心动过速(ventricular tachycardia,VT)并很快消失。有效靶点继续放电60~90 s,消融后观察30 min,以VAs消失,电刺激及异丙肾上腺素静脉滴注等不再诱发VAs为消融终点。如试放电15 s后VAs未终止则重新标测。
经CVS行导管消融,了解其解剖结构至关重要,除了Thebesian瓣和Vieussens瓣外,GCV沿二尖瓣环外侧部延伸至其前外侧心外膜处的DGCV,弯曲的GCV形态可能限制导管前行。DGCV在LVS的主动脉瓣尖下方移行为AIV,其与DGCV2的夹角个体差异大。AIV与DGCV2间呈锐角,消融导管不易到达AIV,反之,则易进入AIV。Summit-CV位于DGCV2和AIV之间过渡区远端的主动脉和肺动脉环之间,与LVS的上部密切相关。其管壁很薄,限制了导管的到位和消融。总之,静脉瓣的阻碍、GCV的偏斜、DGCV2和AIV之间的锐角、Summit-CV的薄管壁均是阻碍DGCVAIV VAs导管消融的潜在解剖因素。故任何有助于克服这些解剖障碍的方法均可提高CVS-VAs的消融成功率。
4.1.1 有效靶点腔内双极电图特征[11]笔者对243例心室流出道心外膜不同区域VAs的有效靶点行腔内双极电图观察。根据VAs时有效靶点或“最早”激动点腔内双极电图V波特征、是否存在特殊电位及其时程和振幅,按图6将其定义为以下几种类型:(1)初始短程碎裂电位。(2)初始高幅尖峰电位。(3)长程丛集和稀疏碎裂电位:为多峰碎裂电位,时程占V波时间≥50%。波峰数目>5个,最大间距<2 mm为丛集碎裂电位;波峰数目≤5个,最大间距≥2 mm为稀疏碎裂电位。(4)前序尖峰电位:为V波前的尖峰(单峰)电位,与V波间有等电位线。上述特殊电位波幅≤2 mm为低幅电位,而>2 mm为高幅电位,可伴或不伴电位翻转(窦性心律时特殊电位在V波后部,PVC时翻转至V波之前)。结果发现不同区域VAs有效靶点腔内双极电图特殊电位的类型有差异:LVS组高幅长程丛集或稀疏碎裂电位明显高于PSC及ASC组,ASC组初始短程碎裂电位明显高于LVS及PSC组,PSC组初始高幅尖峰或多峰电位明显高于LVS及ASC组,PSC组伴电位翻转明显高于ASC及LVS组(均P<0.05)。
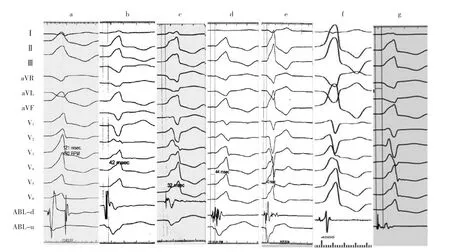
图6 双极腔内电图(a:初始短程低幅碎裂电位;b:初始短程高幅碎裂电位;c:初始高幅尖峰电位;d:初始长程丛集碎裂电位;e:初始长程稀疏碎裂电位;f:前序低幅尖峰电位;g:前序高幅尖峰电位)
4.1.2 CVS不同部位阻抗变化及高阻抗处理策略 因CV主支(从Cs至DGCV)的管腔内径较大,血流速度较快,消融时不易产生较高的阻抗。研究发现,按DGCV1→DGCV2→AIV和Summit-CV顺序,其对应的阻抗依次递增。随着CV向远端移行,管腔直径递减而阻抗递增,CV分支放电后局部阻抗快速攀升,难以达到额定功率,无法完成透壁消融并影响成功率[13]。
笔者的研究显示,CVS的阻抗受其部位、初始阻抗、盐水流速和消融仪不同等诸多因素的影响。试消融前(盐水流速30~60 ml/min)均较初始(盐水流速2 ml/min)阻抗明显下降,且初始阻抗越高,降幅越大。此外,在使用同种消融仪而盐水流速不同时,其阻抗降幅随盐水流速的增加而递增;反之,盐水流速相同而消融仪不同时,SES组(Stockert ep shuttle,美国强生公司)的阻抗均高于T11组(IBI-1500T11,美国雅培公司),两者差值40~60 Ω。
经CVS消融首选盐水灌注消融导管,其能更均匀冷却消融导管,有效提高功率输出并减少血栓形成。动物研究发现,在心外膜采用4 mm的盐水灌注导管较普通导管能产生更深的心肌损伤[(6.7±1.7)mm比(3.7±1.3)mm,P<0.05][14]。消融采用温控模式,功率设置为25~35 W,电极-心肌组织温度范围为43~60℃,盐水流速为15~60 ml/min。此外,术中采用下列处理策略,对降低阻抗,提高放电率、放电能量及消融成功率有裨益:(1)重置消融仪上限阻抗为300 Ω;(2)盐水流速增至30~60 ml/min;(3)上述处理后若放电前阻抗仍>300 Ω,或可降至300 Ω以下,但放电后迅速攀升>300 Ω,且难以持续放电,则关闭阻抗;(4)若阻抗仍高,放电困难,则将消融仪由SES更换为T11,并重复上述各种方法进行试消融;(5)盐水由泵注改为手推,以加快灌流速度;(6)若经上述方法可持续放电,但能量释放<15 W且无效,则上调消融仪温度至45℃甚至更高(笔者在术中最大温度设置为48℃)。
4.1.3 放电时注意事项 (1)CVS解剖结构复杂,管壁较薄且毗邻CAS,其分支因静脉较细并有更多的弯曲,直接放置消融导管较困难,多数需Swatz鞘支撑及CVG引导方可到位。(2)因消融导管的直径与DGCV及分支类似,血流缓慢,阻抗很高,是降低有效放电及消融成功率的重要因素。(3)试消融靶点的选择与RVOT起源VAs相似,除注意心室电位领先程度(一般≥30 ms)外,应选择小A大V(A∶V≤1∶1,但DGCV因其前方毗邻左心耳,靶点常呈大A小V),起搏标测匹配良好,其相似度≥95%。(4)因CV管壁较薄且毗邻CA,标测与消融时易损伤CA,或静脉破裂导致心包压塞的风险,操作宜轻柔。(5)Swatz鞘需在消融导管的引导下移动,以防CV穿孔致心包压塞。(6)消融时应注意是否有胸痛等症状或心电监护提示ST段抬高,需警惕CA损伤、痉挛或血栓栓塞。
4.2 心内膜导管消融 Yamada等[14]发现部分VAs的起源点可能在LVOT壁内,故需在DGCV靶点相对应的心内膜消融,特殊情况下需心内、外膜双导管同步或双极消融才能成功,以心内、外膜靶点间距离>8 mm和消融部位的V-QRS<-30 ms预测需心内、心外膜同时消融的灵敏度与特异度分别为100%、80%与88.9%、100%;并提出了“解剖消融”的概念[14],即在“最早”激动部位消融失败或激动领先位置不安全时,可对其毗邻部位进行“解剖消融”。
4.2.1 经RVOT消融 Frankel等[15]报道2例起源于AIV患者,因距LAD较近,放电风险大,最终在RVOT后部成功消融;Vaseghi等[16]认为消融靶点在RVOT后部,尤其是在肺动脉瓣下2~3 cm时,消融时应反复造影监测导管与LAD的距离,避免损伤LAD。
4.2.2 经LCC与AMC消融 因LCC、AMC与LVS特殊的毗邻关系,故其可作为消融LVS-VAs首选的替代靶点。Jauregui等[17]报道16例LVS-VAs患者,9例在GCV、AIV内激动标测提早明显,但距LAD较近(<10 mm),随后在LCC及AMC消融成功,且后期随访VAs完全消失。同时发现当LCC或AMC的“最早”激动点与GCV/AIV的“最早”激动点距离<13.5 mm时,可经LCC或AMC消融成功。因经主动脉逆行达LCC较容易,但跨主动脉瓣到AMC理想靶点较困难,故Ouyang等[18]采用静脉穿房间隔跨二尖瓣“反S”弯成功消融16例LVS-VAs。
4.2.3 经皮心外膜消融 对经心内膜、CVS等消融LVS-VAs失败,且考虑心外膜起源时,可行经皮心外膜导管消融,但较厚的脂肪层及增大的左心耳均影响其成功率。Yamada等[19]报道20例经皮心外膜消融患者,以DGCV为界将LVS分为近基底和近心尖部,结果6例近心尖部均成功消融,14例近基底部因邻近CA且有脂肪覆盖而放弃消融。Santangeli等[3]报道23例患者即刻成功5例,18例因同样原因失败。此方法并发症较高,Killu等[20]报道心包出血12.7%、心包压塞6.6%、慢性复发性心包炎7.2%、胸膜损伤1.7%和膈神经损伤0.7%。
4.2.4 心腔内超声(intracardiac echocardiography,ICE)指导下导管消融 对于心脏结构畸形或有外科手术史的LVS-VAs者,ICE引导下的三维电解剖标测系统的辅助导管消融是个好帮手。Rivera等[21]在零射线下消融26例LVS-VAs患者,即刻成功84%,消融部位以DGCV最多见,其次是PSC、ASC及AMC,随访3个月24%复发。
4.2.5 乙醇消融 主要方式有3种:(1)经CAS乙醇消融,Tokuda等[22]报道27例VT行经CA无水乙醇消融,成功10例(36%),7例(27%)得到控制。(2)经CVS乙醇消融:Tavares等[23-24]对53例LVS-VAs行靶静脉酒精消融。术中CVG确定了支配LVS的静脉:①DGCV的LV环状支(19/53);②AIV间隔分支(53/53);③AIV对角分支(51/53)。消融靶静脉分别为AIV间隔支38例、DGCV环状支6例和AIV对角支2例。结果显示CVS酒精消融治疗LVS-VAs是可行的,尤其适合于病灶位于消融导管难以抵达区域者。(3)经胸心肌内直接注射乙醇消融,Gurukripa等[25]采用混合入路方式,经CVS及CAS标测到LVS不可达区域最早靶点,但消融失败,后经正中胸骨切开,心外膜标测证实LAD-D1分叉处“最早”。用穿刺针直达该区域6 mm深的心肌,确定为“最早”激动点后,并向心肌注射3 ml乙醇后VAs消失。为不可达区LVS-VAs的治疗提供了新的方法。
4.2.6 0.45%氯化钠溶液灌注导管消融 当病灶起源点位于心肌深层时,常规使用0.9%氯化钠溶液,其含高浓度的Na+,可在消融导管周围创造低阻抗环境及能量传导降低,不能将组织永久性损伤。动物模型显示在消融时降低离子浓度和电荷密度使组织损伤的深度增加。Nguyen等[26]用0.45%氯化钠溶液对94例0.9%氯化钠溶液消融失败的VAs进行消融,成功78例(83%),后期随访均未复发。
4.2.7 经CAS导丝消融及弹簧圈填塞 当心内膜和心外膜消融均无效时,可尝试经CAS消融。将冠状动脉介入导丝送至CA心肌深层,标测到“最早”激动点后将导丝尾端与消融电极相接,消融后可终止VAs;或找到靶血管后用冠状动脉微导管将弹簧圈完全填塞靶血管而终止VAs。
4.2.8 经CVS导丝消融 PCI导丝不仅能经CAS消融LVS-VAs,也可经CVS消融。Michael等[27]报道2例Vision导丝经CVS对LVS-VAs成功消融病例,将导丝分别通过远端GCV/AIV或隔膜穿支,到达LVS心外膜靶点,使用低能量(10~20 W),持续(20~30 s)消融成功。Xuan[28]等报道1例用PCI导丝消融LVS-VAs,其经微导管调节导丝位置,标测时导丝尾端与V1相连接,记录单极电位,消融时微导管末端与高压盐水泵连接实现盐水灌注并消融成功。这种消融方法虽存在导丝头端焦痂等问题,但对难治性LVS-VAs的治疗是一种很好的补充。
4.2.9 单极和双极导管消融 单极消融:经心内膜和对应的心外膜,同时单极消融心肌深部的靶点,因同时产生两个阻抗热,可提高消融靶点温度并取得理想的效果。Yang等[29]报道6例患者标测定位VAs均起源于心肌深部,前期经提高功率、延长消融时间等均失败。改用内外膜单极同时消融,即刻均成功,平均随访20个月,无复发4例(67%)。
与单极消融类似,双极消融时两根盐水灌注导管分别为正负极,放电时电流经导管之间组织产生透壁损伤。Nguyen等[30]对14例其他方法无效的LVS-VAs患者采用双极消融,即刻成功13例,术后随访14个月,未复发7例。虽双极消融可产生更集中、更深的损伤灶,但风险更高。随着消融技术的提高,在考虑经济因素的基础上,笔者常用单导管经不同路径夹击消融,且效果理想。
4.2.10 针式导管消融与冷冻导管消融 针式导管因其头端有可伸缩的针头,故主要用于深部心肌起源VAs的消融。Stevenson等[31]对31例LVS-VAs患者采用此方法消融,26例VT中有19例(73%)至少消融成功1种,5例PVC成功4例,随访6个月,48%无复发,19%发作次数明显减少。William等[32]报道采用冷冻导管经CVS对2例LVS-VAs患者行消融,术后1个月随访无复发,术后3年随访无相关症状。
4.2.11 经左心耳消融 左心耳解剖位置特殊,覆盖部分LVS,故经其消融LVS-VAs有解剖学基础,但因其形状、大小不同,覆盖范围亦异。Kuniewicz等[33]经双源CT扫描示其覆盖75%的LVS,约196.08 mm2,垂直距离为 5.14 mm(1.45~10 mm)。Yakubov等[34]报道1例曾行RVOT后壁、LCC和DGCV消融均失败病例,最终于左心耳的心室侧消融成功。Daniel等[35]报道在左心耳尖部消融终止LVS-VAs病例。但此技术难度较大,有较高的心包积液/心包压塞风险,故消融前需完善相关检查,术中应在ICE指导下确定左心耳与CA和LVS的毗邻关系。
4.2.12 外科手术消融 目前相关报道均为复合手术时采用,且为个案,手术方式也不尽相同,有此前介绍的直接心肌注射乙醇消融,也有内镜下机器人消融或开胸后结合射频或冷冻导管消融,与经心包心外膜标测比较,直视化的手术可选择最佳解剖定位和导管贴靠。
5 小结
本文从LVS的解剖、心电图特点、标测和消融方法进行了系统性的阐述。目前对LVS-VAs的消融主要有心内膜和经CVS心外膜导管消融,但因后者较复杂,故在文中结合笔者团队经验详细阐述了此方法具体操作及相关技术。随着材料、导管技术的进步和对LVS-VAs认识的进一步加深,近年来经CVS或CAS乙醇消融、经左心耳消融、高精密度标测的应用,不论其机制的研究或诊治方法均有长足的进步。但目前对LVS-VAs的相关研究均为小样本或个案报道,各种消融方法的安全性、有效性仍待明确,今后仍需大规模、多中心、前瞻性的研究予以阐明。
(本文由浙江省医学会推荐)
——导丝概述及导丝通过病变技巧

