circPTK2调控miR-619-5p对食道癌细胞侵袭迁移的影响
付堂清, 李文忠, 罗仕云, 师 路, 杜镇鸿
(三六三医院胸外科, 四川 成 都 610041)
食道癌(Esophageal cancer,EC),也被称为食管癌,是一种恶性肿瘤,发病率和病死率均较高[1]。鳞状细胞癌和腺癌是EC的两种主要的组织病理亚型[2]。关于食管癌的各种治疗策略已被开发,包括内窥镜技术、外科治疗、全身化疗和免疫疗法[3,4]。近年来的研究强调了分子靶点在EC个体化治疗和早期诊断中的重要意义。非编码RNA(ncRNAs)包括非编码环状RNA(circRNAs)和microRNAs(miRNAs)是当前EC研究的热点。CircRNAs可以特异性结合miRNAs,从而发挥基因的间接调控作用,促进或抑制EC的进展。例如,circ_0023397通过靶向miR-106b抑制EC细胞的增殖[5],而circ_0004370/miR-1294/LASP1轴被发现能够促进EC的发育过程[6]。据报道,hsa_circ_0005273(circPTK2)在结直肠癌中作为肿瘤启动子[7],而hsa_circ_0008305(circPTK2)在非小细胞肺癌中作为肿瘤抑制子[8]。尽管circPTK2在多种癌症中的生物学功能已被证实,但circPTK2在EC中的具体作用仍不清楚。miR-619-5p已被证实为口腔鳞状细胞癌[9]的肿瘤抑制因子,但是miR-619-5p在EC中的表达和作用尚不明确。本研究将主要研究circPTK2和miR-619-5p在EC中的生物学功能及调控机制,为肿瘤发生机制提供更深层次的理解,并为EC的治疗提供潜在的靶点。
1 材料与方法
1.1实验材料:circPTK2的小干扰RNA(si-circPTK2)和siRNA阴性对照(si-NC)、miR-619-5p mimic(miR-619-5p)和阴性对照(miR-NC)、miR-619-5p inhibitor(anti-miR-619-5p)和阴性对照(anti-NC)、慢病毒包被的circPTK2质粒(LV-circPTK2)和阴性对照(LV-NC)、circPTK2的短发夹RNA(sh-circPTK2)和阴性对照(sh-NC)、生物素偶联miR-619-5p mimic(Bio-miR-619-5p)和阴性对照(Bio-miR-NC)均购自RIBOBIO。RPMI-1640培养基、胎牛血清购自美国Sigma-Aldrich;Lipofectamine 3000试剂、TRIzol购自美国Invitrogen公司;SuperScriptTM IV第一链合成系统、SYBR Green一步法qPCR试剂盒、链霉亲和素磁珠购自美国Thermo Fisher公司;细胞计数盒-8(CCK-8)购自北京科硕生物技术有限公司;Transwell室购自美国康宁公司;RIPA裂解缓冲液购自上海远慕生物科技有限公司;一抗anti-E-cadherin、anti-N-cadherin、anti-Vimentin、anti-GAPDH和山羊抗兔IgG H&L(HRP)二抗、ECL Western Blotting底物试剂盒购自美国ABCam公司;双荧光素酶报告基因检测试剂盒购自翌圣生物公司。酶标仪购自美国伯乐公司;倒置显微镜购自日本Olympus。
1.2组织获取和细胞培养:51例EC患者在本院接受手术治疗。接受化疗、放疗或其他治疗的患者被排除在本研究之外。收集的EC组织(n=51)和正常的癌旁组织(n=51)保存在-80℃。已获得所有EC患者的书面知情同意书。本研究经本医院伦理委员会批准。人食管上皮细胞系(HEEC)和EC细胞系(OE19、KYSE-450、KYSE-520和TE-13)购自北纳生物。RPMI-1640培养基添加10%胎牛血清以维持上述细胞生长。培养环境为37℃、5% CO2的潮湿空气中。
1.3细胞转染与分组:使用20nmoL/L的siRNA或抑制剂和50nmoL/L的模拟物进行细胞转染。将TE-13细胞接种于96孔板过夜,然后用Lipofectamine 3000试剂转染1.1中的寡核苷酸或载体,并分组为对照组、si-NC、si-circPTK2组、miR-NC组、miR-619-5p组、si-circPTK2+anti-NC组和si-circPTK2+anti-miR-619-5p组。
1.4qRT-PCR检测EC组织和细胞内circPTK2和miR-619-5p的表达:用TRIzol试剂从组织和细胞中纯化RNA。通过SuperScript IVSuperScriptTM IV第一链合成系统逆转录后,根据使用说明采用SYBR Green一步法qPCR试剂盒进行表达检测。引物序列为:circPTK2为5’-AATGCCTGTGAACCCATAGTG-3’(正向引物)和5’-CTGACAGCATGAGCATCCCT-3’(反向引物);miR-619-5p为5’-GGGGGTCCCCGGTGCT-3’(正向引物)和5’-AGTGCAGGGTCCGAGGTATT-3’(反向引物);GAPDH为5’-GAAGGTGAAGGTCGGAGTC-3’(正向引物)和5’-GAGATGGTGATGGGATTTC-3’(反向引物);U6为5’-ATTGGAACGATACAGAGAAGATT-3’(正向引物)和5’-GGAACGCTTCACGAATTTG-3’(反向引物)。GAPDH作为circPTK2的内参。U6为miR-619-5p的内参。最后,用2-ΔΔCT法进行相对表达分析。
1.5CCK-8评估TE-13细胞活力:TE-13细胞转染48h后,96孔板每孔移入10μL CCK-8试剂;4h后,在酶标仪上450nm处检测吸光度,以实验组与对照组的吸光度百分比表示细胞活力(%)。
1.6Transwell检测TE-13细胞侵袭、迁移:上室接种1×104个TE-13细胞(转染24h后),下室加入含10%胎牛血清的RPMI-1640培养液,24h后小心擦去未迁移的细胞,用4%多聚甲醛固定和结晶紫染色。Transwell上腔涂布基质后进行细胞侵袭检测;将1×105个TE-1细胞接种到上腔室,按照迁移试验的步骤进行后续处理。倒置显微镜下保存100倍镜下细胞图像,计数迁移或侵袭细胞。
1.7Western blot检测EC组织和细胞内上皮间充质转化(EMT)相关蛋白表达:用放射免疫沉淀法(RIPA)裂解缓冲液提取总蛋白;用SDS-PAGE分离40μg总蛋白,然后将蛋白质转移到PVDF膜上。用5%脱脂牛奶孵育膜,以阻止非特异性蛋白信号之间的结合,然后在4℃条件下孵育一抗过夜。使用的一抗如下:anti-E-cadherin、anti-N-cadherin、anti-Vimentin、anti-GAPDH。将PVDF膜与山羊抗兔IgG H&L(HRP)二抗在室温下孵育;1h后,使用ECL Western Blotting底物试剂盒显影。用Image Lab软件进行蛋白表达分析。
1.8双荧光素酶报告实验证实circPTK2与miR-619-5p的关系:将含有miR-619-5p结合位点的circPTK2 3’-非翻译区(3’ UTR)的序列克隆到基础荧光素酶表达质粒pGL3-control中,构建野生型荧光素酶质粒。野生型荧光素酶质粒命名为WT-circPTK2。此外,突变体circPTK2 3’ UTR序列(包含miR-619-5p结合的突变位点)被插入到pGL3-control中,以产生突变型(MUT)荧光素酶质粒(MUT-circPTK2)。TE-13细胞分别用上述质粒与miR-NC或miR-619-5p在37℃下转染48h。使用双荧光素酶报告基因检测系统测量荧光素酶活性。
1.9生物素偶联miRNA pull-down试验:分别将Bio-miR-619-5p和Bio-miR-NC转染TE-13细胞48h后,将细胞裂解,在4℃条件下与链霉亲和素磁珠孵育16h,提取磁珠结合的总RNA,采用qRT-PCR检测circPTK2的相对水平。
1.10荷瘤裸鼠实验观察TE-13细胞在体内的抗瘤能力:将6周龄雄性BALB/c裸鼠,购自长春生物制品研究所有限责任公司,许可证号:SYXK(吉)2017-0005。实验分为5组(每组6只):对照组、sh-NC组、sh-circPTK2组、sh-circPTK2+anti-NC组、sh-circPTK2+anti-miR-619-5p组。稳定转染sh-NC、sh-circPTK2、sh-circPTK2+anti-NC、sh-circPTK2+anti-miR-619-5p后,将1×106个TE-13细胞重悬于100μL磷酸盐缓冲液中,皮下注射裸鼠。每周用数字卡尺测量肿瘤的长和宽,肿瘤体积计算公式为:长×宽2×0.5。5周后处死裸鼠,用电子秤称肿瘤重量。本实验经本医院动物伦理委员会批准。裸鼠的所有实验均符合美国国立卫生研究院实验室动物护理和使用指南。

2 结 果
2.1circPTK2和miR-619-5p在EC组织和细胞系中的表达:与正常的癌旁组织和HEEC细胞相比,circPTK2水平在51个EC组织和4个细胞系(OE19、KYSE-450、KYSE-520、TE-13)中明显升高,miR-619-5p在51个EC组织和4个细胞系(OE19、KYSE-450、KYSE-520、TE-13)中明显降低(P<0.05),见表1、表2。后续研究采用TE-13细胞(circPTK2表达量高于其他三种EC细胞系)。

表1 qRT-PCR测定正常组织与EC组织中circPTK2和miR-619-5p的表达
2.2miR-619-5p过表达抑制了EC细胞的生长、侵袭、迁移和EMT:与对照组和miR-NC组比较,miR-619-5p组TE-13细胞中的miR-619-5p水平显著升高,细胞活力显著下降,侵袭和迁移细胞数目明显减少,E-cadherin的表达显著增高,N-cadherin和Vimentin的表达显著降低(P<0.05),见图1、图2、表3。

表2 qRT-PCR测定HEEC与EC细胞系中circPTK2和miR-619-5p的表达

图1 miR-619-5p上调对EC细胞侵袭、迁移的影响
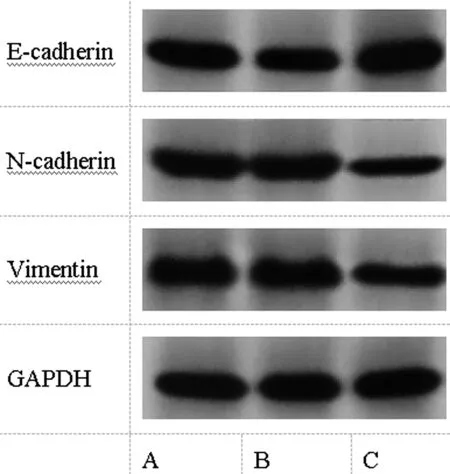
图2 Western blot检测EC细胞中EMT蛋白标记物水平
2.3circPTK2通过海绵吸附降低miR-619-5p的水平:生物信息学分析显示了circPTK2和miR-619-5p序列之间的结合位点(图3)。双荧光素酶报告实验显示,miR-619-5p+WT-circPTK2组的荧光素酶活性明显低于miR-NC+WT-circPTK2(P<0.05),而miR-619-5p+MUT-circPTK2组的荧光素酶活性与miR-NC+MUT-circPTK2组无显著差异(P>0.05),见表4。同时,circPTK2可被miR-619-5p在生物素偶联miRNA下拉实验中捕获(P<0.05),见表5。此外,si-circPTK2组的miR-619-5p表达增高,LV-circPTK2组的miR-619-5p表达降低(P<0.05),见表6。

表3 转染miR-619-5p对EC细胞生长侵袭迁移及EMT蛋白标记物的影响
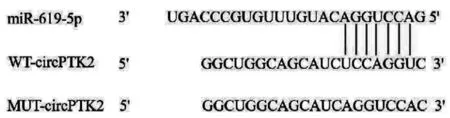
图3 circPTK2和miR-619-5p的结合位点

表4 双荧光素酶报告实验分析circPTK2和miR-619-5p的交互

表5 pull-down实验分析circPTK2和miR-619-5p的交互

表6 qRT-PCR测定各组TE-13细胞中miR-619-5p的表达
2.4miR-619-5p抑制剂逆转了si-circPTK2的抗肿瘤作用:与对照组和si-NC组比较,si-circPTK2组TE-13细胞中circPTK2的水平显著降低,细胞活力显著下降,侵袭和迁移细胞数目明显减少,E-cadherin的表达显著增高,N-cadherin和Vimentin的表达显著降低(P<0.05);与si-circPTK2组和si-circPTK2+anti-NC组比较,si-circPTK2+anti-miR-619-5p组TE-13细胞中的miR-619-5p水明显降低,细胞活力显著增高,侵袭和迁移细胞数目明显增多,E-cadherin的表达显著下降,N-cadherin和Vimentin的表达显著升高(P<0.05),见图4、图5、表7、表8。
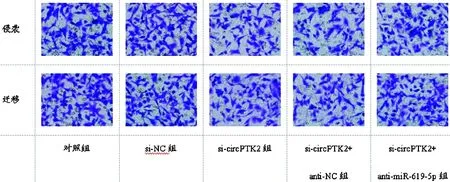
图4 si-circPTK2和anti-miR-619-5p共转染对EC细胞侵袭、迁移的影响
表7 si-circPTK2和anti-miR-619-5p共转染对EC细胞生长侵袭迁移的影响

表8 si-circPTK2和anti-miR-619-5p共转染对EC细胞中EMT蛋白标记物的影响
2.5circPTK2和miR-619-5p对EC在体内肿瘤发生的影响:sh-circPTK2组肿瘤体积(第3、4、5周)和重量均较sh-NC组和对照组减轻,sh-circPTK2+anti-miR-619-5p组肿瘤体积(第3、4、5周)和重量较sh-circPTK2组和sh-circPTK2+anti-NC组增高(P<0.05),见表9。

表9 sh-circPTK2和anti-miR-619-5p影响EC在体内的肿瘤发生

图5 Western blot检测EC细胞中EMT蛋白标记物水平
3 讨 论
CircRNAs的共价闭合环结构使其比传统的线性RNA更稳定地对抗RNase和外切酶,能够长时间发挥其生物学功能[10]。近年来,高效测序和生物信息学分析技术的发展促进了circRNAs的鉴定和功能研究。已有研究证实许多circRNAs的异常表达作为肿瘤抑制或启动子参与了EC[11]等多种癌症的发生发展。在本研究中,circPTK2在临床EC组织和体外培养的EC细胞系中显著上调。与该结果一致,circPTK2在多种人类恶性肿瘤(如口腔鳞状细胞癌[9]和胃癌[12])中作为生物活性的调节因子。此外,本研究通过功能缺失实验探究了circPTK2的生物学作用。结果表明,在EC中下调circPTK2导致细胞活力、侵袭、迁移和EMT过程受到显著抑制。这些结果均证实circPTK2在EC中表达上调,并作为一种致癌分子发挥作用。
在众多的miRNAs中,miR-619-5p在癌症中得到了新的关注。以往的研究表明,miR-619-5p在肿瘤进展中的功能不同。例如,miR-619-5p通过靶向ATXN3抑制口腔鳞癌的增殖,增强顺铂耐药性[9],而在胶质瘤中miR-619-5p过表达促进细胞增殖和迁移并抑制凋亡[13]。miR-619-5p在不同癌症中功能不一致的原因可能是由于癌细胞的不同类型导致的。本研究发现miR-619-5p在EC组织和细胞中表达下调,其过表达可抑制EC细胞侵袭、迁移和EMT过程。提示miR-619-5p在EC中作为抑癌分子发挥作用。
大量研究表明circRNA在包括EC在内的各种癌症中可作为miRNA的分子海绵。例如,circ_0006168作为miR-384的海绵,促进EC的发展[14];circ_0000554沉默可通过海绵吸收miR-485-5p下调FERMT1抑制EC进展,增强细胞的放射敏感性[15]。本研究的生物信息学分析推测了circPTK2与miR-619-5p之间的结合位点。然后,通过miRNA pull-down实验和荧光素酶报告基因检测确认它们之间的结合能力。而且,circPTK2与miR-619-5p呈负调控。此外,拯救实验显示,miR-619-5p的衰减可以逆转circPTK2下调介导的EC细胞增殖、侵袭、迁移效应。并且,miR-619-5p缺失可部分恢复circPTK2下调对体内EC瘤体生长的抑制作用。
本研究首次提供了circPTK2/miR-619-5p轴调控EC进展的证据。然而,本研究仍存在一些局限性。首先,可以通过更多的实验来验证这些结果:例如通过MTT法或5-乙基-2-脱氧尿苷(Edu)法进一步证实circPTK2对细胞增殖的影响;为了探索circPTK2的调控机制,可以通过免疫荧光检测来确定circPTK2的亚细胞定位。众所周知,circRNA可能在多种癌症的发展过程中作为一种竞争性的内源性RNA(ceRNA)。因此,还需要进一步开展实验,进一步研究circPTK2在EC进展过程中可能存在的ceRNA网络。
综上所述,circPTK2在EC中上调,miR-619-5p下调,circPTK2通过下调miR-619-5p促进EC进展,提示在EC中发现了一种新的调控机制。这些发现可能为启发新的EC分子诊断和治疗策略提供科学依据。

