芒柄花苷经AMPK/SIRT1/FoxO1通路对2型糖尿病肾病大鼠肾损伤的改善作用
姚 艺, 李艳丽, 丁洪成, 陈思思
(湖北省十堰市人民医院/湖北医药学院附属人民医院内分泌科, 湖北 十堰 442000)
糖尿病肾病(Diabeticnephropathy,DN)作为2型糖尿病(T2DM)的主要微血管并发症之一,35%~40%的T2DM患者合并DN,是导致终末期肾病(End stage renal disease,ESRD)的关键因素。虽然严格控制血糖和血压水平可以延缓DN的发生和进展,但这些措施并不能完全防止T2DM患者发展为肾衰竭[1]。因此,开发预防和治疗DN的新药至关重要。在糖尿病状态下,肾小球系膜细胞增殖,伴随着肾小球肥大,逐渐导致细胞外基质(Extracellular matrix,ECM)沉积在肾小球系膜区,这导致纤维化成分如纤连蛋白(Fibronectin,FN)和细胞间黏附分子-1 (Intercellular adhesion molecule-1,ICAM-1)的进行性积累,并发展为肾纤维化[2]。在糖尿病的病理状态下,高水平的葡萄糖刺激细胞产生大量活性氧(Reactive oxygen species,ROS),活性氧激活下游多种信号通路,从而诱导和加速肾纤维化的发生[3]。因此,抑制氧化应激能有效预防糖尿病肾纤维化进展。芒柄花苷是黄芪、甘草、红芪等多种中药的主要活性成分,具有抗氧化活性[4]。研究表明,芒柄花苷通过上调沉默信息调节因子-1(Silent information regulator -1,SIRT1)的表达来改善肝胆汁淤积[5]。但芒柄花苷改善DN的研究较少。腺苷酸活化蛋白激酶(AMP activated protein kinase,AMPK)/SIRT1通路是细胞内重要的抗氧化通路,AMPK和SIRT1可以协同作用,通过叉头盒蛋白O1 (Forkhead box protein O1,FoxO1)介导的氧化应激和自噬调节糖尿病引起的肾脏损伤。因此,芒柄花苷可能与AMPK/SIRT1/FoxO1通路介导的DN调控有潜在的联系。因此,本研究探讨芒柄花苷对DN大鼠肾损伤的改善作用,并探讨其潜在机制,为芒柄花苷治疗DKD提供理论依据。
1 材料与方法
1.1实验动物:清洁级雄性SD大鼠50只,体质量250±00g,购自上海杰思捷有限公司,动物生产许可证号:SCXK(沪)2017-0005,在温度(23±2)℃、湿度(40~70)%、12h昼夜节律的环境中自由进食和饮水,适应性喂养一周后进行实验。
1.2主要试剂与仪器:芒柄花苷、二甲双胍(美国Sigma公司,货号:4636、2197);盐酸片(中美上海施贵宝制药有限公司,货号:201702123);链脲佐菌素(美国Sigma公司,货号:S0103);苏木素染色液和Masson染液(上海碧云天生物技术研究所);超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(GSH-PX)和丙二醛(Malondialdehyde,MDA)检测试剂盒(南京建城生物工程有限公司);蛋白抽提试剂盒(武汉博士德生物工程有限公司);AMPK、SIRT1、FoxO1、FN、微管相关蛋白1轻链3B(Microtubule-associated protein1 light chain3B,LC3B)、β-actin和山羊抗鼠IgG二抗(美国Santa Cruz公司);AU5800型全自动生化分析仪(美国贝克曼库尔特);JT-12K 型脱水机(武汉俊杰电子有限公司); RM2016型病理切片机(德国Leica公司);CX-21型普通光学显微镜(日本OLYMPUS公司);HBS-1096B型酶标仪(南京德铁实验设备有限公司);电泳仪(北京市六一仪器厂);MicroPublisher成像系统(美国Q-IMAGING公司)。
1.3分组及造模:选50只成年雄性SD大鼠均分为阴性对照组、模型组、芒柄花苷低剂量组、芒柄花苷高剂量组和阳性对照组。阴性对照组大鼠腹腔注射柠檬酸缓冲液(1mL/100g),其余各组大鼠腹腔注射链脲佐菌素(30mg/kg),72h后测大鼠血糖,血糖>16.7mmoL/L表示造模成功。芒柄花苷低剂量组和芒柄花苷高剂量组大鼠分别灌胃给予芒柄花苷,剂量分别为50mg/kg和200mg/kg[6],阳性对照组灌胃给予二甲双胍(250mg/kg)[7],对照组和模型组灌胃给予等量生理盐水,持续16周。实验结束时心脏取血,分离血清,自动生化分析仪测定血尿素氮(Blood urea nitrogen,BUN)、血清肌酐(Serum creatinine,Scr)和血糖水平。分离肾脏,右肾置于福尔马林溶液中国保持,左肾置于液氮中保持。
1.4大鼠肾脏组织形态学检查:右肾组织经脱水、包埋、切片(3μm),进行苏木精-伊红(HE)和Masson染色,用显微镜观察肾组织学变化。
1.5肾组织中SOD、GSH-PX和MDA水平的检测:取部分冻存肾组织,用预冷生理盐水冲洗3次,制成匀浆,按1mL/100mg的比例加入生理盐水,离心取上清,然后将相应一抗稀释至10μg/mL,加入到96孔板中(0.1mL/孔),过夜(4℃),洗涤3次,加上清液(0.1mL)于上述反应孔中,37℃孵育(1h);加入新配置相对应的二抗(0.1mL/孔),孵育(1h);加入新配置的3,3',5,5'-四甲基联苯胺底物溶液(0.1mL/孔)进行显色(20min);加入硫酸(0.05mL)终止反应,于450nm处测各孔吸光度(A)值,计算肾组织中SOD、GSH-PX和MDA水平。
1.6Western Blot法检测肾组织中AMPK、SIRT1、FoxO1、FN和LC3B水平:取部分冻存肾组织,用预冷生理盐水冲洗3次,制成匀浆,按1mL/100mg的比例加入蛋白抽提液,离心后取上清,进行电泳(20 μg/孔),蛋白质经8%SDS-PAGE分离后转移到聚偏氟乙烯膜上,然后用5%脱脂牛奶封闭,将膜与AMPK、SIRT1、FoxO1、FN和LC3B抗体进行孵育,孵育过夜(4℃),洗膜后与相应的山羊抗鼠IgG二抗孵育(30min),显色后用MicroPublisher成像系统分析蛋白条带的灰度强度(以β-actin作为内对照)。

2 结 果
2.1芒柄花苷对DN大鼠肾组织形态学的影响:HE和Masson染色显示,阴性对照组大鼠肾小球结构完好,肾小球系膜内未见增生或糖原积累;模型组大鼠肾小球异常肥大,系膜细胞增殖,系膜基质增加,间质纤维化;芒柄花苷和二甲双胍治疗后,肾小球形态逐渐恢复正常,肾小球内的炎症和纤维化程度也有不同程度的改善。见图1、2。

图1 芒柄花苷对DN大鼠肾组织形态学的影响(HE染色,×400)
(A:阴性对照组、B:模型组、C:芒柄花苷低剂量组、D:芒柄花苷高剂量组、F:阳性对照组)
2.2芒柄花苷对DN大鼠血清BUN、Scr和血糖水平的影响:与阴性对照组比较,其余各组大鼠血清BUN、Scr和血糖水平升高(P<0.05);与模型组比较,芒柄花苷低剂量组、芒柄花苷高剂量组和阳性对照组大鼠血清BUN、Scr和血糖降低(P<0.05);芒柄花苷高剂量组大鼠血清BUN、Scr、血糖与阳性对照组比较差异无统计学意义(P>0.05)。见表1。
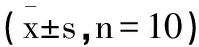
表1 芒柄花苷对DN大鼠血清中BUN Scr和血糖水平的影响
2.3芒柄花苷对DN大鼠肾组织中SOD、GSH-PX和MDA水平的影响:与阴性对照组比较,其余各组大鼠肾组织中SOD和GSH-PX水平降低,MDA水平升高(P<0.05);与模型组比较,芒柄花苷低剂量组、芒柄花苷高剂量组和阳性对照组大鼠肾组织中SOD和GSH-PX水平升高,MDA水平降低(P<0.05);芒柄花苷高剂量组大鼠SOD、GSH-PX、MDA与阳性对照组比较差异无统计学意义(P>0.05)。见表2。
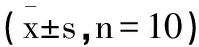
表2 芒柄花苷对DN大鼠肾组织中SOD GSH-PX和MDA水平的影响
2.4芒柄花苷对DN大鼠肾组织中AMPK、SIRT1、FoxO1、FN和LC3B水平的影响:与阴性对照组比较,其余各组大鼠肾组织中AMPK、SIRT1和LC3B水平降低,FoxO1和FN水平升高(P<0.05);与模型组比较,芒柄花苷低剂量组、芒柄花苷高剂量组和阳性对照组大鼠肾组织中AMPK、SIRT1和LC3B水平升高,FoxO1和FN水平降低(P<0.05);芒柄花苷高剂量组大鼠AMPK、SIRT1、FoxO1、FN、LC3B与阳性对照组比较差异无统计学意义(P>0.05)。见表3和图3。
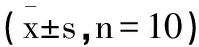
表3 芒柄花苷对DN大鼠肾组织中AMPK SIRT1 FoxO1 FN和LC3B水平的影响

图2 芒柄花苷对DN大鼠肾组织形态学的影响(Masson染色,×400)
(A:阴性对照组、B:模型组、C:芒柄花苷低剂量组、D:芒柄花苷高剂量组、F:阳性对照组)
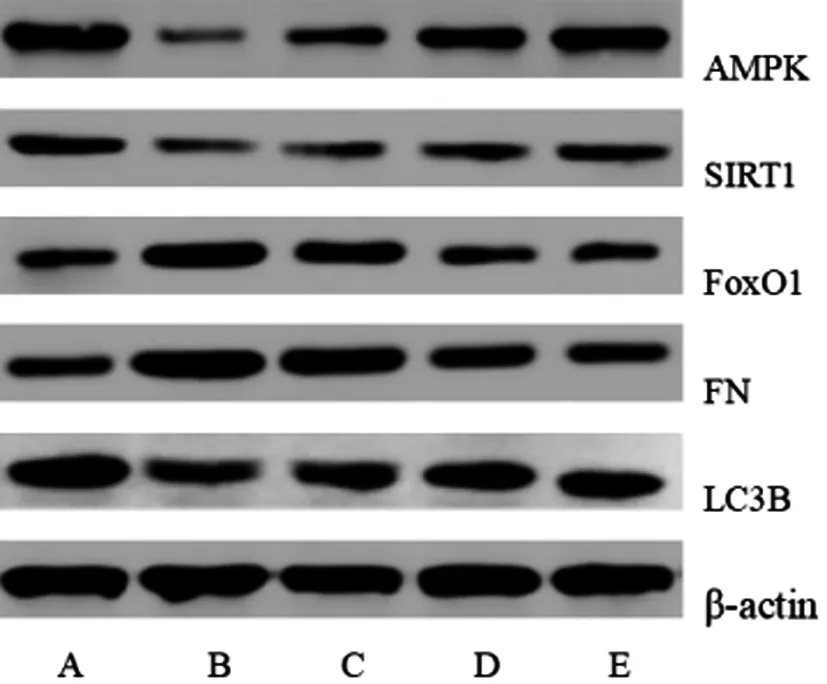
图3 芒柄花苷对DN大鼠肾组织中AMPK、SIRT1、FoxO1、FN和LC3B水平的影响
(A:阴性对照组、B:模型组、C:芒柄花苷低剂量组、D:芒柄花苷高剂量组、F:阳性对照组)
3 讨 论
遗传易感性和高血糖被认为是DN的触发因素。代谢紊乱导致肾脏氧化应激增加,促进足细胞损伤和肾小管间质纤维化,随着病情进展,最终导致ESRD。二甲双胍是治疗T2DM的一线药物,可维持T2DM患者糖脂代谢平衡,抑制肾纤维化,具有一定的肾保护作用,但二甲双胍只能延缓DN的进展,并不能根治DN。因此,寻找新的DN治疗药物尤为重要。芒柄花苷作为一种异黄酮化合物,能增强机体对氧化应激的抵抗力,对动脉粥样硬化和神经损伤发挥保护作用。氧化应激是肾纤维化加重的关键环节,也可加速DN的进展[8]。因此,本研究推测芒柄花苷可能也可以通过其抗氧化能力改善DN。本研究结果显示,芒柄花苷可显著降低DN大鼠血清BUN、Scr和血糖水平,且呈剂量依赖性。同时,HE和Masson’s染色显示,芒柄花苷治疗后肾小球形态逐渐恢复正常,肾小球内炎症和纤维化程度也有不同程度的改善,说明芒柄花苷能明显改善DN大鼠肾功能。此外,芒柄花苷能显著促进DN大鼠肾组织中SOD和GSH-PX表达,抑制MDA表达,说明内源性细胞防御机制在抵抗氧化应激和维持细胞状态中起着重要作用。
氧化应激和自噬受损是DN肾损伤的重要机制。自噬在多种肾脏疾病模型中起保护作用,随着年龄的增长,缺氧减弱了自噬,导致ROS在肾脏受损的线粒体和线粒体中积累。LC3B在自噬的整个过程中起作用,可反映自噬水平。在糖尿病晚期,细胞内环境紊乱极大地抑制了肾脏自噬,抑制AMPK/SIRT1通路,最终导致自噬失代偿,加速了DN进展[9]。二甲双胍可以通过激活AMPK磷酸化正向调节自噬。研究表明,SIRT1抑制剂EX527可抑制二甲双胍上调AMPK/SIRT1信号通路,抑制自噬相关蛋白的表达,促进FN的表达[10]。因此,本研究推测芒柄花苷可能通过AMPK/SIRT1/FOXO1促进DN自噬,减轻肾脏损伤。
转录因子家族FoxO通过调控内皮细胞周期阻滞、DNA修复和凋亡,在细胞增殖和存活中发挥核心作用。其中FoxO1被认为是糖尿病动物模型中参与氧化应激、促进细胞凋亡和抑制自噬的重要调节因子[11]。在氧化应激下,提高FoxO1转录活性可以抑制自噬,降低抗氧化酶的表达,抑制心肌细胞存活。FoxO1的去乙酰化也促进了FoxO1与自噬相关基因7的相互作用,同时抑制了自噬因子LC3B的表达。本研究结果显示,芒柄花苷能促进肾组织中AMPK、SIRT1和LC3B水平,降低FoxO1和FN,促进肾组织细胞自噬,抑制肾纤维化,发挥DN保护作用,且芒柄花苷高剂量组作用与二甲双胍类似。
综上所述,芒柄花苷可明显减轻DN大鼠糖代谢异常和肾脏损害,抑制肾纤维化,其机制可能与芒柄花苷激活AMPK和SIRT1表达,抑制FoxO1表达,改善肾脏氧化应激状况,抑制自噬,从而缓解DN的发生发展过程。

