CircBIRC6调节miR-126-5p/JARID2轴对非小细胞肺癌细胞顺铂耐药性的影响
党 乙, 张 梁, 翟恒钰, 李文海
(西安国际医学中心医院胸外科, 陕西 西安 710100)
非小细胞肺癌(NSCLC)是肺癌的主要病理类型,化疗是其治疗手段之一,顺铂(Cisplatin,DDP)可与基因组DNA或线粒体DNA结合,阻止DNA复制,抑制细胞增殖,最终诱导细胞坏死或凋亡,但长期使用易发生耐药性,导致患者生存率下降,因此,研究NSCLC的耐药机制,寻找克服肿瘤耐药方法对改善患者预后有重要意义[1]。研究显示,CircBIRC6在NSCLC中表达上调,通过抑制miR-145表达促进NSCLC进展[2],CircBIRC6是否与NSCLC耐药性有关尚不清楚。miR-126-5p参与结肠癌、上皮性卵巢癌等肿瘤的耐药性[3],研究显示,miR-126-5p在DDP耐药的NSCLC组织中表达下调,过表达miR-126-5p可靶向并负调控ADAM9表达,提高NSCLC对DDP的敏感性[4]。经starbase在线分析显示,CircBIRC6与miR-126-5p有靶向结合位点,CircBIRC6是否通过调控miR-126-5p表达参与NSCLC细胞的DDP耐药性尚不清楚,本研究探索CircBIRC6对NSCLC细胞DDP耐药作用及机制,为临床克服NSCLC对DDP耐药性提供理论依据。
1 材料与方法
1.1主要材料:A549及A549/DDP细胞购于中科院上海细胞库;DDP(1763258)购自美国Sigma公司;CircBIRC6过表达载体(pcBIRC6)及对照(pcDNA)、CircBIRC6干扰质粒(si-CircBIRC6)及阴性对照(si-NC)、miR-126-5p抑制物(miR-126-5p inhibitor)及其对照(NC inhibitor)、各引物购自上海吉玛生物科技有限公司;Lipofectamine 6000转染试剂(C0526)、双荧光素酶报告基因检测试剂盒(RG089S)、CCK-8试剂盒(C0037)、Annexin V-FITC细胞凋亡检测试剂盒(C1062L)购自Beyotime生物;兔抗JARID2(13594)、Cyclin D1(55506)、P21(2947)、P-gp(13978)抗体购自CST公司。
1.2标本来源:选择2015年1月至2017年12月在本院接受手术并进行DDP化疗的NSCLC患者肺癌组织,其中DDP敏感组织23例,DDP耐药组织25例。根据最后一次DDP化疗与患者复发之间的时间间隔,超过6个月为DDP敏感,小于6个月为DDP耐药。本研究经本院伦理委员会批准,患者均知情并签署知情同意书。
1.3方 法
1.3.1细胞培养与转染:A549/DDP细胞在5.0μmoL/L的培养基中进行培养,待A549/DDP细胞培养融合至65%~70%时,使用Lipofectamine 6000转染试剂盒对A549/DDP细胞进行转染,根据转染质粒将细胞分为pcDNA组、pcBIRC6组、si-CircBIRC6组、si-NC组、si-BIRC6+inhibitor NC组,si-BIRC6+miR-126-5p inhibitor组,另设对照组(Control组)不做转染,转染48h后,进行后续实验。
1.3.2A549、A549/DDP细胞对DDP的半抑制浓度:将A549及各组处理的A549/DDP细胞2×104个/孔接种于96孔板中,分别使用终浓度为1、10、20、40、80、160μmoL/L的DDP处理细胞,培养48h后,每孔加入10μL CCK-8溶液,测定酶标仪450nm处吸光度值,计算各组细胞的半数抑制浓度(IC50)。
1.3.3RT-qPCR检测CircBIRC6、miR-126-5p表达:使用TRIzol试剂提取标本及各组细胞总RNA,然后对RNA进行逆转录合成cDNA,使用Taq qPCR Master Mix再进行RT-qPCR扩增,分别以β-actin、U6为内参,采用2-△△Ct法计算CircBIRC6、miR-126-5p相对表达。CircBIRC6上游引物(5′-3′):TCAAGGAGACCAACTTTGGC;下游引物(5′-3′):CTGGAGTTTGCAGAGCAGTG;β-actin上游引物(5′-3′):CTCTGCTCCTCCTGTTCGAC,下游引物(5′-3′):GCGCCCAATACGACCAAATC;miR-126-5p上游引物(5′-3′):GGTATAATCCGCCGCTTAGCTGCC,下游引物(5′-3′):GTGCAGGGTTGCAAGGT;U6上游引物(5′-3′):CTCGCTTCGGCAGCACA,下游引物(5′-3′):AACGCTTCACGAATTTGCGT。
1.3.4细胞增殖实验:各组处理的A549/DDP细胞4×104个/孔接种于96孔板中,在37℃、5% CO2条件下培养48h后,使用CCK-8试剂盒检测各孔吸光度值(A)。
1.3.5细胞凋亡实验:离心收集转染的各组A549/DDP细胞,PBS洗涤后,使用binding buffer制备成1×106个/mL的细胞悬液,分别加入10μL的Annexin V-FITC与PI溶液,室温避光孵育20min,上流式细胞仪检测细胞凋亡。
1.3.6Western blot检测JARID2、Cyclin D1、P21、P-gp蛋白表达:使用RIPA液提取各组细胞总蛋白,经SDS-PAGE电泳后转膜,10%脱脂奶粉封闭2h,加入JARID2(1∶1000)、Cyclin D1(1∶1000)、P21(1∶1500)、P-gp(1∶1500)一抗稀释液,4℃孵育过夜,再加入HRP标记二抗(1∶2000),室温孵育1h,ECL试剂显色,以β-actin为内参,分析各蛋白表达。
1.3.7CircBIRC6、JARID2与miR-126-5p的靶向关系:使用starbase在线预测CircBIRC6、JARID2与miR-126-5p的靶向关系,分别构建CircBIRC6、JARID2野生型与突变型表达载体,使用荧光素酶报告基因实验验证CircBIRC6、JARID2与miR-126-5p的靶向关系。

2 结 果
2.1CircBIRC6在敏感及耐药肺癌组织及A549、A549/DDP细胞中表达:与敏感肺癌组织相比,CircBIRC6在耐药肺癌组织中表达水平显著升高(P<0.05),与A549细胞相比,A549/DDP细胞中CircBIRC6表达水平显著升高(P<0.05),见图1。
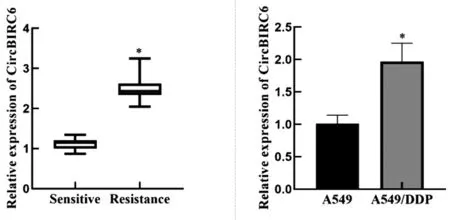
图1 CircBIRC6在敏感及耐药肺癌组织及A549、A549/DDP细胞中表达
2.2DDP对A549、A549/DDP细胞的IC50值:DDP呈剂量依赖性抑制A549、A549/DDP细胞增殖,经计算,DDP对A549、A549/DDP细胞的IC50值分别为28.60μmoL/L、53.56μmoL/L,见图2。
2.3CircBIRC6与miR-126-5p靶向关系验证:通过starbase在线预测显示,CircBIRC6与miR-126-5p有结合位点,见图3。双荧光素酶报告基因检测结果显示,与CircBIRC6-WT+miR-NC组比较,CircBIRC6-WT+miR-126-5p mimics组荧光素酶活性显著降低(P<0.05),见表1。而过表达CircBIRC6,miR-126-5p表达水平显著降低,抑制CircBIRC6表达,miR-126-5p表达水平显著升高,见表2,证明CircBIRC6与miR-126-5p存在靶向关系。
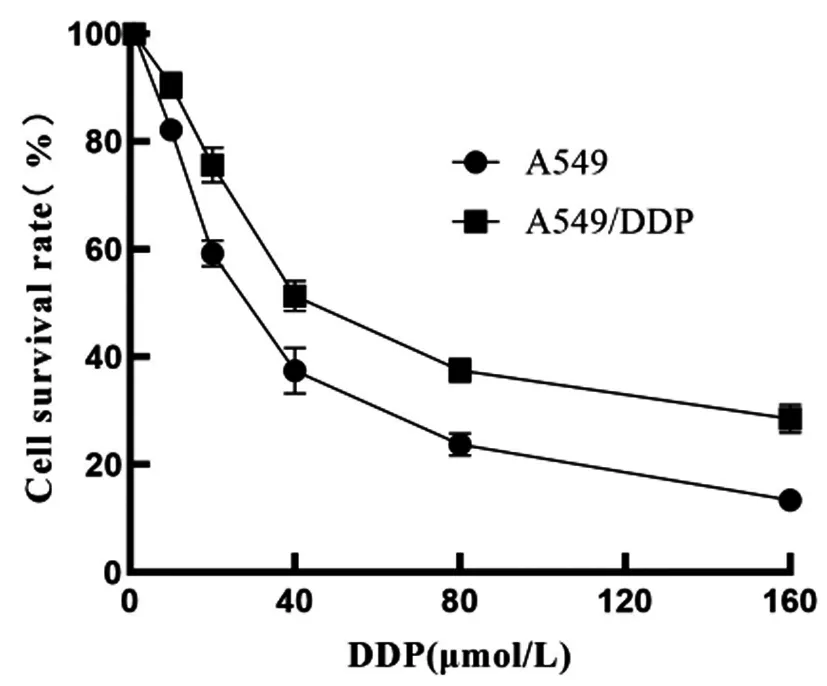
图2 MTT检测DDP对A549、A549/DDP细胞的IC50值

图3 CircBIRC6与miR-126-5p结合位点预测结合

表1 各组A549细胞双荧光素酶报告基因检测结果
2.4各组细胞CircBIRC6与miR-126-5p表达比较:与pcDNA组相比,pcBIRC6组CircBIRC6表达水平显著升高,miR-126-5p表达水平显著降低(P<0.05);与si-NC组相比,si-BIRC6组CircBIRC6表达水平显著降低,miR-126-5p表达水平显著升高(P<0.05);与si-BIRC6+inhibitor NC相比,si-BIRC6+miR-126-5p inhibitor组miR-126-5p表达水平显著降低(P<0.05),CircBIRC6表达水平差异无统计学意义(P>0.05),见表2。

表2 各组细胞CircBIRC6与miR-126-5p表达比较
2.5各组细胞JARID2表达比较:与pcDNA组相比,pcBIRC6组JARID2表达水平显著升高(P<0.05);与si-NC组相比,si-BIRC6组JARID2表达水平显著降低(P<0.05);与si-BIRC6+inhibitor NC相比,si-BIRC6+miR-126-5p inhibitor组JARID2表达水平显著升高(P<0.05),见表3与图4。
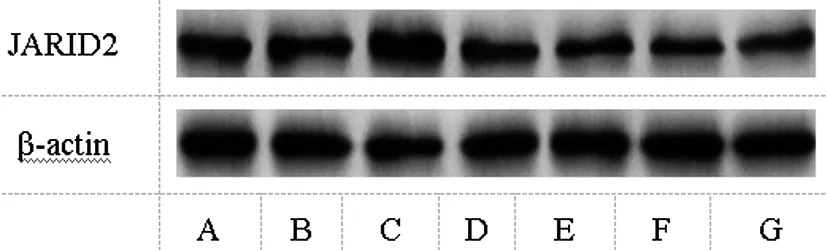
图4 各组细胞JARID2表达

表3 各组细胞JARID2表达比较
2.6CircBIRC6对A549/DDP细胞增殖、凋亡及IC50的影响:与pcDNA组相比,pcBIRC6组细胞增殖、Cyclin D1与P-gp蛋白表达及IC50值显著升高,细胞凋亡率及P21蛋白表达水平显著降低(P<0.05);与si-NC组相比,si-BIRC6组细胞增殖、Cyclin D1与P-gp蛋白表达及IC50值显著降低,细胞凋亡率及P21蛋白表达水平显著升高(P<0.05);与si-BIRC6+inhibitor NC相比,si-BIRC6+miR-126-5p inhibitor组细胞增殖、Cyclin D1与P-gp蛋白表达及IC50值显著升高,细胞凋亡率及P21蛋白表达水平显著降低(P<0.05),见表4、图5、图6。

表4 CircBIRC6对A549/DDP细胞增殖凋亡及IC50的影响

图5 各组细胞Cyclin D1、P21、P-gp蛋白表达

图6 各组细胞凋亡
2.7miR-126-5p与JARID2的靶向关系:通过starbase在线预测,发现JARID2-3’UTR上与miR-126-5p存在结合位点,见图7。进一步使用荧光素酶报告基因实验验证miR-126-5p与JARID2的靶向关系,与JARID2-WT+miR-NC相比,JARID2-WT+miR-126-5p mimics组细胞的荧光素酶活性降低(P<0.05),而JARID2突变型细胞的荧光素酶活性无显著变化,见表5,表明JARID2是miR-126-5p的靶基因。而过表达CircBIRC6,miR-126-5p表达水平显著降低的同时,JARID2表达水平升高,抑制CircBIRC6表达,miR-126-5p表达水平升高的同时,JARID2表达水平降低,见表3,证明CircBIRC6可调控miR-126-5p/JARID2轴。

图7 miR-126-5p与JARID2靶向关系预测

表5 各组A549细胞双荧光素酶报告基因检测结果
3 讨 论
DDP为常见的化疗药物,用于多种恶性肿瘤的治疗,然而肿瘤对DDP的耐药性问题越来越突出,研究DDP的耐药性机制显得尤为重要[5]。有报道显示,circRNA可以调节DDP在NSCLC中的耐药性,CircBIRC6属于circRNA之一,在膀胱癌、肝癌中均上调表达,抑制CircBIRC6表达可抑制肿瘤细胞增殖、迁移及上皮间质转化[6]。本研究结果显示,CircBIRC6在耐药肺癌组织与细胞中表达水平显著升高,提示CircBIRC6可能与NSCLC耐药有关。已有报道显示,CircBIRC6在NSCLC组织与细胞中上调表达,通过抑制miR-217表达,上调β淀粉样蛋白前体蛋白结合蛋白2表达促进非小细胞肺癌的发展[7]。在卵巢癌中,抑制CircBIRC6表达可上调miR-367-3p表达,降低卵巢癌细胞对DDP的耐药性[8]。为探索CircBIRC6在A549/DDP细胞中的功能,本研究在A549/DDP细胞中干预CircBIRC6表达,结果显示,过表达CircBIRC6可增加A549/DDP细胞对DDP的耐药性,而抑制CircBIRC6表达增加A549/DDP细胞对DDP的敏感性,然而其具体作用机制尚不清楚。
circRNA可以作为miRNA海绵参与肿瘤耐药性,如上调circCUL2表达可通过抑制miR-888-5p表达,上调RB1CC1表达增强A549/DDP细胞对DDP的敏感性[9]。本研究显示上调或下调CircBIRC6表达,可抑制或下调miR-126-5p表达,研究表明,miR-126-5p在NSCLC中呈低表达,过表达miR-126-5p可抑制NSCLC细胞增殖和进展[10];本研究通过生物信息学分析和荧光素酶报告基因检测结果显示,CircBIRC6与miR-126-5p存在靶向结合位点,抑制miR-126-5p表达可逆转抑制CircBIRC6表达对A549/DDP细胞增殖的抑制作用,提示CircBIRC6靶向调控miR-126-5p表达参与NSCLC化疗耐药性。Han等研究也证实,miR-126-5p与肺腺癌的放射敏感性有关,过表达miR-126-5p通过调控EZH2/KLF2/BIRC5轴,抑制细胞迁移并促进细胞凋亡,从而增强肺腺癌细胞对放射治疗的敏感性[11]。
JARID2是Jm-jC域(具有去甲基化活性)的SMCX蛋白,为Jumonji蛋白家族中的一员,在多种肿瘤中上调表达,通过促进肿瘤细胞的上皮间质转化,促进肿瘤侵袭与转移[12]。
在胶质瘤中,JARID2表达下调,过表达JARID2可抑制CCND1表达调节胶质瘤细胞生长和胶质瘤细胞对替莫唑胺的敏感性[13]。本研究结果显示,在过表达CircBIRC6的A549/DDP细胞中,miR-126-5p表达水平降低,JARID2表达增加,而抑制CircBIRC6表达后,JARID2表达水平降低,并且在抑制CircBIRC6基础上同时下调miR-126-5p表达后,JARID2表达增加,表明miR-126-5p可靶向调节JARID2表达,且starbase在线预测与双荧光素酶报告基因检测结果证实miR-126-5p与JARID2有靶向结合位点,提示CircBIRC6可能通过miR-126-5p调控JARID2蛋白表达,参与NSCLC对DDP耐药性。Kuang等研究显示JARID2在DDP耐药的NSCLC细胞中上调表达,通过上调Notch1促进NSCLC干性和顺铂耐药[14],也表明JARID2与肺癌顺铂耐药有关。
综上,CircBIRC6在A549/DDP细胞中高表达,CircBIRC6可通过靶向抑制miR-126-5p表达,上调JARID2表达,促进A549/DDP细胞对DDP的耐药性。

