白芦藜醇对大鼠牙移植后牙周组织愈合及Sirt1/Nrf2信号通路的影响
王 鹏, 陈 慧, 代喆颖, 江 铃, 彭 红, 周 辉
(湖北省武汉市第三医院口腔科, 湖北 武汉 430060)
牙齿缺失的治疗是一项非常具有挑战性的工作,种植体修复体已被广泛用于替换缺失的牙齿[1]。然而,种植体假体存在多个缺点,如缺乏生理本体感觉和牙周韧带(periodontal ligament,PDL)对咀嚼的感觉反应缺失[2]。最近的研究显示,牙齿自体移植,可以将非功能性牙齿(通常是第三磨牙)转移到功能性位置,具有较高的成功率[3,4]。白芦藜醇(Resveratrol,RSV)是一种天然存在的植物抗生素,可从多种植物如葡萄等物质中获取。由于其生物学效应,被认为是治疗各种慢性疾病的潜在候选药物[5]。据报道,RSV可通过减少破骨细胞的形成和促进成骨细胞的形成来影响骨代谢[6]。故而,推测RSV可能通过影响成骨细胞和破骨细胞来改变牙移植后牙周组织愈合。此外,RSV在多项研究中被用作Sirt1信号通路的激活剂发挥作用[7],且Nrf2已被证实是Sirt1的下游靶基因[8]。因此,推测RSV对牙移植后牙周组织愈合的影响可能与Sirt1/Nrf2信号通路有关。
1 材料与方法
1.1实验动物:48只SPF级雄性Lewis大鼠,8周龄,体重(180±15)g购自中国科学院动物研究所[许可证号SCXK(京)2021-0012];饲养条件为标准的12h明暗循环,恒温约25℃,自由饮食和水。实验方案经武汉市第三医院医学伦理委员会审核批准。
1.2药物与试剂:RSV粉剂购自美国Sigma Aldrich公司(批号:R5010,纯度≥99%);羧甲基纤维素(Carboxymethyl cellulose,CMC)溶液购自北京YITA公司(批号:SY0248);HE染色液购自北京Leagene公司(批号:DH0006);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒购自美国Sigma公司(批号:387-1KT);小鼠源一抗核因子κB受体激活剂配体(Receptor Activator of Nuclear Factor-κB Ligand,RANKL,批号:ab239607)、Sirt1(批号:ab110304)、β-actin(批号:ab8226)和兔源一抗骨保护素(Osteoprotegerin,OPG,批号:ab73400)、Runt相关转录因子2(Runt-related transcription factor 2,RUNX2,批号:ab236639)、骨钙素(Osteocalcin,OCN,批号:ab93876)、Nrf2(批号:ab92946)均购自英国Abcam公司。
1.3主要仪器:BX51光学显微镜(日本Olympus公司);SU8010型扫描电子显微镜(日本HITACHI公司);OmegaLum C型凝胶成像系统(美国Aplegen公司)。
1.4方 法
1.4.1大鼠牙移植模型构建及处理:将大鼠按照随机数字表法分为4组(每组12只):依次为对照(Control)组、模型(Model)组、低剂量RSV(L-RSV)组和高剂量RSV(H-RSV)组。Control组不作处理,其余组均将大鼠右上颌第一磨牙植入大鼠右上颌第一磨牙牙槽窝[9]。14d后,Control组和Model组大鼠每天早上8点整灌胃等量CMC,L-RSV组和H-RSV组大鼠分别给予5mg·kg-1·d-1RSV或10mg·kg-1·d-1RSV(溶于CMC)灌胃[10],每天一次。大鼠牙移植后28d,所有大鼠均以过量麻醉药物处死。每组分为2个亚组,其中一个亚组分别用HE染色、TRAP染色和免疫组化染色观察牙周组织病理学和成骨分化相关因子的变化。第二个亚组通过扫描电子显微镜分析牙根吸收面积的比例和Sirt1/Nrf2信号通路相关蛋白水平。
1.4.2标本制备和染色:大鼠上颌骨在4℃下于4%多聚甲醛中固定24h,在10% EDTA中脱钙至少2个月。将脱水的样本包埋在石蜡中,切成5 μm厚的切片。行常规HE染色,观察牙周组织病理学变化。使用TRAP染色试剂盒鉴定破骨细胞[11],计算TRAP阳性细胞数。对于免疫组化染色,先用消化酶回收抗原,而后将载玻片在4℃下与一抗孵育90min,分别以1∶300(RANKL和OCN)、1∶400(RUNX2)和1∶50(OPG)的浓度稀释抗体,相应的二抗孵育后,光学显微镜下观察RANKL、OCN、RUNX2和OPG的阳性表达。
1.4.3扫描电子显微镜观察牙根吸收情况:将上颌骨浸泡在10%次氯酸钠溶液中数小时。首先仔细拔除磨牙,轻轻去除牙齿周围的牙周膜,然后去掉除2个远中根外的其他3个牙根。扫描电子显微镜观察远中根的近侧,用Image J软件计算牙根吸收面积与总表面积比(即牙根吸收率)。
1.4.4Western blot检测牙周组织中Sirt1、Nrf2蛋白水平:将1.4.3中取出的牙周组织通过RIPA法提取总蛋白,并通过电泳分离。将分离的蛋白转移到PVDF膜上,用5%的脱脂牛奶封闭后,在4℃下与一抗过夜孵育,均以1∶1000(Sirt1、Nrf2、β-actin)的比例稀释抗体。相应的二抗室温孵育2h后,使用ECL试剂盒结合OmegaLum C型凝胶成像系统检测,并通过Image J软件量化。

2 结 果
2.1RSV对大鼠牙移植后牙周组织病理学的影响:Control组牙周组织形态正常,Model组牙周组织破坏最明显,牙槽骨表面可见大量破骨细胞,炎症细胞大量浸润;且牙根表面多见局部牙根吸收,牙根吸收陷窝最大、最深。L-RSV组和H-RSV组牙周组织损伤程度和牙根吸收面积均小于Model组;且L-RSV组牙周损伤程度和牙根吸收面积大于H-RSV组。见图1。
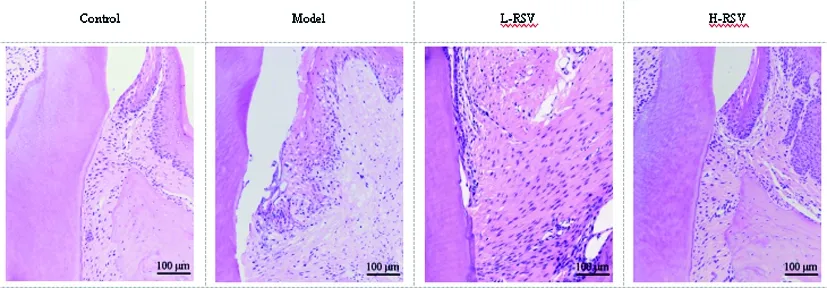
图1 各组大鼠牙移植后牙周组织病理情况(HE染色,×200)
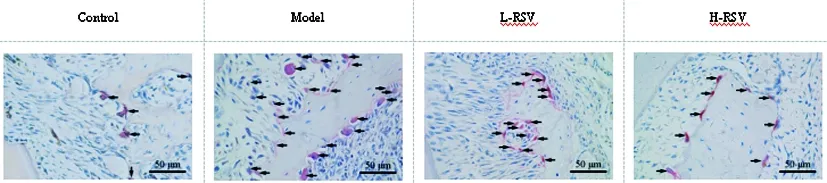
图2 各组大鼠牙移植后牙周组织中破骨细胞数量(TRAP染色,×200)
2.2RSV对大鼠牙移植后破骨细胞的影响:与Control组比较,Model组大鼠牙周组织中TRAP阳性破骨细胞数量增多(P<0.05);与Model组比较,L-RSV组、H-RSV组大鼠牙周组织中TRAP阳性破骨细胞数量均降低(P<0.05);与L-RSV组比较,H-RSV组大鼠牙周组织中TRAP阳性破骨细胞数量均降低(P<0.05)。见图2、表1。
2.3RSV对大鼠牙移植后牙周组织中RANKL、OPG、RUNX2和OCN表达的影响:与Control组比较,Model组RANKL水平升高,OPG、RUNX2和OCN水平降低(P<0.05);与Model组比较,L-RSV组、H-RSV组RANKL水平降低,OPG、RUNX2和OCN水平升高(P<0.05);与L-RSV组比较,、H-RSV组RANKL水平降低,OPG、RUNX2和OCN水平升高(P<0.05)。见图3、表2。

表1 RSV对大鼠牙移植后破骨细胞的影响

表2 RSV对大鼠牙移植后牙周组织中RANKL OPG RUNX2和OCN表达的影响
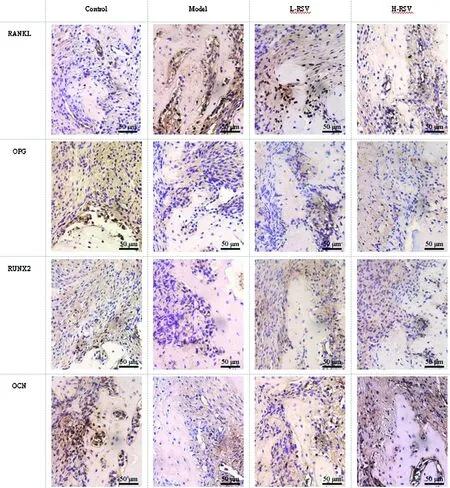
图3 免疫组化检测各组大鼠牙周组织中RANKL、OPG、RUNX2和OCN表达情况
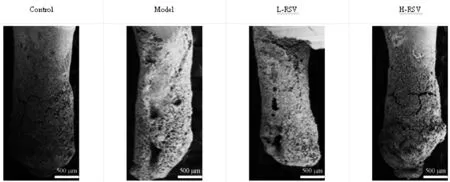
2.4 RSV对大鼠牙移植后牙根吸收的影响:与Control组比较,Model组大鼠牙周组织中牙根吸收率升高(P<0.05);与Model组比较,L-RSV组、H-RSV组大鼠牙周组织中牙根吸收率均降低(P<0.05);与L-RSV组比较,H-RSV组大鼠牙周组织中牙根吸收率均降低(P<0.05)。见图4、表3。

表3 RSV对大鼠牙移植后破骨细胞的影响
2.5RSV对大鼠牙移植后牙周组织中Sirt1/Nrf2信号通路的影响:与Control组比较,Model组Sirt1、Nrf2蛋白水平降低(P<0.05);与Model组比较,L-RSV组、H-RSV组Sirt1、Nrf2蛋白水平升高(P<0.05);与L-RSV组比较,H-RSV组Sirt1、Nrf2蛋白水平升高(P<0.05)。见图5、表4。
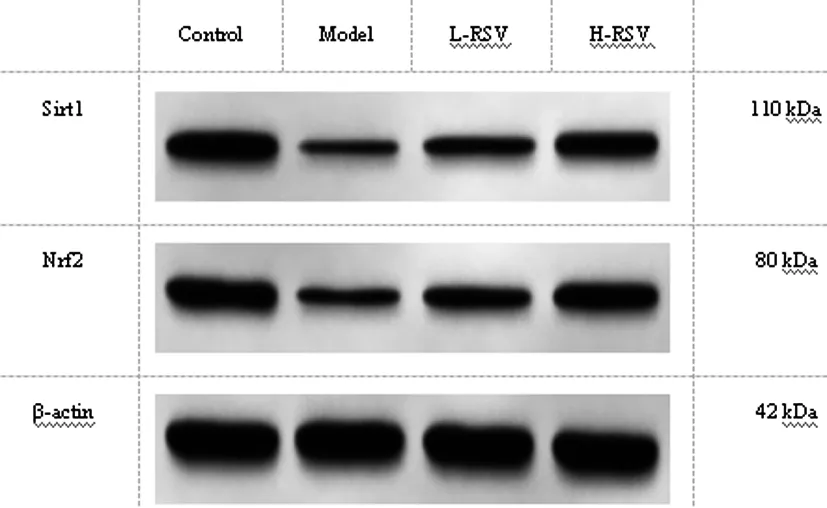
图5 Western blot检测Sirt1、Nrf2蛋白水平

表4 RSV对大鼠牙移植后Sirt1 Nrf2蛋白水平的影响
3 讨 论
RSV是一种天然合成的植物化学物质,即使在高浓度下也不会产生有害作用,因此可以作为膳食补充剂。据报道,RSV对破骨细胞的骨吸收有抑制作用,也有对成骨细胞骨形成的促进作用[6],这与牙移植过程中牙周组织愈合过程密切相关。然而,到目前为止,关于RSV与牙移植后牙周组织愈合的相关数据在文献中很少见。
TRAP为破骨细胞和骨吸收的关键标志物。本研究使用TRAP染色来检查牙移植后牙周组织中破骨细胞的数量。结果显示,RSV处理根部和牙槽骨周围TRAP阳性细胞数量明显少于Model组,表明RSV在抑制破骨细胞形成中具有重要作用。据报道,成骨细胞表达的RANKL是破骨细胞生成的关键调节因子之一。而OPG可阻止RANKL与其细胞表面受体RANK结合进而对破骨细胞分化具有抑制作用[12]。本研究结果显示,Model组牙周组织中RANKL上调,OPG下调,而用RSV处理后这种表达得到逆转。表明RANKL/RANK/OPG系统很有可能是RSV在大鼠牙移植后牙周组织愈合的直接机制。RUNX2是骨形成的关键激活剂和早期成骨分化的标志物,OCN是成骨细胞成熟的标志。在本研究中,RUNX2和OCN在大鼠牙移植模型中的表达降低,而RSV可明显上调二者表达。此外,本研究还证实了RSV可改善大鼠牙移植后牙周组织的损伤程度,同时还可明显抑制牙根吸收率。以上数据证实,RSV可能通过抗破骨细胞形成、促成骨形成以及抑制牙根吸收等方面在牙移植后牙周组织的愈合过程中发挥重要保护作用。
RSV已被证实是Sirt1强效激活剂[7],Nrf2是Sirt1的下游靶基因[8]。据报道,RSV通过激活Sirt1/Nrf2信号通路抑制活性氧产生和成纤维样滑膜细胞增殖进而改善类风湿关节炎[13]。近期研究显示,RSV通过Sirt1/Nrf2通路减少氧化应激增强人牙髓基质细胞成骨潜能[14]。本研究结果证实,牙移植后牙周组织中Sirt1、Nrf2蛋白水平均明显降低,而RSV干预可明显上调Sirt1、Nrf2蛋白水平。结合以往研究得出,RSV可能通过激活Sirt1/Nrf2通路介导大鼠牙移植后牙周组织愈合。
综上所述,RSV可改善牙移植后牙周组织损伤,可能与激活Sirt1/Nrf2通路,调控破骨细胞、成骨细胞的形成有关。有研究表明,RSV在正常大鼠体内应用不会导致骨骼发生明显变化[15],但由于RSV浓度不同、实验时期不同、大鼠病情不同,不能否认全身应用RSV可能会产生影响。

