三倍体枇杷花期调控基因EjAGL6的表达特性和功能分析
蒲籽言,胡若倩,徐欣羽,郭启高,夏 燕,景丹龙*
(1 南方山地园艺学教育部重点实验室, 西南大学 园艺园林学院,重庆 400715;2 西南大学 南方山地作物逆境生物学国家级培育基地,西南大学 农业科学研究院,重庆400715;3 重庆市朝阳中学,重庆 400700)
枇杷属于蔷薇科枇杷属(Eriobotrya)植物,原产于中国亚热带的常绿果树。中国枇杷的栽培面积以及总产量均居世界首位,主要分布地区为长江以南的各省份[1]。枇杷果实成熟于正值水果淡季的初夏[2],其果肉鲜嫩多汁、酸甜适口且具有极高的营养价值与药用价值,因而深受消费者的喜爱[3]。目前,栽培品种多为二倍体枇杷,其种子大且多,严重影响了可食性。三倍体枇杷具有无核、大果、优质、抗逆性强等优良性状,具有良好的市场前景[4]。同时,货架期的长短也是影响枇杷经济效益的重要因素之一。枇杷的花果发育是一个连续的过程,利用提前花期促进果实早熟,再与中、晚熟品种交替上市,从而延长枇杷货架期,提升经济效益。因此,三倍体枇杷花发育花期调控关键基因的功能研究具有重要意义,为三倍体枇杷花期的定向遗传改良积累基因资源。
MADS-box基因家族是调控植物生长发育的重要转录因子家族之一,参与花器官发育、开花时间的调控[5-6]。MADS-box基因根据结构域的类型分为TypeⅠ(M-type)和TypeⅡ(MIKC-type)两类[7]。TypeⅡ基因特点为,包括DNA结合的M区、中间区域I、二聚化区域K和末端的C区,故亦称MIKC基因,其中C区参与转录激活或MADS-box蛋白多重聚合物的形成[8]。MIKC基因包含MIKC*和MIKCC两个亚家族,而MIKCC基因被进一步划分为13个亚类。其中,AGL6及其同源基因属于MIKCC基因的AP1/AGL9亚组[9-10]。
AGL6(AGAMOUS-like6)基因是古老的MADS-box家族基因,在基部被子植物、真双子叶植物和单子叶植物中,均克隆得到了AGL6基因[11]。研究表明,AGL6基因主要在生殖发育阶段发挥作用,包括调控花器官特征、花器官数目、开花时间[12]、花分生组织的大小[13]和种子发育[14]等。在拟南芥(Arabidopsisthaliana)中,过量表达AtAGL6基因会导致拟南芥表现出早花现象[15-16]。在蝴蝶兰(Phalaenopsisaphrodite)中,B类基因和AGL6基因编码的蛋白,通过形成L (OAP3-2/OAGL6-2/OPI)和SP (OAP3-1/OAGL6-1/OPI)复合物决定兰花的唇、花萼、花瓣特征[17]。在牡丹(Paeoniasuffruticosa)中,PsAGL6在生殖器官中表达量较高,且在萼片、花瓣和雌蕊均显著表达,表明PsAGL6主要与牡丹萼片、花瓣和雌蕊的发育相关[18]。在小麦(Triticumaestivum)中,过表达TaAGL6的普通小麦植株的穗粒数显著增加[19]。在水稻(Oryzasativa)中,AGL6-like基因OsMADS6参与调控花器官和分生组织特征,其突变后的水稻会丧失花分生组织的决定性,导致小穗的分生组织形成额外的小穗[11,13]。目前,AGL6基因调控木本植物花期的分子机制研究仍然缺乏。
本研究以三倍体枇杷‘华玉无核1号’花芽为材料,克隆得到了EjAGL6基因,分析了其序列、蛋白结构和亚细胞定位特性,利用实时荧光定量PCR方法分析了该基因在不同花期枇杷品种中的表达特性,通过对EjAGL6转基因拟南芥的开花表型观察,鉴定了EjAGL6基因的功能,探讨和推测EjAGL6在调控三倍体枇杷花发育过程中的作用,为三倍体枇杷花期调控机制研究提供了理论依据。
1 材料和方法
1.1 试材及取样
以二倍体(2x)早花品种‘森尾早生’和晚花品种‘常白1号’,三倍体(3x)早花品种‘无核早玉’和晚花品种‘华玉无核1号’作为材料,采自于重庆市枇杷倍性资源圃(北碚区歇马镇,106°22′E,29°46′N)。分别采集花发育8个时期的材料:花芽生理分化期(S1)、花芽形态分化期(S2)、花序主轴分化期(S3)、花序支轴分化期(S4)、花序侧生支轴快速伸长期(S5)、小花分化期(S6)、花蕾露白期(S7)和盛花期(S8)[20]。将采集后的材料用液氮速冻处理,并存放于-80 ℃冰箱,保存备用。
1.2 方 法
1.2.1EjAGL6基因全长cDNA序列克隆以三倍体枇杷‘华玉无核1号’花序支轴分化期为EjAGL6基因克隆材料,利用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,北京)提取总RNA。通过1%琼脂糖凝胶电泳和NanoDrop 2000c(ThermoScientific,美国)检测RNA样品的浓度,保存于-80℃冰箱备用。利用PrimeScript RT reagent KitWith gDNA Eraser试剂盒(TaKaRa,大连)合成第一链cDNA。
参照枇杷转录组测序中筛选出的EjAGL6基因,用软件Oligo7设计引物(表1)。PCR反应体系:16.25 μL ddH2O、2.5 μL 10×Ex Taq 缓冲液、2 μL 2.5 mmol·L-1dNTP、2 μL 逆转录产物、正反向引物各1 μL、0.25 μL Ex Taq,共计25 μL。扩增程序为 94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 50 s,35个循环;72 ℃ 10 min。将上述PCR产物进行琼脂糖凝胶电泳,并利用琼脂糖凝胶DNA回收试剂盒(天根生化科技有限公司,北京)回收目的片段条带。将pMD19-T载体与目的片段连接后,转入大肠杆菌DH5α感受态细胞。经Amp抗性筛选和菌落PCR筛选,阳性克隆送擎科生物公司测序。
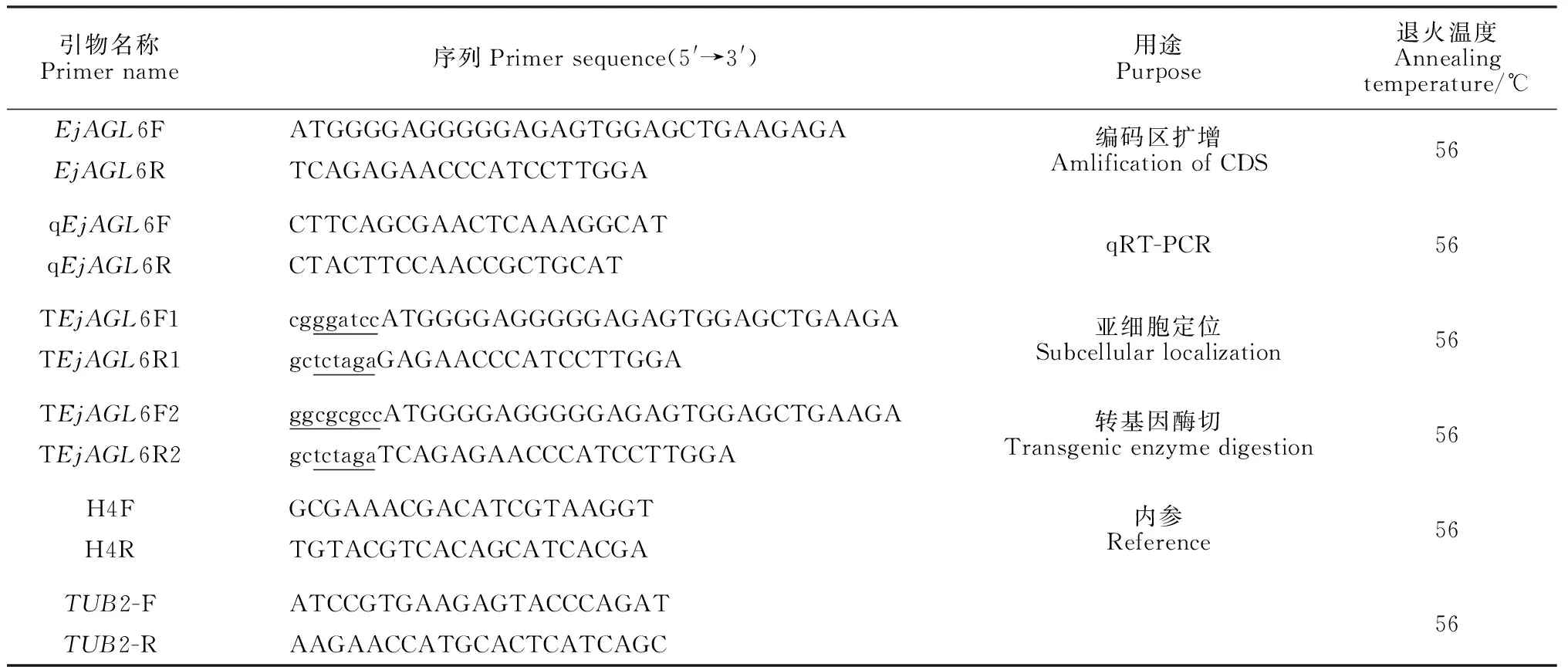
表1 EjAGL6基因所用引物序列
1.2.2 EjAGL6蛋白的基本性质和结构特性预测利用ExPASy Proteomics Server中的ProtParam工具(http://web.expasy.org/protparam/)分析蛋白质的基本理化性质;利用在线软件 SOPMA(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html),对EjAGL6蛋白质进行二级结构分析;使用SWISS-MODEL(http://swissmodel.expasy.org)进行同源建模,构建EjAGL6蛋白三级结构域模型。通过NetPhos 3.1 Server(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)对其进行磷酸化分析。通过ProtScale(https://web.expasy.org/protscale/)对EjAGL6蛋白进行亲水性分析。
1.2.3 EjAGL6蛋白序列比对和分子系统发生通过MEGA 5.0软件构建系统进化树,参数为邻接法,用bootstrap重复1 000次进行校正,其他采用默认设置[21]。通过NCBI数据库获得苹果、陆地棉(Gossypiumhirsutum)、甜樱桃(Prunusavium)等的AGL6氨基酸序列,并使用BioEdit软件对多蛋白序列进行比对分析[22]。
1.2.4 花发育不同阶段EjAGL6的表达特性4个材料的顶芽分化、花序分化和花器官分化等8个不同时期材料,分别提取总RNA,检测其完整性和浓度后,逆转录成cDNA。以枇杷的Ejactin基因作为内参,利用Oligo7在EjAGL6序列差异较大的区域设计特异性引物,分别为目的基因引物qEjAGL6F和qEjAGL6R、内参基因引物H4F和H4R (表1)。采用CFX96 PCR仪(Bio-Rad公司,美国)进行扩增,反应体系和程序参照NovoStart®SYBRqPCRSuperMixPlus的说明书。反应体系:SYBRgreen 5 μL,双蒸水 3.6 μL,cDNA 1 μL,上、下游引物各 0.2 μL。反应程序:95 ℃预变性1 min;95 ℃变性20 s,58 ℃退火20 s,72 ℃延伸30 s,45个循环。每个时期均采集了3个生物学重复样品,每个样品均设置了3个技术性重复。利用2-ΔΔCT方法分别计算EjAGL6在花发育不同时期相对表达量[23]。试验数据均使用SPSS软件进行统计分析,采用Duncan’s法进行差异显著性检验。
1.2.5 EjAGL6蛋白的亚细胞定位分析采用本氏烟草瞬时表达系统,分析EjAGL6蛋白的亚细胞定位特性。利用软件Oligo7对EjAGL6的开放阅读框(open reading frame, ORF)序列进行酶切位点分析,并设计两端的酶切位点引物,分别为带酶切位点BamH I和XbaI的基因特异性引物TEjAGL6F1和TEjAGL6R1(表1)。以测序正确的pMD19-EjAGL6质粒为模板进行扩增,以获得含有酶切位点的目的基因ORF序列。分别提取目的基因和载体pCAMBIA1300质粒,用限制性内切酶分别进行双酶切反应,经琼脂糖凝胶电泳后进行回收。将酶切后的目的基因EjAGL6和改造的pCAMBIA1300载体进行连接,并将重组载体转入大肠杆菌DH5α,经过菌液PCR和双酶切验证后进行测序,确保目的基因序列成功连接到载体。
提取构建好的重组质粒通过冻融法转入农杆菌GV3101感受态细胞。用含50 mg·L-1卡那霉素和50 mg·L-1利福平的LB液体培养基将农杆菌培养至OD600为0.5。取5 mL菌液于4 ℃离心5 min收集菌体, 加入2 mL液体培养基[10 mmol·L-1MgCl2、10 mmol·L-12-吗啉乙磺酸(2-morpholi-noethanesulfonic acid, MES)、150 μmol·L-1乙酰丁香酮,pH5.6]重悬菌体。最后稀释成OD600为0.03~0.1后进行本氏烟草转化。转化后的烟草暗培养24 h,进行荧光观察[24]。
1.2.6EjAGL6基因的功能分析设计两端分别带AscⅠ和XbaⅠ酶切位点的基因特异性引物TEjAGL6F2和TEjAGL6R2(表1),构建到pFGC5941载体超表达,具体构建步骤可参考1.2.5。提取构建好的质粒通过冻融法转入农杆菌GV3101感受态细胞。用含50 mg·L-1卡那霉素和50 mg·L-1利福平的100 mL LB液体培养基将农杆菌培养至OD600为0.8~1.5,将菌液转至离心管,常温5 000 r/min离心5 min,倒掉上清液。加入少量侵染缓冲液(0.5% Silwet L-77,5% 蔗糖,1/2 MS培养基),悬浮菌体,获得侵染液。采用花序浸染法[25]转化拟南芥:剪去拟南芥全开的花与角果,将即将开放的花蕾浸入侵染液90 s左右,侵染完成后将植株置于纸箱中避光培养,24 h后放回正常生长环境中,1周后再侵染,此次不需剪去全开的花与种子。最终收获得到的T0代种子,经烘干、春化后播种。通过喷洒草铵膦进行阳性植株筛选,并持续对后代种子进行培养、筛选和表型观察。
分别取每株野生型与转基因拟南芥植株的叶片置于2.0 mL的微量离心管中,放入液氮速冻,充分研磨;加入200 μL提取缓冲液(200 mmol·L-1Tris-HCl,0.5% SDS,250 mmol·L-1NaCl,25 mmol·L-1EDTA,pH8.0),涡旋震荡后,置于65 ℃水浴中7 min,接着12 000 r/min室温离心8 min;吸取上清液至新的微量离心管中,加入350 μL异丙醇,上下颠倒混匀;置于-20 ℃沉降20 min;12 000 r/min室温离心7 min,弃上清液;沉淀依次用70%、100%乙醇漂洗;沉淀吹干后,溶于50 μL无菌水。以未转基因野生型拟南芥的DNA作为对照,用引物EjAGL6F和EjAGL6R对转基因拟南芥的阳性植株进行EjAGL6基因进行确证。
采用野生型与EjAGL6转基因拟南芥莲座叶的cDNA为模板,以qEjAGL6F和qEjAGL6R为引物,以拟南芥Tubulin基因作为内参基因,进行实时荧光定量PCR。分析转基因拟南芥植株的EjAGL6基因表达量,具体方法同1.2.4。观察统计野生型与EjAGL6转基因拟南芥的开花时间差异,并进行拍照。
2 结果与分析
2.1 枇杷EjAGL6基因全长cDNA序列克隆
通过PCR扩增,获得三倍体枇杷‘华玉无核1号’的EjAGL6基因编码区序列,长度为732 bp(图1)。利用生物学软件DNAMAN对该序列进行分析,推导出一条编码243个氨基酸的多肽。将所得序列与转录组预测序列进行同源比对发现,一致性达100%。利用NCBI网站中的Blast对序列进行比对分析,发现该基因与多数被子植物MADS-box基因家族中的AGL6成员相似度最高,因此将其命名为EjAGL6。进一步比对分析三倍体 ‘华玉无核1号’、‘无核早玉’以及二倍体‘森尾早生’和‘常白1号’的EjAGL6蛋白序列,发现氨基酸序列一致。
2.2 枇杷EjAGL6蛋白的基本性质和结构特性预测
利用ExPASy在线软件对EjAGL6蛋白进行蛋白理化性质分析,结果显示:EjAGL6蛋白的分子式为C1216H1958N358O373S10,分子质量为27.88 kD,带负电荷残基数29,带正电荷残基数34,等电点为 9.05,显碱性,亲水性平均系数为-0.710(负值),因此该蛋白为亲水性蛋白,其脂溶指数为79.05。EjAGL6 的不稳定系数为44.04,说明该蛋白是一种不稳定蛋白(蛋白质不稳定系数大于40时,则该蛋白不稳定)[26]。序列分析显示,EjAGL6 蛋白富含 Leu (11.9%)、Glu(9.5%)和Ser(9.1%)。
利用SOPMA在线软件对EjAGL6蛋白二级结构进行预测,结果显示(图2,A):无规则卷曲所占比例为32.51%,α螺旋为53.91%,延伸链为9.47%,β转角为4.12%。使用SWISS-MODEL对EjAGL6蛋白三级结构预测显示,其包含α螺旋、β转角、无规则卷曲和延伸链,与二级结构预测的结果基本一致(图2,B、C)。
采用Netphos 3.1 Server在线软件预测EjAGL6蛋白的磷酸化位点,结果显示:EjAGL6蛋白存在24个磷酸化位点(打分>0.5),其中丝氨酸(Ser)位点13个,苏氨酸(Thr)位点8个,酪氨酸(Tyr)位点3个(图2,D)。这些磷酸化位点可能对修饰EjAGL6蛋白的结构或功能,调控蛋白活性起着重要作用。利用Protscale在线软件,对EjAGL6蛋白的亲水性进行分析(分数>0,疏水;分数<0,亲水),结果显示该蛋白序列的亲水性区域总体上大于疏水性区域,预测EjAGL6蛋白为亲水性蛋白(图2,E)。
2.3 EjAGL6蛋白序列比对和分子系统发生分析
利用苹果、甜樱桃、杜李(Prunusdulcis)等物种的同源AGL6氨基酸序列共17条,与EjAGL6氨基酸序列进行比对分析,并构建系统进化树(图3,A)。结果表明:枇杷EjAGL6与苹果MdAGL6蛋白相似性较高,聚在同一分支。氨基酸序列比对表明:枇杷、苹果、陆地棉、甜樱桃等的AGL6蛋白均具有高度保守的MADS结构域(M区)、Ⅰ结构域(Ⅰ区),较为保守的K结构域(K区)与C末端结构域(C区)(图3,B)。其中,M区有57个氨基酸,Ⅰ区有30个氨基酸,K区有82个氨基酸,C区有74个氨基酸。其中,C区包含高度保守的AGL6基序Ⅰ和AGL6基序Ⅱ[27]。
2.4 EjAGL6蛋白的亚细胞定位分析
利用本氏烟草瞬时表达系统,以表达载体35S∷GFP作为对照,以35S∷EjAGL6-GFP载体为试验组,注射生长良好的烟草植株,在激光共聚焦显微镜下进行观察。观察结果表明:对照组中的细胞膜和细胞核上都可以观察到荧光信号,而 35S∷EjAGL6-GFP融合蛋白只在细胞核里能观察到荧光信号(图4)。由此说明,枇杷EjAGL6蛋白定位在细胞核。
2.5 花发育不同阶段EjAGL6的表达
4个枇杷品种‘森尾早生’、‘常白1号’、‘华玉无核1号’和‘无核早玉’ 的EjAGL6基因表达分析发现,表达量随着枇杷花发育的不同时期而呈现变化(图5)。EjAGL6的表达主要集中在花发育的后3个时期,分别为小花分化期(S6)、花蕾露白期(S7)和盛花期(S8),而在花发育的前5个时期表达量均较低。
二倍体枇杷早花品种‘森尾早生’和晚花品种‘常白1号’从花序侧生支轴快速伸长期(S5)向小花分化期转变期间,EjAGL6的表达量均呈上升趋势,且在盛花期达到峰值(图5)。三倍体早花品种‘无核早玉’EjAGL6表达量在花发育的后3个时期,呈现先上升后下降的变化趋势,在花蕾露白期达到峰值(图5);而晚花品种‘华玉无核1号’EjAGL6表达量在花发育的后3个时期的变化趋势与‘无核早玉’相反,其在盛花期达到峰值。在早花品种 ‘森尾早生’和‘无核早玉’中,从小花分化期到花蕾露白期,EjAGL6基因表达均显著上升且表达量高于晚花品种,推测EjAGL6基因在花蕾露白期发挥调控花期的关键作用。
2.6 EjAGL6基因的功能分析
EjAGL6转基因拟南芥的开花时间的表型观察发现,开花时间提前1周左右(图6,A),表明EjAGL6具有促进开花的功能。对转基因拟南芥植株进行检验,以野生型拟南芥WT4为阴性对照,含目的基因的pFGC5941超表达载体质粒为阳性对照,结果显示扩增出的片段长度均与阳性对照一致 (图6,B)。进一步利用实时荧光定量PCR分析发现:转基因拟南芥株系的EjAGL6基因表达量显著高于野生型拟南芥(图6,C)。
3 讨 论
本研究从三倍体枇杷‘华玉无核1号’中克隆得到EjAGL6,其具有高度保守的M区、Ⅰ区、K区和C区,其中,C区包含高度保守的AGL6基序Ⅰ和AGL6基序Ⅱ。与枣(Ziziphusjujuba)的ZjAGL6[28]、百合(Liliumbrownii)的LiAGL6[29]、薄壳山核桃(Caryaillinoinensis)的CiAGL6[9]、高粱(Sorghumbicolor)的SbAGL6[30]和春兰(Cymbidiumgoeringii)的CgAGL6-3[12]等基因结构相似,表明了EjAGL6基因属于MIKC基因亚家族成员。系统进化树分析表明,枇杷EjAGL6与苹果MdAGL6蛋白质相似性较高,聚在同一分支,这与传统分类学上枇杷与苹果同属于苹果亚科相吻合[20]。同时,通过亚细胞定位发现EjAGL6蛋白定位于细胞核中,具有典型的MADS-box转录因子亚细胞定位特性[31]。
EjAGL6基因在三倍体和二倍体早晚花不同枇杷品种的花发育不同时期中均有表达,且表达量差异显著;其表达量分别在三倍体早花枇杷‘无核早玉’花蕾露白期、三倍体晚花枇杷‘华玉无核1号’小花分化期、二倍体早花枇杷‘森尾早生’和二倍体晚花枇杷‘常白1号’的盛花期达到最高。结果表明,在枇杷花期调控过程中,花芽的发育阶段与EjAGL6表达量高低密切相关。类似的,在枣花发育过程中,ZjAGL6表达量在大蕾期最高,其次为盛开期,而在小蕾期与初开期中的表达差异并不显著[28],这与本研究结果类似。建兰花不同发育阶段的CeAGL6基因均有表达,且表达量在最小的花蕾中最高[32],该结果与本研究结果存在明显差异,这可能是由于两个物种的亲缘关系较远所致。在其他被子植物中,紫薇(Lagerstroemiaindica)花发育5个时期的LiAGL19基因表达量,呈现先升高后下降的趋势[33]。山核桃(Caryacathayensis)雄花发育不同时期的CcAGL24基因表达量存在一定差异,其表达量在雄花发育前期的小花原基形成期最高[34]。在蕙兰(Cymbidiumfaberi)和墨兰(Cymbidiumsinense) 同一器官或组织的不同发育时期,CfAG1、CfAG2和CsAG1基因的表达量也有差异[35]。此外,本研究结果与转录因子基因EjbHLH79在调控三倍体枇杷花发育不同时期中的表达量相似,主要集中在花发育的后3个时期[36]。
EjAGL6转基因植株表型观察显示,EjAGL6基因在拟南芥中过量表达,能够使转基因植株花期提前。类似地,兰花AGL6-like基因的转基因拟南芥,通过正向激活开花时间基因FT、SOC1和花启动基因LFY和AP1,显著促进开花[37]。小麦TaAGL6在拟南芥和水稻中过量表达,均会促进提前开花[38]。在花椰菜花叶病毒(CaMV) 35S启动子驱动下过表达AGL6基因,转基因植物在长、短日均开花提前[15]。红花玉兰(Magnoliawufengensis)MawuAGL6过表达也能使拟南芥出现早花现象[39]。
本研究通过克隆EjAGL6基因,分析其序列、亚细胞定位特性以及在二倍体和三倍体枇杷早晚花品种中的表达水平,推测EjAGL6在花蕾露白期发挥关键调控作用。通过对EjAGL6基因的功能鉴定,表明EjAGL6基因促使枇杷开花时间提前。本研究的EjAGL6基因表达特性和功能分析,使枇杷MADS-box基因家族的功能研究得到了拓展。但是,关于EjAGL6与其他调控花发育的转录因子间的相互作用机制以及基因调控网络,仍有待进一步的研究。

