燕麦植株生长及叶片生理活性对土壤镉胁迫的响应
马凤仪,赵宝平*,张 茹,王永宁,郭晓宇,王美玲,刘景辉
(1 内蒙古农业大学 农学院,呼和浩特 010010;2 内蒙古农牧业生态与资源保护中心,呼和浩特 010000;3 乌兰察布市污染防治智能监管服务与技术支持中心,内蒙古乌兰察布 012000)
燕麦(AvenasativaL.)是中国重要的粮、饲作物,内蒙古是燕麦种植的最适地区之一[1],占中国燕麦种植面积42%以上。内蒙古西部有色金属、黑色金属等矿产具有明显优势,但在开采、冶炼过程中一些重金属污染物通过沉降、雨水和淋溶等途径进入土壤,造成周边农田土壤镉(Cd)、铅(Pb)等重金属污染物超标,严重影响当地农产品的质量安全[2]。
Cd是植物非必需元素, 具有强生物毒性和快速迁移的特点, 能够导致植物营养缺陷、叶绿素合成抑制、光合作用降低、氧化应激等, 最终抑制植物生长, 甚至导致植物死亡[3]。研究表明,Cd胁迫能降低植物蒸腾速率,导致气孔关闭,抑制“钙信号”传递[4],影响光合速率[5],抑制植物叶片中叶绿素的生物合成,减少叶绿体数量,使基粒类囊体排列紊乱,影响植物的原初光化学反应和光系统Ⅱ(PSⅡ),从而引起植物体内生理代谢紊乱,最终影响植物体的生长发育[6-7]。
同种作物不同品种对Cd胁迫生理响应存在差异,在小麦[8-9]、玉米[10]、水稻[11]、龙葵[12]等作物上已有相关报道,目前有关燕麦不同品种对Cd胁迫响应差异研究较少。因此,本试验以两个高、低Cd积累燕麦品种为材料,探明不同Cd积累型燕麦生长及叶片生理特性对Cd胁迫响应的差异,为燕麦抗Cd机制及应用农艺措施降低燕麦Cd积累量与超标风险,推动内蒙古燕麦安全、优质生产提供科学依据。
1 材料和方法
1.1 试验材料
本试验依据前期18个燕麦品种两年大田筛选后结果, 选择‘200919-7-1’(Yl)和‘燕科2号’(Yh)两个燕麦品种为供试材料。其中,‘200919-7-1’具有籽粒低Cd积累特性,在两年试验中籽粒平均Cd含量为0.122 mg/kg,种子由河北省张家口市农业科学院提供;‘燕科2号’具有籽粒高Cd积累特性,在两年试验中籽粒平均Cd含量为0.298 mg/kg,种子由内蒙古自治区农牧业科学院提供。
1.2 试验设计
试验在内蒙古农业大学燕麦产业研究中心温室进行。盆栽土壤取自河套灌区试验地(镉污染土壤,Cd)和内蒙古农业大学教学农场(对照,CK)。供试土壤Cd含量分别为0.96 mg/kg(Cd)和0.23 mg/kg(CK),供试土壤属轻度Cd污染土壤,基本理化性质详见表1。选择规格为240 mm×180 mm的塑料花盆,每盆装土5 kg,每盆播种30粒,每盆混为一个样,每个处理重复4次,共16盆,每盆施底肥磷酸二铵3 g。抽穗期测定相关生长及生理指标。
1.3 测定项目与方法
1.3.1 生长指标于抽穗期每处理选择5株先测定株高,然后将其用去离子水洗干净,85 ℃下杀青30 min,于105 ℃烘至恒重后称重,得到整株生物量干重(DW)。
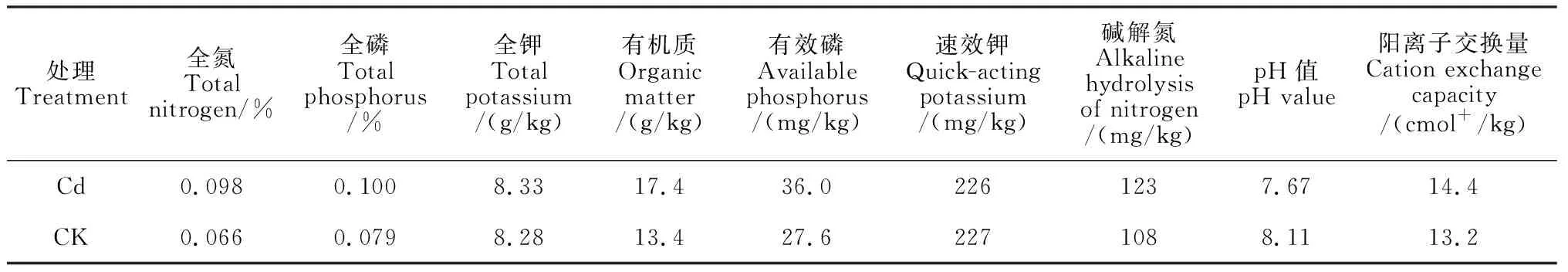
表1 盆栽试验供试土壤理化性质
1.3.2 叶片抗氧化酶活性和MDA含量取燕麦中上部叶片,依据《植物生理学实验指导》[13]方法测定叶片中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性和丙二醛(MDA)含量,每个处理重复3次。
1.3.3 叶片气体交换参数和叶绿素荧光参数采用CIRAS-3光合仪测定旗叶的净光合速率(Pn)、蒸腾速率(Tr)、胞间 CO2浓度(Ci)和气孔导度(Gs),以及光下最小荧光(Fo′)、光下最大荧光(Fm)、光适应下最大可变荧光(Fv′),并计算PSⅡ反应中心的激发能捕获效率(Fv′/Fm′)、光化学淬灭系数(qP)、实际光化学效率(φPSⅡ)、电子传递速率(ETR),测量时将叶片夹于叶室中部,每个处理重复3次;采用SPAD-502型叶绿素仪测定旗叶的相对叶绿素含量(SPAD)值,每个处理重复3次。叶绿素荧光参数计算公式如下:
Fv′/Fm′ =(Fm′ -Fo′)/Fm′;
qP =(Fm′ -Fs)/(Fm′ -Fo′);
φPSⅡ=(Fm′ -Fs)/Fm′
1.4 数据处理
使用Microsoft Excel 2010对数据进行简单统计处理和绘图,采用SPSS 22.0进行方差分析。
2 结果与分析
2.1 Cd胁迫对两个类型燕麦品种植株生长的影响
表2显示,与CK相比,两个燕麦品种的株高、各器官(根、茎、叶、颖壳)干重、单株干重在Cd胁迫下均显著降低,Yl品种(籽粒低Cd积累)降幅分别为28.5%、31.8%、38.3%、55.3%、26.4%、40.8%,Yh品种(籽粒高Cd积累)降幅则分别为27.3%、25.9%、37.3%、57.6%、34.6%、38.2%(P<0.05)。在相同处理下,两品种的株高没有显著差异,单株干重则表现为Yh品种显著高于Yl品种,在CK和Cd胁迫下分别显著提高40.1%和47.8%。说明两类型燕麦品种的生长在镉胁迫下均受到显著抑制,但籽粒高Cd积累品种受到的抑制程度较小,尤其以单株干重的表现更为突出。

表2 Cd胁迫下两个类型燕麦株高及单株干重
2.2 Cd胁迫对两个类型燕麦品种叶片气体交换参数和叶绿素含量的影响
图1显示,两个燕麦品种叶片的Pn、Gs和SPAD在Cd胁迫条件下均比相应CK显著降低,Yh的降幅分别为35.0%、28.4%和16.4%,Yl的降幅分别为57.1%、71.3%和14.8%(P<0.05),其余指标则无显著变化;同时,Yl叶片的Ci也比CK显著降低13.6%,而Yh叶片的Ci以及两品种的Tr均无显著变化。在CK处理条件下,Yh叶片的Pn较Yl显著提高24.3%,其Ci则比Yl显著降低5.4%,而其余指标与Yl均无显著差异;在Cd胁迫条件下, Yh的Pn和Gs较Yl分别显著升高100%和143.6%,而其Ci、Gs和SPAD与Yl均无显著差异。结果说明Cd胁迫显著抑制了两燕麦品种叶片的净光合速率、气孔导度和叶绿素含量,但Yl品种受到的影响更大;Yh品种的Pn在相同处理条件下均显著高于Yl品种。
2.3 Cd胁迫对两种类型燕麦品种叶绿素荧光参数的影响
图2显示,在Cd胁迫条件下,燕麦品种Yh叶片的叶绿素荧光参数仅光下最小荧光(Fo′)比CK显著提高3.0%,而燕麦品种Yl叶片的叶绿素荧光参数仅Fo′和光化学淬灭系数(qP)分别比对照显著降低14.4%和27.3%(P<0.05),而其余参数原初光化学量子效率(Fv/Fm)、PSⅡ反应中心的激发能捕获效率(Fv′/Fm′)、实际光化学效率(φPSⅡ)和电子传递速率(ETR)均与对照差异不显著。在CK处理下,Yh品种的Fo′、φPSⅡ、qP和ETR分别较Yl品种显著提高6.6%、23.6%、30.1%和23.7%,其Fv/Fm和Fv′/Fm′均与Yl品种无显著差异;在Cd胁迫条件下, Yh品种叶片的Fo′、φPSⅡ、qP、ETR较Yl品种分别显著提高22.4%、29.2%、40.4%和29.2%,而Yl品种的Fv′/Fm′却较Yh品种显著提高15.0%(P<0.05),而两品种间的Fv/Fm无显著差异。可见,在镉胁迫条件下,两燕麦品种的叶绿素荧光参数与对照相比大多无显著变化,而除Fv/Fm外,其余参数在品种间均存在显著差异。
2.4 Cd胁迫对两种类型燕麦品种叶片抗氧化酶活性和MDA含量的影响
由图3可知,两种类型燕麦品种叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量在Cd胁迫下均比CK不同程度提高,但仅SOD 活性和MDA 含量增幅达到显著水平;其中,Yl品种的增幅分别为44.9%和22. 2%,Yh品种增幅则分别为41.9%和18.1%(P<0.05)。在CK和Cd胁迫条件下,Yh品种的SOD活性较Yl分别显著提高36.8%和22.8%,而其MDA含量则较Yl显著降低27.1%和30.8%(P<0.05),POD和CAT活性在两品种间均差异不显著。可见,镉胁迫均能诱导两个类型燕麦品种叶片SOD活性和MDA含量显著提高,而Yl的MDA含量增幅高于Yh, Yl受到的Cd胁迫危害更大。
2.5 燕麦幼苗生长与生理指标之间关系
Cd胁迫下,燕麦通过不同机制共同作用来减轻Cd的毒害作用。相关性分析(表3)结果显示,燕麦根、茎、叶的干重和单株的干重与Pn呈显著正相关关系(P<0.05),同时,根的干重与qP、ETR和φPSⅡ也呈显著正相关关系;根的干重与MDA呈显著负相关关系(P<0.05),与CAT活性呈极显著负相关关系(P<0.01);颖壳的干重与CAT活性呈显著负相关关系(P<0.05)。

表3 燕麦幼苗生长指标与生理指标之间的相关性
3 讨 论
本研究以高Cd积累燕麦品种‘燕科2号’(Yh)和低Cd积累燕麦品种‘200919-7-1’(Yl)为试验材料,初步比较分析了Cd胁迫下两个品种的生长和生理差异。已有研究表明,Cd胁迫条件下植物生长会受到抑制,导致各器官生物量会降低[14-15],且相较于低Cd积累品种,高Cd积累品种对Cd的耐受力较强,生长受抑制的程度较小[16]。在本研究中,与CK处理相比,高、低Cd积累燕麦品种株高及各器官生物量在Cd胁迫下均显著下降,各器官生物量均与其叶片Pn呈正相关关系;Yh品种的生物量在Cd胁迫下高于Yl,表明两品种的生长均受到镉胁迫的显著抑制,但Yh对Cd胁迫有较强的耐受力。
同时,植物的光合作用也会受到Cd胁迫的抑制,导致光合作用降低的因子包括气孔限制和非气孔限制,Ci是评判的依据;当Pn、Gs、Ci同时降低时,表明光合作用是受气孔限制因素的影响;当Pn的降低伴随着Ci的升高,则表明光合作用是受非气孔因素限制[17-18]。周姣等[12]研究表明龙葵和少花龙葵光合作用的降低是气孔限制和非气孔限制综合作用的结果;董袁媛等[19]研究表明镉胁迫下气孔限制降低了黄麻的光合作用。此外,郭佳佳等[16]报道,低Cd积累小麦品种光合作用的降低部分原因是气孔限制因素引起的,另有原因可能是由叶绿素含量及相关酶活性等非气孔限制因素引起的。本研究结果表明,在Cd胁迫条件下,燕麦品种Yl和Yh叶片的Pn、Gs和Ci较CK处理均同时呈下降趋势,表明Cd胁迫下两个品种光合作用的降低可能是受气孔限制因素的影响;此外,燕麦品种根、茎、叶的干重和单株的干重均与Pn呈显著正相关,而与CAT活性呈显著负相关,表明Cd胁迫下光合作用的降低可能与有关抗氧化酶活性等非气孔限制因素密切相关。
此外,叶绿素荧光参数是评价植物生理指标变化和光能利用的一种较好检测方法[20-21]。Fo′与光合作用的光反应无关,与叶绿素浓度有关,其变化可以说明PSⅡ反应中心受到了逆境胁迫的抑制或者伤害[22];Fv′/Fm′反映在逆境胁迫下植物光合机构的损伤程度,通常用来判断植物是否受到光抑制影响[23];qP用来表达PSⅡ反应中心能量被色素所吸收之后的转化率,也可以表示PSⅡ开放中心的数目,其值越高说明光系统Ⅱ具有的电子传递活性越高,电子传递速率越快,相反qP值越低表明光系统Ⅱ开放比例减小,为光合作用提供的能量也降低[24-25];ETR反映在实际光照强度下的表观电子传递速率[26]。在本试验的Cd胁迫条件下,燕麦品种Yh叶片的Fo′值增加幅度较Yl高,说明Cd胁迫对品种Yh的叶绿素浓度影响较大;品种Yl的Fv′/Fm′值提升幅度显著高于Yh,且Yl的qP降幅较Yh高,这与Cd胁迫下POD、CAT活性有关,说明燕麦品种Yl叶片光合机构损伤程度较Yh更严重,对光合作用的影响更大。
另外,MDA 是细胞膜质过氧化产物,它的积累可作为植物叶片的细胞膜遭受破坏程度的指标[27],SOD、POD和CAT共同组成植物体内的活性氧清除系统,有效清除植物体内的自由基和过氧化物[16],Cd胁迫下POD和CAT活性的增加与活性氧的加速产生有关[28]。本研究结果表明,在Cd胁迫条件下,两个燕麦品种CAT活性增加,燕麦品种Yl的MDA含量增加幅度高于Yh,且品种Yl叶片的SOD活性和MDA含量均显著高于品种Yh,说明相比于品种Yh,品种Yl受Cd胁迫诱导的过氧化伤害较大。品种Yl叶片的MDA含量较Yh高可能是因为Yl的POD活性较低所致。孙亚莉等[11]研究表明,2个水稻品种随着Cd浓度增加,其MDA 含量以及SOD、POD 和 CAT 等抗氧化酶活性均随着镉胁迫处理浓度的升高而增强,且Cd胁迫处理下耐Cd品种 MDA 含量与各抗氧化酶活性较对照的相对增加值小于镉敏感品种;邵国胜等[29]研究表明,Cd耐受性强的水稻抗氧化酶活性显著高于Cd敏感品种,而MDA含量则低于Cd敏感品种。本研究中燕麦品种Yl叶片的SOD、POD活性均低于品种Yh,而MDA含量均显著高于品种Yh,这些结果表明Yl对Cd较敏感,而Yh对Cd的耐受性较高。
4 结 论
Cd胁迫显著抑制了高、低Cd积累燕麦品种生长和叶片光合气体交换参数及叶绿素荧光参数特性,诱导增强了两个品种的叶片SOD、POD 和 CAT等抗氧化酶活性,尤其是SOD活性得到显著增强;与低Cd积累燕麦品种(200919-7-1)相比,高Cd积累燕麦品种(‘燕科2号’)具有更高的生物量和抗氧化酶活性,光合气体交换参数和叶绿素荧光参数的表现也更优。综合研究结果发现,高Cd积累燕麦品种(‘燕科2号’)因具有优良的抗氧化和光合生理活性,从而对土壤Cd的耐受性较低Cd积累燕麦品种更强。

