生孢噬纤维菌纤维素酶关键氨基酸饱和突变及性质
王 辛, 方 程, 盛 钧 美, 陈 晓 艺
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
纤维素酶是一类能够水解纤维素的糖苷水解酶的统称,根据催化功能不同可分为3类,即内切纤维素酶、外切纤维素酶和β-葡萄糖苷酶。纤维素的降解需要3种酶的协同作用,内切纤维素酶作用于纤维素分子内部非结晶区,通过水解β-1,4-糖苷键将长链的纤维素大分子截短,产生带还原性末端的小分子纤维糊精;外切纤维素酶作用于纤维素分子的结晶区与非结晶区末端,水解产物为纤维二糖;β-葡萄糖苷酶进一步水解纤维二糖生成葡萄糖[1]。
生孢噬纤维菌(Sporocytophagamyxococcoides)是一种滑动细菌,革兰氏染色阴性,可在以纤维素为唯一碳源的培养基上生长[2]。在该菌株的基因组中挖掘到一个纤维素酶Sm_2974,该酶蛋白结构简单,仅由分泌信号肽和糖苷水解酶第五家族催化结构域(GH5)组成。该酶蛋白同时具有内切纤维素酶和外切纤维素酶的活性,且催化效率较高。
为研究Sm_2974催化中心的关键氨基酸残基对酶蛋白水解纤维素能力的影响,本实验在已克隆表达Sm_2974的基础上,对该酶活性中心的第205位色氨酸残基进行饱和突变[3],对所有突变体蛋白的酶活力和纤维素水解能力进行了比较分析,以期为进一步研究Sm_2974结构与催化能力的关系提供了理论基础。
1 材料和方法
1.1 材 料
1.1.1 实验菌株及表达载体
菌株Sporocytophagasp. CX11,本实验室分离鉴定并保藏;质粒pET28a(+)、大肠杆菌EscherichiacoliDH10B、EscherichiacoliBL21(DE3)均获赠于中科院大连物理化学研究所赵宗保研究员课题组,分别用于重组质粒构建克隆宿主菌株、重组质粒表达宿主菌株。
1.1.2 培养基
LB培养基:1.0%蛋白胨,0.5%酵母提取物,1.0% NaCl;LLB培养基:1.0%蛋白胨,0.5%酵母提取物,0.5% NaCl。
1.1.3 试 剂
Prime STAR HS DNA聚合酶,EcoR V、KpnⅠ等限制性内切酶,宝生物(TaKaRa)大连有限公司;PCR引物合成于上海生工生物工程有限公司,DNA的测序由吉林省库美生物科技有限公司完成。DNA胶回收、质粒小量抽提试剂盒、卡那霉素、IPTG,上海生工生物工程股份有限公司;其余试剂均为国产分析纯。
1.2 方 法
1.2.1 Sm_2974同源建模及结构比对
从NCBI获得BsEG5C-1(No.NP389695.2)完整序列,使用Megalign软件对比Sm_2974和BsEG5C-1的序列。利用SWISS-MODEL服务器进行蛋白质三级结构的预测,经同源建模得到模拟的Sm_2974三维结构。
1.2.2 Sm_2974饱和突变体的构建
以Sm_2974-pET28a重组质粒为模板,利用RF克隆技术,定点突变引物中分别引入突变的碱基,反应体系(200 μL):模板16 μL、上游引物8 μL、下游引物8 μL、Prime STAR 2 μL、5×Prime STAR buffer 40 μL、dNTPmix 16 μL、无菌水补充至200 μL。反应条件:95 ℃ 5 min,(94 ℃ 30 s、55 ℃ 45 s、72 ℃ 1 min)30个循环,72 ℃ 10 min,20 ℃结束反应。PCR扩增产物通过1%琼脂糖凝胶电泳分析,进行胶回收获得目的片段。消化母本质粒,反应体系(10 μL):RF Ⅱ反应产物 8.5 μL,DpnⅠ 1.5 μL,反应条件:37 ℃消化10 h。取5 μL消化产物电击转化至克隆菌株。挑取单菌落接菌至10 mL含有30 μg/mL Kan的LB液体培养基中,37 ℃培养12~16 h,提取质粒进行酶切鉴定,正确的质粒送测序公司测序。将鉴定结果正确的质粒热激转化至表达菌株中。
1.2.3 Sm_2974饱和突变体表达与纯化
将表达正确的Sm_2974突变体进行大体系诱导表达(800 mL),诱导后菌液经8 000 r/min,4 ℃ 离心3 min,弃上清。将诱导的菌体用ddH2O洗两次,彻底洗去菌体表面的培养基等杂质,然后用30 mL Native binding buffer重悬后,高压匀浆破碎细胞。混合液在10 000 r/min,4 ℃ 离心10 min,分离破碎上清及沉淀,上清测定蛋白浓度。采用Ni Sepharose 6 Fast Flow填料进行蛋白纯化[4]将收集的Elution洗脱液进行SDS-PAGE验证。利用截留量为10 ku的聚醚砜超滤膜将Elution洗脱液浓缩,用10 mmol/L pH 7.4 PBS置换缓冲液,测定蛋白浓度后置于4 ℃保存。
1.2.4 蛋白浓度测定
利用Bradford法检测蛋白质浓度。制作0.1~1.0 mg/mL蛋白标准曲线:分别吸取含0.2、0.4、0.6、0.8和1.0 mg/mL的牛血清蛋白标准液20 μL,加入1.0 mL考马斯亮蓝G-250蛋白试剂中,反应2 min后,测定595 nm处吸光度,以ddH2O代替标准液作为空白。以牛血清蛋白标准液的蛋白质浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.5 酶活测定
1.2.5.1 纤维素内切酶酶活测定
利用DNS法测定纯化的Sm_2974的酶活[5],反应体系:150 μL以10 mmol/L pH 8.0 NaH2PO4-Na2HPO4配置的10 g/L羧甲基纤维素钠(CMC)与50 μL酶液混合,35 ℃反应20 min,反应结束后立即加入200 μL DNS溶液充分混合,沸水浴5 min,冷却后取200 μL上清液加入96孔板中,以灭活酶液为空白对照,测量波长540 nm处的吸光度。酶活力单位的定义:在最佳反应条件下,每分钟释放1 μmoL还原糖所需的酶量为1 U。
1.2.5.2 纤维素外切酶活性测定
1 mg/mLpNPC:取10 mgpNPC和10 mg葡萄糖酸内脂溶于10 mL 50 mmol/L pH 6.8的Na2HPO4-NaH2PO4缓冲液,混合后4 ℃保存。将100 μL酶液与50 μL 1 mg/mLpNPC 溶液加入2 mL离心管中,在35 ℃水浴锅中反应30 min,加入150 μL 10%的Na2CO3终止反应,在420 nm波长处检测吸光度,对照用煮沸10 min 灭活的酶液。
酶活力单位的定义:在最适反应条件下,每分钟释放1 μmolpNP所需的酶量为1 U。
1.2.6 酶水解滤纸能力测定
在2 mL离心管中加入5片打孔Whatman滤纸(约10 mg)加入3 μmol/L酶液,用10 mmol/L pH 7.0 NaH2PO4-Na2HPO4补充体系至0.4 mL,在35 ℃下反应5、10、15、20、60 min,以灭活酶液为对照组,反应结束后立即分离上清和沉淀。利用DNS法测定上清中的还原糖量,以纤维二糖作标准曲线。
2 结果与讨论
2.1 Sm_2974同源建模及结构比对
经过氨基酸序列比对,Sm_2974与来源于BacillussubtilisBS的纤维素酶BsEG5C-1结构相似度很高,约为49.3%。利用SWISS-MODEL服务器进行蛋白质三级结构的预测,经同源建模得到模拟的Sm_2974三维结构,并与BsEG5C-1的结构进行对比,结果如图1所示。BsEG5C-1催化中心的F238位点突变后,突变体蛋白F238A的CMC酶活较原始蛋白基本不变(超过90%),但对滤纸、微晶纤维素以及pNPC的酶活力却大大降低,纤维素水解能力也显著减弱。说明F238残基对BsEG5C-1催化降解结晶纤维素的能力至关重要[6]。因此选取与BsEG5C-1相对应Sm_2974的W205位点进行氨基酸突变,考察该位点对Sm_2974催化能力的影响。

黄色为Sm_2974,灰色为BsEG5C-1
2.2 Sm_2974突变体构建
为了研究第205位氨基酸残基对Sm_2974水解纤维素能力的影响,对W205进行了氨基酸饱和突变,利用RF-Clone技术构建了Sm_2974突变体文库[5]。分别筛选到19种氨基酸突变菌株,突变体片段大小均与理论大小(930 bp)一致,利用KpnI和EcoR V进行重组质粒的酶切鉴定,经鉴定突变体质粒完全正确,证明Sm_2974突变体文库构建成功,如图2和图3所示。
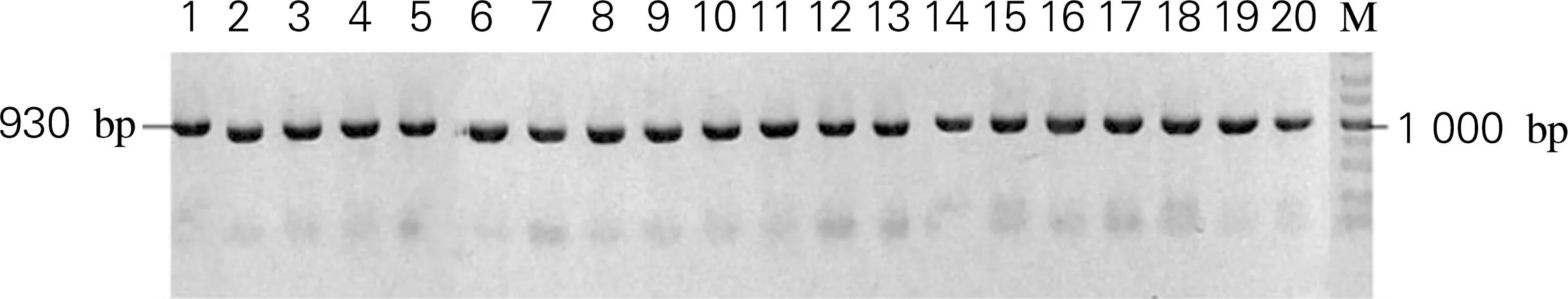
1,Sm_2974;2~20,Sm_2974突变体
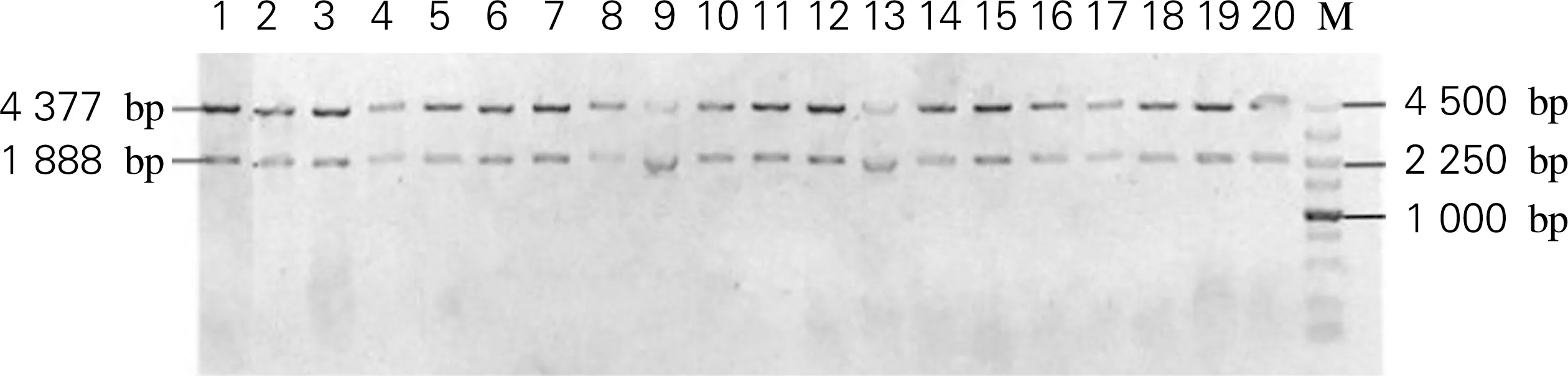
1,Sm_2974;2~20,Sm_2974突变体
2.3 Sm_2974突变体蛋白表达与纯化
将扩培、诱导后的突变体菌体经高压匀浆破碎后,分离上清与沉淀分别进行SDS-PAGE分析,所有突变体蛋白表达纯化后所显示目的条带均与理论大小(35.2 ku)一致,用作酶学性质分析的酶均为通过镍亲和层析柱纯化后并达到电泳纯的纯酶,即SDS-PAGE电泳结果显示为单一条带,如图4所示。
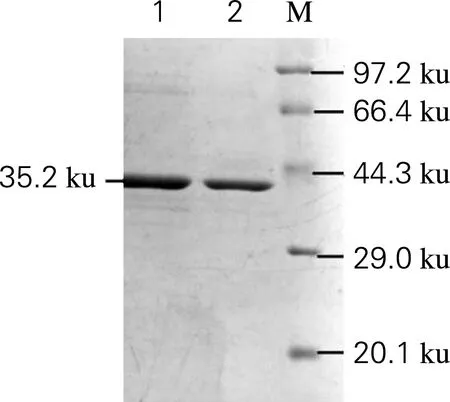
1,Sm_2974;2,Sm_2974突变体蛋白
2.4 Sm_2974及其突变体蛋白的酶活
如图5所示,所有的W205突变体蛋白的酶活力均低于天然酶。其中,色氨酸向苏氨酸的突变对Sm_2974的酶活力影响相对较小;当色氨酸突变为丙氨酸、天冬酰胺、精氨酸、半胱氨酸、甲硫氨酸和谷氨酰胺后,CMC酶活略有下降,但对pNPC的酶活力却损失了一半以上。W205突变为其他氨基酸时,两种酶活力均显著下降,尤其是W205Y的pNPC活力完全丧失,突变体蛋白表现为普通的内切纤维素酶,且CMC酶活仅为原来的7%。结果表明,第205位色氨酸残基对于Sm_2974的催化活性有一定的影响。

(a) CMC
2.5 Sm_2974及其突变体蛋白水解滤纸能力分析
选取对Sm_2974酶活力影响较小的8个突变体蛋白,比较天然酶与突变体蛋白作用滤纸后滤产生的可溶性还原糖,结果如表1所示。在10~60 min内,W205D在相同反应时间水解纸所得到的可溶性还原糖比Sm_2974高。反应60 min时,W205D作用于滤纸生成的可溶性还原糖较Sm_2974提高了12%,表明将W205突变为天冬氨酸,能够使得酶对纤维素底物的水解能力增强。W205Q与W205T作用于滤纸时,在5 min内未检测到可溶性还原糖,并且在5~60 min的反应时间内,生成的可溶性还原糖量始终低于天然酶,推测将第205位色氨酸突变为苏氨酸或者谷氨酰胺导致酶与底物的结合能力下降,进而影响酶的催化效率。结果表明,第205位色氨酸残基对Sm_2974 结合纤维素底物的能力以及催化底物水解的能力均具有显著影响,可能是酶活性中心的关键氨基酸残基。
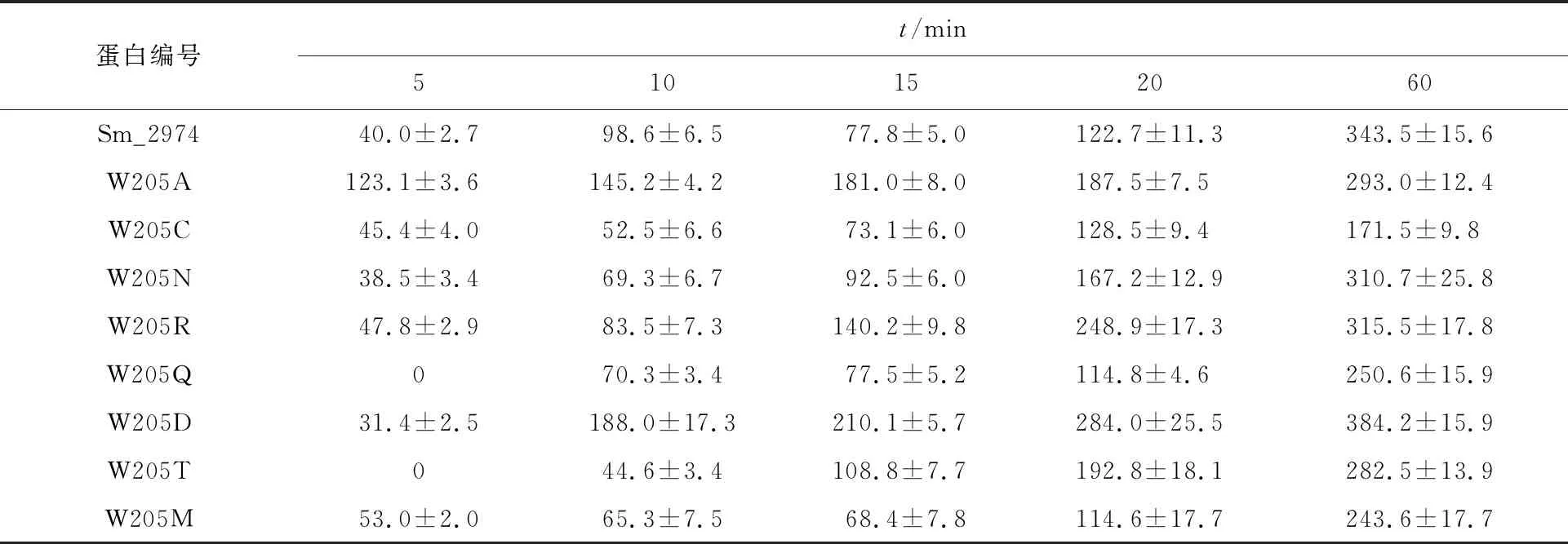
表1 Sm_2974及其突变体蛋白水解滤纸能力比较
3 结 论
通过序列比对及同源建模,选取Sm_2974蛋白的205位色氨酸残基进行饱和突变,考察该位点对酶蛋白催化活性的影响。实验结果表明,所有突变体蛋白的CMC酶活力和pNPC酶活力均比天然酶有所下降,尤其是W205Y完全丧失了pNPC酶活,仅残留了微弱的CMC酶活。但在水解滤纸时,在相同反应时间内生成的可溶性还原糖却比天然酶多,说明目前常用的测定纤维素酶活力的底物不能够表征纤维素酶的真实催化能力[7]。
目前对于GH5家族内切纤维素酶的研究表明,位于活性中心的芳香族氨基酸的突变会降低酶活或使水解能力明显降低甚至全部丧失[8-11]。本研究中,对W205的突变同样导致酶活力下降,且对酶催化纤维素水解能力和底物结合能力也有一定的影响。后续研究将利用分子对接技术阐明Sm_2974活性中心与纤维素底物的结合模式及关键氨基酸残基。
——一道江苏高考题的奥秘解读和拓展

