刺参AIF-1的原核表达、抗血清制备及表达
王 丽 君, 王 凤 鑫, 王 晗
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
刺参(Stichopusjaponicus)属棘皮动物门海参纲,具有较高的营养价值[1]。但刺参仅具有天然免疫功能[2],养殖过程中,致病微生物和寄生虫的感染时有发生。目前,研究者已经对刺参的免疫功能进行了大量的研究[3-4]。但是,目前针对刺参蛋白的抗血清较少,成为在蛋白水平上深入研究相关反应过程及机理的阻碍之一。
同种异体移植炎症因子-1(Allograft inflammatory factor-1,AIF-1)具有参与损伤、炎症反应等生物学功能[5-7],人[8]、鼠[9]等脊椎动物和海绵、海参[10]、海胆[11]、牡蛎[12-13]等无脊椎动物中均存在该基因。在刺参体壁、肠道、呼吸树、体腔细胞以及纵肌等组织细胞中已检测到转录水平的表达[9]。但是,目前关于刺参AIF-1抗体/抗血清制备的研究尚未见报道。制备刺参AIF-1抗血清,将为在蛋白水平分析刺参应激反应和免疫功能提供有益的研究工具。
本实验应用原核表达系统对刺参AIF-1进行重组表达及纯化,并免疫小鼠获得较高效价的小鼠抗刺参AIF-1抗血清,可以应用于蛋白免疫印迹及细胞免疫荧光检测。分析了灿烂弧菌体腔注射后,刺参体腔细胞和呼吸树组织AIF-1转录水平和蛋白水平表达的变化。
1 材料与方法
1.1 材料与试剂
小鼠,大连医科大学动物实验中心;刺参,大连海参养殖场;Trizol,生工生物工程(上海)股份有限公司;蛋白Marker,北京全式金生物技术有限公司;五周标准鼠单抗/多抗制备佐剂,北京索莱宝科技有限公司;PrimeScriptTM ⅡcDNA第一链合成试剂盒,TB Green©Premix Ex TaqTMⅡ(Tli RNaseH Plus)定量PCR试剂盒,宝生物工程(大连)有限公司;anti-β-actin一抗,美国Proteintech公司;HRP-二抗/FITC-二抗,美国Santa Cruze生物公司,其他试剂均为国产分析纯。
1.2 仪 器
电泳仪,美国Bio-rad公司;转膜仪,北京六一生物科技有限公司;酶标仪,Thermo Fisher公司;PCR反应扩增仪(T100),美国Bio-rad公司;荧光定量PCR仪,罗氏LightCycler480 Ⅱ;凝胶成像系统,上海天能科技有限公司;倒置荧光显微镜,OLYMPUS公司。
1.3 方 法
1.3.1AIF-1基因的扩增及载体构建
采用Trizol法提取刺参呼吸树总RNA,根据反转录试剂盒说明书合成cDNA,使用RT-PCR技术,分别依据编码区上下游序列设计引物。上游引物5′-ATGCCTGGAAGTAAACTGGAC-3′;下游引物5′-GGAACCAAATGTGGAATGTCC-3′扩增AIF-1基因,凝胶电泳检测PCR产物。由宝生物(大连)公司完成PCR产物测序,上海生工生物公司完成基因的体外合成及表达载体pET-29b(+)-AIF-1-his的构建。利用热休克技术将表达载体pET-29b(+)-AIF-1-his转化至大肠杆菌BL21(DE3)中。
1.3.2 重组蛋白的诱导表达与鉴定
将重组大肠杆菌BL21接种到卡那霉素液体选择性培养基,进一步扩大培养至OD6000.6左右。分别用0.25和0.50 mmol/L IPTG于20 ℃诱导表达16~20 h。4 ℃离心收集菌体,按1∶5的质量体积比加入裂解液、蛋白酶抑制剂和溶菌酶,于冰水浴超声破碎。
1.3.3 表达产物的纯化
采用镍离子螯和层析法纯化重组目的蛋白,洗脱液为50 mmol/L咪唑、50 mmol/L NaH2PO4和300 mmol/L NaCl。聚丙烯酰胺凝胶电泳检测,SDS-PAGE分析蛋白纯化效果。
1.3.4 鼠抗AIF-1抗血清的制备
应用纯化的AIF-1重组蛋白,1∶1混合5周标准鼠单抗/多抗制备佐剂对小鼠进行小腿免疫注射,每只鼠20 μg蛋白,3周后进行再次免疫,5周后取血清即为抗血清。
1.3.5 间接酶联免疫吸附检测
采用间接ELISA分析血清效价。抗原包被、洗板、封闭后,加入按比例梯度稀释的抗血清孵育,通过羊抗鼠二抗(HRP-IgG)孵育,显色,终止反应。在450 nm处测定吸光度,计算阴性对照组血清的A450平均值,以抗血清的A450大于等于阴性对照组的2.1倍时对应的抗血清稀释倍数作为效价。
1.3.6 蛋白免疫印迹检测
提取刺参呼吸树等组织蛋白,SDS-PAGE检测后,电转移至PVDF膜上。经封闭,抗血清孵育,二抗(HRP-IgG)孵育,应用增强化学发光法检测膜上的阳性条带。
1.3.7 细胞免疫荧光检测
通过细胞免疫荧光法检测体腔细胞AIF-1的表达。细胞接种于多聚赖氨酸包被的玻底平皿,经固定、透膜、封闭、抗血清封闭、二抗(FITC-IgG)孵育,Hoechst33342复染细胞核后,荧光显微镜下观察细胞AIF-1的表达。
1.3.8 灿烂弧菌体腔注射
灿烂弧菌(本实验室保藏)在NB液体培养基中180 r/min、30 ℃培养。离心收集菌体后重悬于过滤海水中。每头刺参体腔注射100 μL菌液(1.0×107CFU/mL),注射过滤海水刺参为对照组。8 h后提取体腔细胞和呼吸树组织RNA,荧光定量PCR分析AIF-1转录水平的变化。24 h后提取体腔细胞和呼吸树组织蛋白样品,蛋白免疫印迹分析AIF-1蛋白表达水平变化。
1.3.9 荧光定量PCR
提取总RNA经逆转录合成cDNA,以此为模板,进行荧光定量PCR分析(SYBR Green法)。刺参内参基因(细胞色素b)上游引物qCytb-F:TGAGCCGCAACAGTAATC;下游引物qCytb-R:AAGGGAAAAGGAAGTGAAAG。刺参AIF-1基因上游引物:qAIF-1-F:GTCGTTGCCAATGGTGAT;下游引物:qAIF-1-R:TGCCAGAGTTGTTCGTGT。mRNA相对表达量以体腔细胞内参基因Cytb表达水平为100%。
1.3.10 统计学分析
应用Student’s假设检验分析组间差异,P<0.05显著性差异(n=3)。
2 结果与讨论
2.1 AIF-1基因扩增的鉴定
如图1所示,PCR产物经琼脂糖电泳分析,可见预期大小的产物片段。PCR扩增产物与GenBank中KC708869序列一致,后续实验依据该序列的氨基酸顺序体外合成重组蛋白。
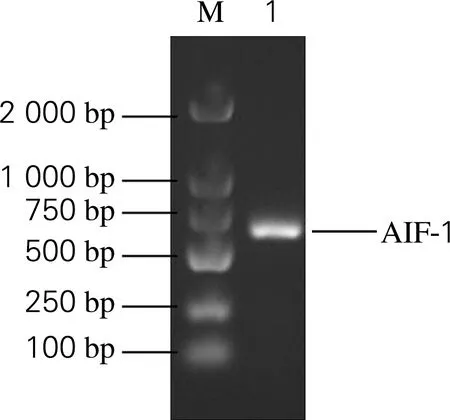
图1 凝胶电泳检测AIF-1基因扩增
2.2 目的蛋白的诱导表达鉴定
经IPTG诱导后,SDS-PAGE分析菌体裂解液上清中不同分子质量蛋白表达的变化。从图2中可以看出,1~4号出现分子质量约为17 ku的蛋白条带,与目的蛋白AIF-1的分子质量一致。而对照组(空载体)未检测到该分子质量的蛋白,提示该条带应为IPTG诱导后表达重组蛋白AIF-1。
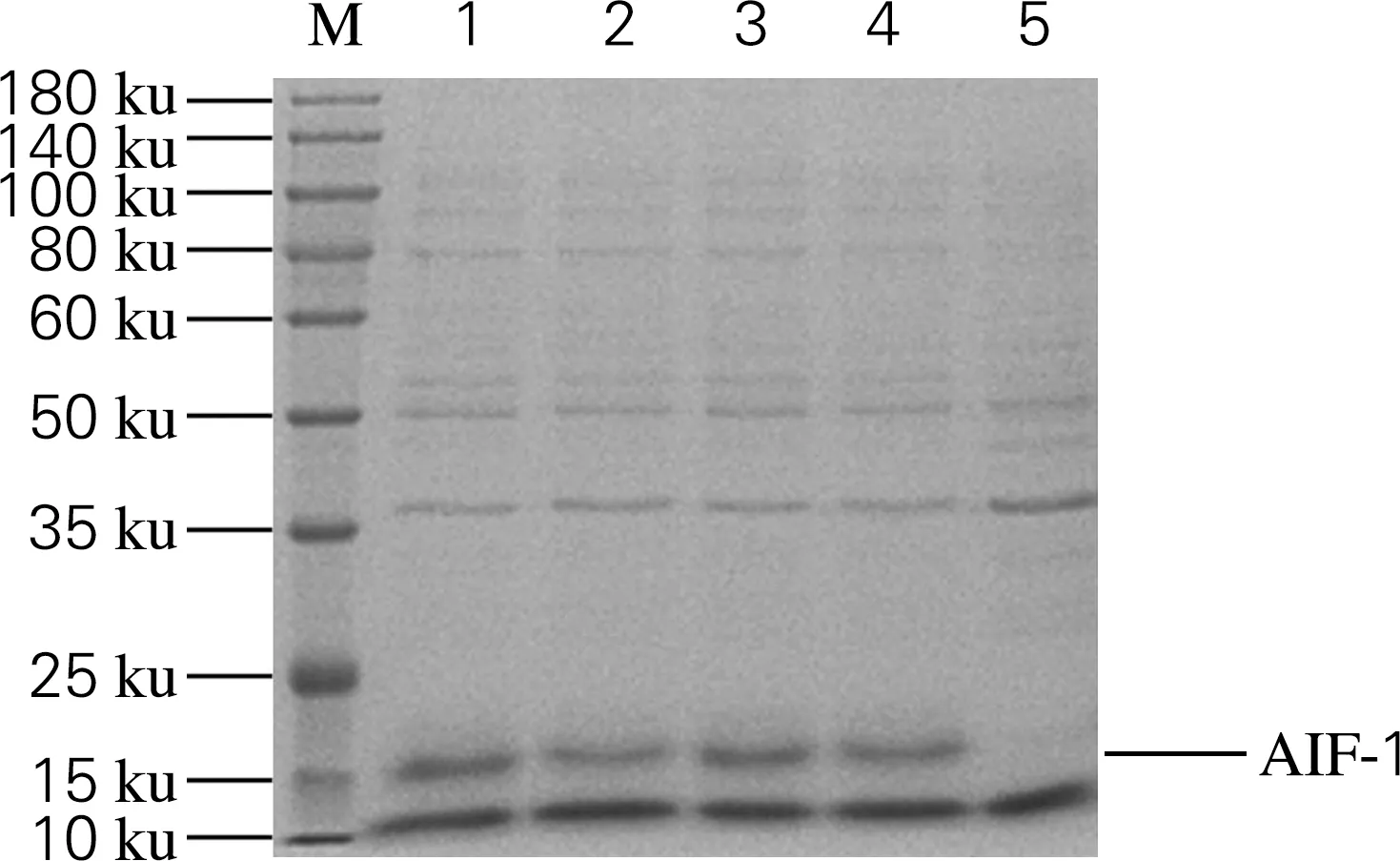
M,Marker;1~4,诱导后的菌体裂解液上清;5,对照组
2.3 表达产物的纯化结果
菌体裂解液上清采用镍离子亲和层析,通过SDS-PAGE检测纯化结果。从图3中可以看出,洗脱后样品在17 ku处出现明显的单一条带,未检测到杂蛋白带,表明纯化效果好,可以应用于免疫动物制备抗血清。
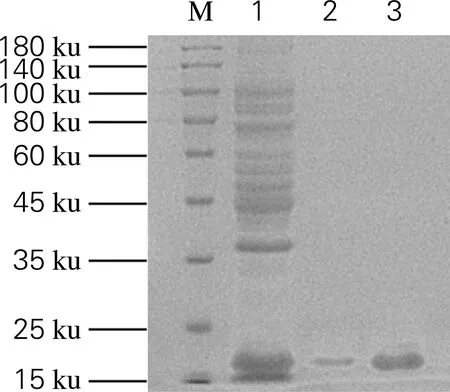
M,Marker;1,经IPTG诱导的菌体裂解液;2,洗脱液1;3,洗脱液2
2.4 间接酶联免疫吸附检测结果
如图4所示,鼠抗AIF-1抗血清效价为1∶102 400。提示制备的血清具有较高的效价,有利于其在免疫实验中的应用。
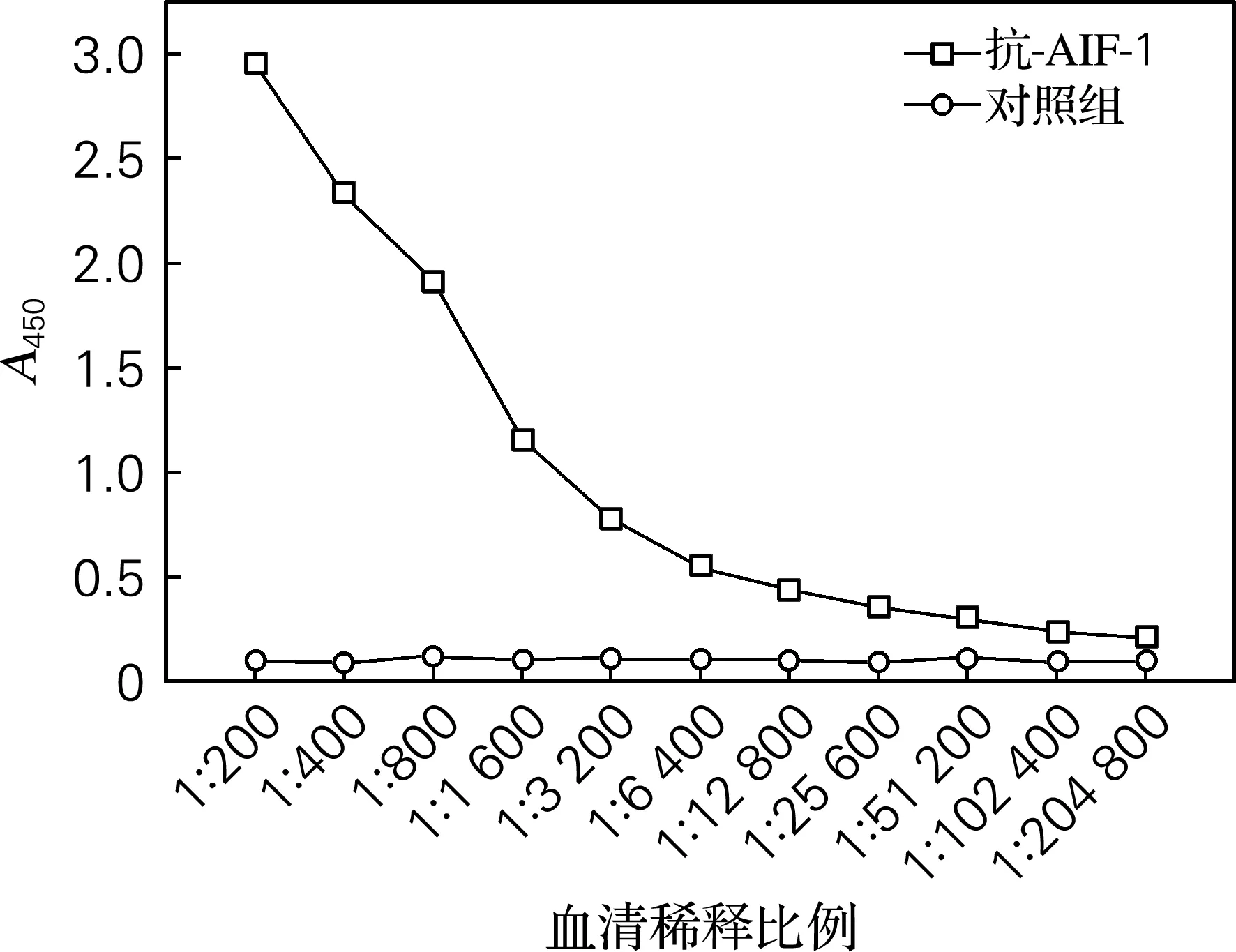
图4 间接ELISA法分析抗血清效价
2.5 蛋白免疫印迹检测结果
以制备的抗血清为一抗,应用蛋白免疫印迹技术分析刺参呼吸树组织和体腔细胞中AIF-1蛋白的表达。如图5所示,刺参呼吸树组织和体腔细胞均检测到AIF-1蛋白的表达。提示制备的抗血清可以应用于蛋白免疫印迹技术,用于刺参组织中内源表达的蛋白样品的检测。

1,呼吸树组织蛋白;2,体腔细胞蛋白
2.6 细胞免疫荧光检测
以制备的抗血清为一抗,应用细胞免疫荧光技术分析体腔细胞AIF-1蛋白的表达,结果如图6所示。从图6可以看到,检测到AIF-1蛋白表达阳性的体腔细胞(绿色),提示制备的抗血清可以用于AIF-1蛋白在细胞原位表达的检测。
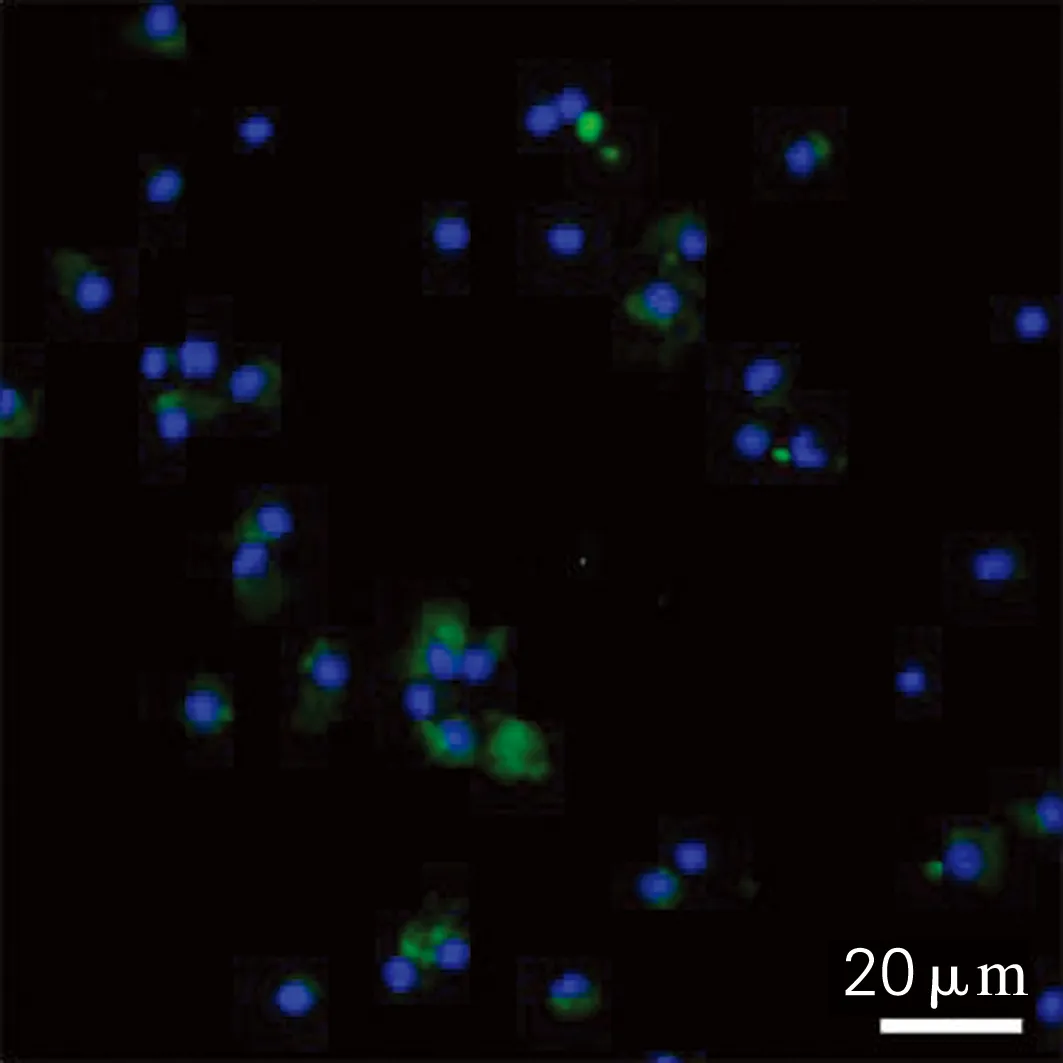
绿色,AIF-1阳性细胞;蓝色,Hoechst 33342染色后的细胞核
2.7 灿烂弧菌免疫刺激后AIF-1转录水平和蛋白水平表达的变化
灿烂弧菌是刺参常见的致病菌,应用灿烂弧菌体腔注射,分析免疫刺激后刺参AIF-1转录水平和蛋白水平的表达,结果如图7所示。荧光定量PCR结果显示,灿烂弧菌体腔注射能够显著上调呼吸树组织和体腔细胞AIF-1转录水平的表达(图7(a))。同时,蛋白免疫印迹结果也发现,灿烂弧菌的免疫刺激明显增加了呼吸树组织和体腔细胞AIF-1蛋白表达,与转录水平的结果一致(图7(b))。
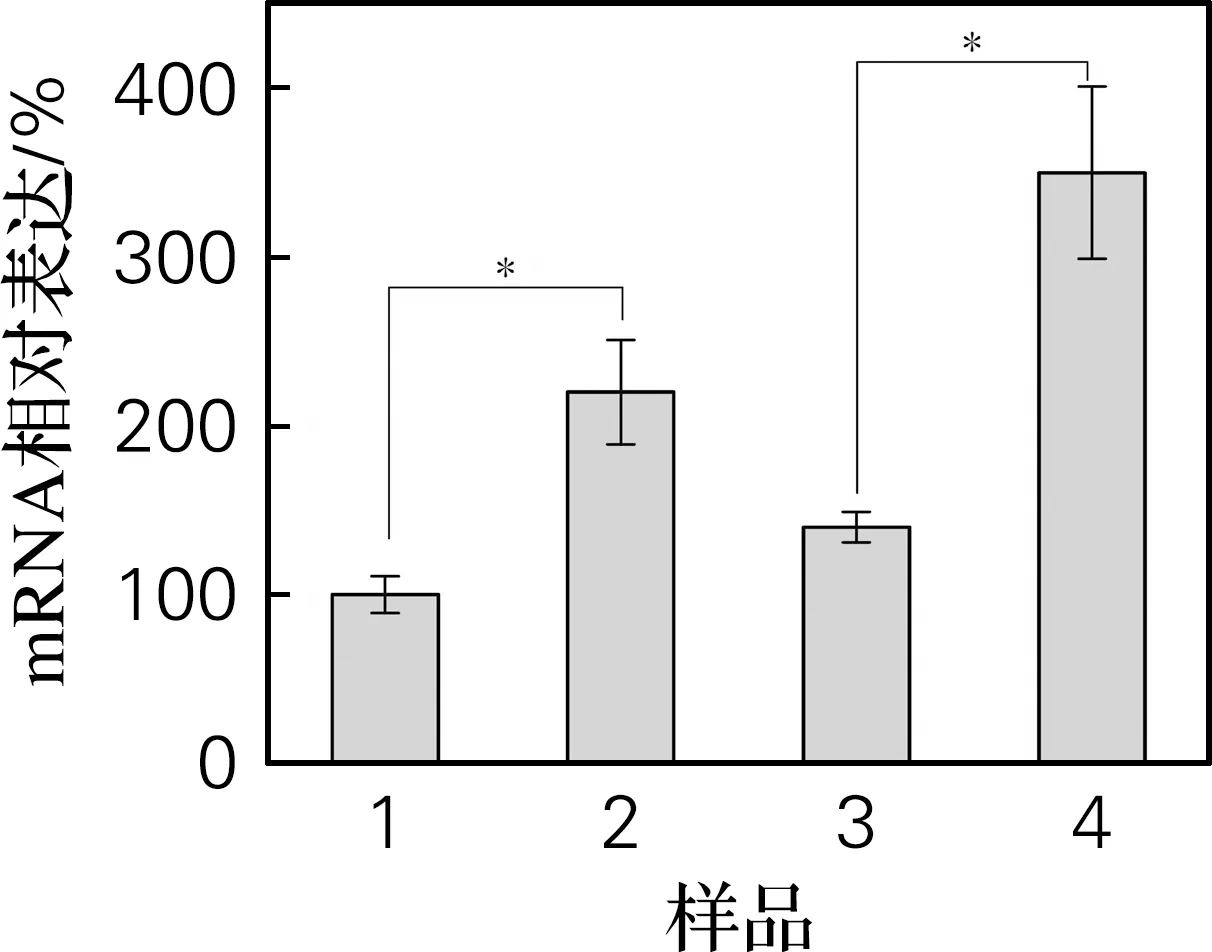
(a) 荧光定量PCR
3 结 论
应用原核表达体系成功表达并纯化了带有His标签的刺参AIF-1重组蛋白,该蛋白以可溶性和包涵体两种形式表达,可溶性重组蛋白具有很好的免疫原性,免疫小鼠后制备出了具有较高效价的鼠抗AIF-1抗血清,可以应用于蛋白免疫印迹和细胞免疫荧光实验用于刺参AIF-1蛋白在蛋白样品中以及细胞原位表达的检测。应用制备的抗血清对刺参呼吸树组织和体腔细胞的AIF-1蛋白表达及灿烂弧菌体腔注射进行免疫刺激,对AIF-1表达的影响进行了分析,发现免疫刺激能够明显提高刺参呼吸树和体腔细胞AIF-1蛋白的表达。

