腹腔注射多氯联苯118 的雄性大鼠甲状腺功能变化观察及其机制探讨
朱晓霞,许文立,段宇
南京医科大学第一附属医院内分泌科,南京 210029
多氯联苯(polychlorinated biphenyls,PCBs)是一种人工合成的持久性有机环境污染物,曾作为冷却剂、热载体和绝缘油等广泛用于工业生产中。PCBs的化学稳定性高、难以分解,目前普遍存在于水、土壤和空气中[1]。PCBs 的高亲脂性导致其在生物体内积聚,并沿着食物链进一步富集,对动物和人类造成一系列不良影响,如致癌、认知和行为异常、致畸和内分泌代谢紊乱等[2-3]。PCBs 对甲状腺组织高度亲和,可直接沉积在甲状腺组织中。长期暴露于富含PCBs 环境中的人群、海洋生物或野生哺乳类动物甲状腺组织中均可检测出PCBs,并出现甲状腺分泌功能下降及甲状腺组织纤维化[4-5]。甲状腺功能异常已成为糖尿病、肥胖、脂质异常等多种衰老相关性疾病的独立危险因素[6-8]。我们前期研究[9-10]发现,持续低剂量PCB118 暴露可导致大鼠甲状腺功能异常,甲状腺组织间质纤维化、炎症浸润,但其发生机制尚未明确。2021 年6 月起,我们观察了PCB118 腹腔注射后Wistar 大鼠甲状腺功能变化,评估了甲状腺组织的衰老程度,检测了衰老基因、SASP、线粒体动力学因子的表达,为进一步揭示PCB118 引发甲状腺功能异常的作用机制提供一定的依据。
1 材料与方法
1.1 动物、试剂及仪器 24 只8 周龄SPF 级雄性Wistar 大鼠,体质量(225 ± 20)g,购于Vital River 公司(中国北京),饲养于南京医科大学动物实验中心,饲养条件为相对湿度50%~60%,环境温度20 ℃~25 ℃,明暗周期12 h,自由摄食及饮水。纯度100%的PCB118(No. 31508-00-6)购自美国Ac‐cuStandard 公司,溶解于玉米油(C8267,美国Sigma公司)中,避光常温保存。ELISA 试剂盒购自中国麦莎公司,细胞衰老相关β-半乳糖苷酶(SA-β-gal)染色试剂盒购自中国碧云天,总RNA 提取试剂盒购自美国Invitrogen 公司,逆转录试剂盒PrimeScript RT Master Mix Kit 购自美国TaKaRa 公司,、SYBR-Green PCR 试剂盒购自中国诺维赞公司,StepOnePlus 实时定量PCR 仪购自美国AppliedBiosystems 公司,qRTPCR 引物由上海英俊公司合成。
1.2 大鼠分组及PCB118 腹腔注射方法 24 只大鼠适应性饲养1 周后随机分为A、B、C 及对照组4组,每组6 只。A、B 及C 组大鼠分别用10、100 和1 000 μg/(kg·d)的PCB118 腹腔注射,1 天/次,一周5 次,共注射13 周。对照组用等容积玉米油腹腔注射,1 天/次,一周5 次,共注射13 周。造模期间大鼠无行为异常,各组大鼠体质量变化无统计学差异。
1.3 各组大鼠甲状腺功能指标观察 造模结束时处死各组大鼠,心脏取血并分离血清,-80 ℃保存备用,采用ELISA 试剂盒测定各组大鼠血清游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)及促甲状腺激素(TSH),所有操作均严格按照使用说明书进行。留空白孔调零,使用酶标仪测量标准品及样品的光密度OD 值。根据标准品浓度及吸光度值建立标准曲线后计算样品的浓度。试验重复3 次,取平均值。
1.4 各组大鼠甲状腺组织衰老情况观察 采用SA-β-gal染色评估甲状腺组织衰老情况。处死各组大鼠后取新鲜甲状腺组织,冰冻切片,使用细胞衰老β-半乳糖苷酶染色试剂盒对组织的冰冻切片进行SA-β-gal 染色,所有操作均严格按照使用说明书进行。显微镜下观察各组大鼠甲状腺组织SA-β-gal表达情况。SA-β-gal染色以X-Gal为底物,在衰老特异性的SA-β-gal 催化下会生成深蓝色产物,光学显微镜下可观察到表达SA-β-gal的组织变为蓝色。对各组大鼠甲状腺组织SA-β-gal 染色情况进行计量分析,测算各组SA-β-gal 染色阳性率。实验重复3 次,取平均值。
1.5 各组大鼠甲状腺组织衰老基因、衰老相关分泌表型中的部分因子及线粒体动力学相关蛋白的基因表达检测 采用实时荧光定量PCR(qRT-PCR)法检测各组大鼠甲状腺组织衰老基因(p16、p21、p53)、衰老相关分泌表型标志物[白细胞介素-1α(IL-1α)、肿瘤坏死因子α(TNFα)、白细胞介素-6(IL-6)、基质金属肽酶13(MMP13)]mRNA、线粒体动力学相关蛋白[线粒体自噬调节因子PTEN诱导激酶1(PINK1)、线粒体动力相关蛋白1(DNM1L)、线粒体融合蛋白1(MFN1)、线粒体融合蛋白2(MFN2)mRNA。取各组甲状腺组织,根据说明书用总RNA 提取试剂盒提取大鼠甲状腺组织的总RNA,用逆转录试剂盒逆转录后获得cDNA。使用SYBR-Green PCR 试剂盒在Ste‐pOnePlus 系统上进行qRT-PCR。以β-actin 作内参,β-actin 上游引物5'-GACAACTTTGGCATCGTGGA-3',下游引物5'-ATGCAGGGATGATGTTCTGG-3;p21 上游引物5'- ATGTCCGATCCTGGTGATGTCC‐GA-3',下游引物 5'- TCAGGGCTTTCTCTTG‐CAGAAGAC-3;p16 上游引物5'- TACCCCGATA‐CAGGTGATGA-3',下游引物5'-TACCGCAAATACC‐GCACGA-3;p53 上游引物5'-GTCGGCTCCGAC‐TATACCACTATC-3',下游引物 5'-CTCTCTTTG‐CACTCCCTGGGG-3;IL-6 上游引物5'-GTCAACTC‐CATCTGCCCTTC-3',下游引物 5'-TGTGGGTGG‐TATCCTCTGTG-3;TNF- α 上游引物 5'-CATCC‐GTTCTCTACCCAGCC-3',下游引物 5'-AATTCT‐GAGCCCGGAGTTGG-3;IL-1α 上游引物5'-AAGA‐CAAGCCTGTGTTGCTGAAGG-3',下游引物 5'-TCCCAGAAGAAAATGAGGTCGGTC-3;MMP13 上游引物5'-TGATGGGCCTTCTGGTCTTCT-3',下游引物5'-AGGTCTCGGGATGGATGCT-3;PINK1 上游引物5'-AATGCCGCTGTGTATGAAGC-3',下游引物5'-CTCCCCATCTGCTCCCTTT-3;DNM1L 上游引物5'-TCCCTAAACTCCATGATGCCATA-3',下游引物5'-CCACAGGCATCAGCAAAGTC-3;MFN1 上游引物5'-CCTTGTACATCGATTCCTGGGTTC-3',下游引物5'-CCTGGGCTGCATTATCTGGTG-3;MFN2 上游引物5'-TCAAGCGCCAGTTTGTGGAG-3',下游引物5'-CACAGATGAGCAAATGTCCCAGA-3。 以 2-ΔΔCT代表目的基因的相对表达量。实验重复3 次,取平均值。
1.6 统计学方法 使用GraphPad Prism 8 统计软件进行数据处理。应用Shapiro-Wilk 法检验计量资料的正态分布,符合正态分布的计量资料以±s表示,多组比较采用单因素方差分析,进一步组间比较采用Tukey 法。P< 0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠血清FT4、FT3 及TSH 水平比较 各组大血清FT4、FT3及TSH水平比较见表1。
表1 各组大鼠血清FT4、FT3及TSH水平比较(±s)
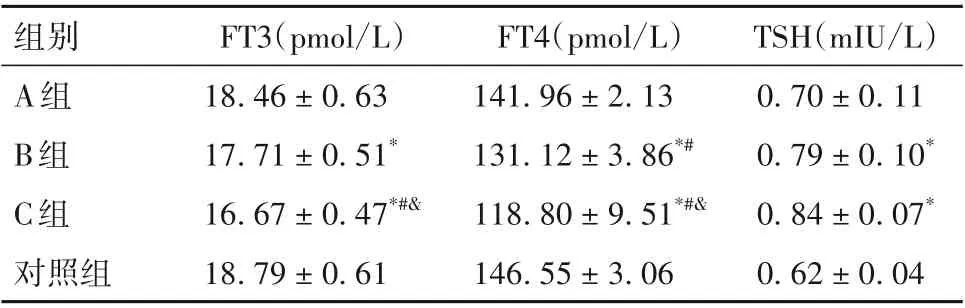
表1 各组大鼠血清FT4、FT3及TSH水平比较(±s)
注:与对照组比较,*P<0.05;与A 组比较,#P < 0.05;与B 组比较,&P<0.05。
TSH(mIU/L)0.70±0.11 0.79±0.10*0.84±0.07*0.62±0.04组别A组B组C组对照组FT3(pmol/L)18.46±0.63 17.71±0.51*16.67±0.47*#&18.79±0.61 FT4(pmol/L)141.96±2.13 131.12±3.86*#118.80±9.51*#&146.55±3.06
2.2 各组大鼠甲状腺组织SA-β-gal 染色阳性率比较 A、B、C及对照组大鼠甲状腺组织SA-β-gal染色阳性率分别为15.46%±4.81%、15.84%±9.15%、31.04%±7.61%、4.14%±2.91%。与对照组比较,A、B、C组大鼠甲状腺组织SA-β-gal染色阳性率升高(P均<0.05);与A、B 组比较,C 组大鼠甲状腺组织SA-β-gal染色阳性率高(P<0.05)。
2.3 各组大鼠甲状腺组织p16、p21及p53基因相对表达量比较 各组大鼠甲状腺组织p16、p21 及p53基因相对表达量比较见表2。
表2 各组大鼠甲状腺p16、p21及p53基因相对表达量比较(±s)
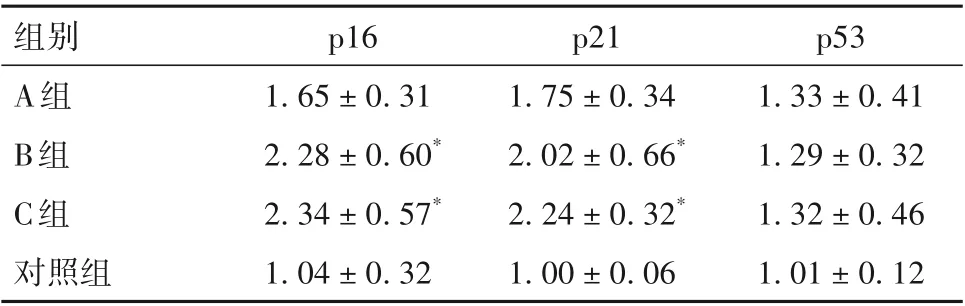
表2 各组大鼠甲状腺p16、p21及p53基因相对表达量比较(±s)
注:与对照组比较,*P<0.05。
组别A组B组C组对照组p53 1.33±0.41 1.29±0.32 1.32±0.46 1.01±0.12 p16 1.65±0.31 2.28±0.60*2.34±0.57*1.04±0.32 p21 1.75±0.34 2.02±0.66*2.24±0.32*1.00±0.06
2.4 各组大鼠甲状腺组织IL-6、TNFα、MMP13及IL-1α的基因相对表达量比较 各组大鼠甲状腺组织IL-6、TNFα、MMP13及IL-1α基因相对表达量比较见表3。
表3 各组大鼠甲状腺组织IL-6、TNFα、MMP13及IL-1α基因相对表达量比较(±s)
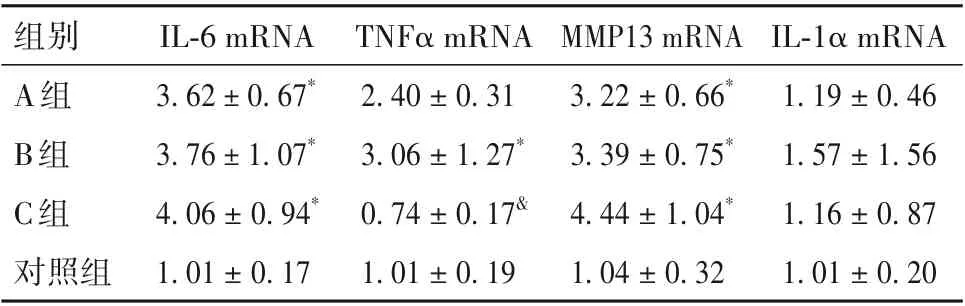
表3 各组大鼠甲状腺组织IL-6、TNFα、MMP13及IL-1α基因相对表达量比较(±s)
注:与对照组比较,*P<0.05;与B组比较,&P<0.05。
组别A组B组C组对照组IL-1α mRNA 1.19±0.46 1.57±1.56 1.16±0.87 1.01±0.20 IL-6 mRNA 3.62±0.67*3.76±1.07*4.06±0.94*1.01±0.17 TNFα mRNA 2.40±0.31 3.06±1.27*0.74±0.17&1.01±0.19 MMP13 mRNA 3.22±0.66*3.39±0.75*4.44±1.04*1.04±0.32
2.5 各组大鼠甲状腺组织PINK1 mRNA、DNM1L mRNA、MFN1 mRNA及MFN2 mRNA相对表达量比较 各组大鼠甲状腺组织PINK1 mRNA、DNM1L mRNA、MFN1 mRNA及MFN2 mRNA相对表达量比较见表4。
表4 各组大鼠甲状腺组织PINK1 mRNA、DNM1L mRNA、MFN1 mRNA及MFN2 mRNA相对表达量比较(±s)
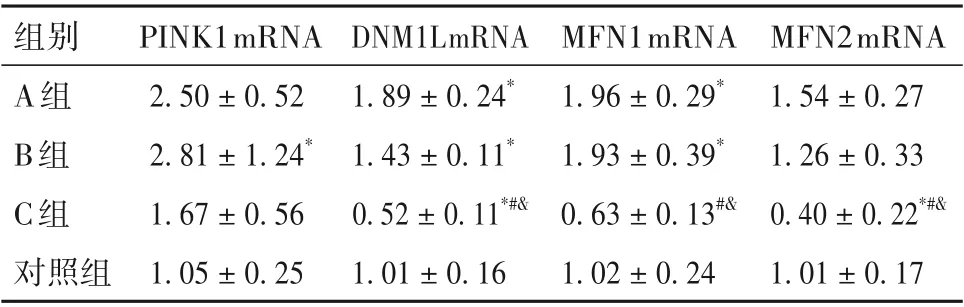
表4 各组大鼠甲状腺组织PINK1 mRNA、DNM1L mRNA、MFN1 mRNA及MFN2 mRNA相对表达量比较(±s)
注:与对照组比较,*P<0.05;与A 组比较,#P < 0.05;与B 组比较,&P<0.05。
MFN2mRNA 1.54±0.27 1.26±0.33 0.40±0.22*#&1.01±0.17组别A组B组C组对照组PINK1mRNA 2.50±0.52 2.81±1.24*1.67±0.56 1.05±0.25 DNM1LmRNA 1.89±0.24*1.43±0.11*0.52±0.11*#&1.01±0.16 MFN1mRNA 1.96±0.29*1.93±0.39*0.63±0.13#&1.02±0.24
3 讨论
PCBs 是一种在环境中广泛存在的环境内分泌干扰物,它可以通过食物持久蓄积于生物体内,已被证明可造成动物和人体神经、免疫、生殖、内分泌系统等多组织、多系统损伤[11]。PCBs 可影响人体淋巴细胞的端粒酶活性,加速端粒缩短。端粒是染色体末端高度重复的核苷酸序列,可保护染色体免受侵蚀,对保持基因组稳定性至关重要[12]。随机体老化,端粒酶活性会降低、端粒缩短。由此推测PCBs可能会加速机体衰老,但目前关于PCBs 是否促进甲状腺衰老的研究尚缺乏。PCB118 在我国长三角地区广泛存在,常作为评估环境中多氯联苯总量的指标[13],因此本研究选用PCB118 作为PCBs 同系物的代表,研究PCBs 能否引起大鼠甲状腺衰老及其潜在机制。
衰老是一个普遍的、内在的和复杂的过程,其特征是组织和器官功能逐渐丧失[14]。流行病学调查[7]显示在老年人群中的随着年龄增大其甲状腺分泌功能降低,表现为血清中FT4 及FT3 水平降低、TSH 升高。本研究中我们检测了对照组及PCB118 暴露组的大鼠血清甲状腺功能,结果显示暴露组大鼠出现明显的甲状腺功能异常。血清FT3、FT4 水平随着PCB118 剂量的增加而下降,TSH水平则随着PCB118 剂量的增加而上升,这与老化进程中甲状腺功能的变化相一致,提示PCB118 暴露导致了大鼠甲状腺功能降低,这可能是甲状腺早衰引起的。
细胞衰老是脊椎动物和人类衰老的标志,衰老细胞的存在及累积可造成组织器官损伤,导致患心血管疾病、糖尿病和神经退行性疾病等疾病的风险增加[15]。衰老反应引起细胞表型的显著变化,包括细胞分裂潜能的不可逆性尚失、细胞凋亡抗性的发生以及基因表达模式的改变[16],这些变化可以被一些标记物识别。SA-β-gal是用于具体识别衰老细胞的第一个标记。SA-β-gal一直是用于在体外或体内识别衰老细胞的最广泛使用的可靠生物标志物,它的活性通常通过用显色底物X-gal 进行原位染色来确定[17]。本研究中SA-β-gal 染色显示,对照组可看到稀疏散在的被染成蓝色的甲状腺细胞、且染色很浅,而在PCB118暴露组大鼠甲状腺组织SA-β-gal活性增强、催化生成的深蓝色产物明显增多,在光学显微镜下表现为蓝染强度增强、面积增大,并且随着PCB118 浓度的增加这种变化越来越明显,C 组可观察到蓝色最深、且蓝染面积最大。同时我们对其进行了计量分析也发现PCB118 处理组的SA-β-gal 染色阳性占比明显高于对照组,C 组中SA-β-gal 染色阳性率显著高于A、B 组及对照组,提示PC118 暴露可致大鼠甲状腺组织内衰老细胞累积,且衰老细胞随着PC118 暴露浓度的增高而进一步增多。
衰老细胞决定性特征之一是稳定的细胞周期停滞,它的基因表达谱也发生极端变化,尤其是与细胞周期抑制剂或激活剂相关的基因,如p21、p16的过度表达。p21 和p16 是p53 和RB 控制的肿瘤抑制通路的组成部分,其中p21 基因被认为是唯一已知的具有促衰老功能的介质,p21 结合并调节细胞周期蛋白依赖性激酶2(CDK2),导致细胞的G1周期停滞和衰老。p21 的作用主要在于衰老的启动,而p16 则可保持持久的生长停止。在本研究中,p21、p16 相对表达量随PCB118 暴露浓度增加均显著上升。p21、p16、p53 通常以协同或相互关联的方式起作用以阻断细胞周期并实施衰老程序,但在不同细胞类型或物种中它们发挥的作用不同。高表达的p21 或p16 可诱导人成纤维细胞周期停滞,p53 在小鼠胚胎成纤维细胞的衰老中发挥重要作用[18]。本研究结果显示,在PCB118 诱导大鼠甲状腺组织衰老的过程中p16、p21 发挥重要的作用。
以往研究认为,细胞衰老是一种静态的细胞命运。最新研究发现,衰老是一个动态的多步骤过程。尽管最初的衰老诱导信号足以启动细胞周期退出,但这仅仅是衰老过程的早期步骤。衰老细胞逐渐重塑染色质,形成独特的分泌蛋白谱,包括多种促炎细胞因子、生长因子和细胞外基质降解蛋白,其特征是持续的促炎性表型,称为衰老相关分泌表型,进入“完全衰老”的第二步[19]。尽管它们的生长停滞,衰老细胞仍具有代谢活性并且可以影响它们的微环境,衰老相关分泌表型能在邻近的年轻细胞中诱导衰老,促进炎症和功能障碍向邻近细胞的传播[15]。衰老相关分泌表型已被证实与老龄化和年龄相关疾病密切相关。低水平慢性炎症(也称为“无菌炎症”)是许多年龄相关疾病的病理学基础。消除衰老细胞可以降低老年小鼠脂肪、肾脏和骨骼肌中的促炎细胞因子水平,如IL-6、IL-1α 和TNF-α[15]。其中IL-6 被认为是衰老相关分泌表型的核心之一,它在多种类型的衰老组织或细胞中表达上升,包括衰老的垂体组织及甲状腺细胞等[20]。MMP13 则是一种重要的细胞外基质降解蛋白。我们检测了IL-6、TNFα、MMP13、IL-1α 的基因表达水平,qRT-PCR 结果显示IL-6 在PCB118 暴露组中mRNA 相对表达量均显著上升,MMP13、TNFα 在B 组也显著上升,而IL-1α 在各组之间无显著差异。这些结果表明暴露组甲状腺处于衰老相关变化的风险中。
线粒体是机体重要的细胞器,在调节能量和新陈代谢稳态中起着关键作用。长期以来线粒体代谢紊乱和ROS 产生在衰老中的作用已经得到广泛证实。近年有研究结果揭示了线粒体膜动力学受损和线粒体质量控制机制在衰老中的作用[21]。线粒体膜动力学通过不断交替进行的融合—裂变来调节线粒体数量、形态和分布,以确保线粒体网络适应细胞生物能量需求。线粒体融合可使细胞器拉长,扩大线粒体网络及其互连性,重新分配能量,改善钙稳态和ATP 合成;裂变则将功能受损的组件分离出来以待线粒体自噬将其进一步去除。线粒体自噬是一种通过自噬机制选择性清除受损或功能失调的线粒体的过程,其功能是维持线粒体质量控制和体内平衡。线粒体自噬对细胞活动非常重要,因为它可以清除严重受损的线粒体,减少有害物质的产生,抵消线粒体损伤的遗传积累。许多研究表明,线粒体融合、裂变和线粒体自噬可能参与细胞衰老,而在多种年龄相关性疾病中也观察到了线粒体动力学稳态的失衡[22]。
线粒体裂变和融合分别由DNM1L 和MFN1/2介导,PINK1 则是线粒体自噬的主要调节因子。在本研究中,PINK1、DNM1L、MFN1/2 的表达在PCB118 暴露后都发生了显著改变。DNM1L、MFN1 在A、B 组中表达升高,在C 组表达显著降低,证实低、中浓度的PCB118 即可扰乱线粒体动力学的稳态,而更高浓度的PCB118 可使线粒体损伤进一步加重。PINK1 靶向线粒体,稳定状态期间PINK1可以通过线粒体蛋白穿梭机制转运到线粒体基质中被蛋白酶降解,但在线粒体损伤的情况下、线粒体膜电位降低,PINK1 无法转移到线粒体中被降解[23]。本研究中,PINK1 在PCB118 暴露组表达上调,反映PCB118 暴露后甲状腺组织中受损线粒体积累,这可能与PCB118加速了甲状腺衰老相关。
综上所述,PCB118 腹腔注射的大鼠甲状腺功能减退、甲状腺组织衰老程度高,衰老基因p16、p21 表达升高,衰老相关分泌表型标志物IL-6 mRNA、TNFα mRNA 及MMP13 mRNA 表达升高,线粒体线粒体动力学相关蛋白PINK1 mRNA、DNM1L mRNA、MFN1 mRNA 表达升高。PCB118 可能通过诱导大鼠甲状腺组织线粒体动力学紊乱、上调衰老基因表达、促进衰老衰老相关分泌表型标志物表达,促进甲状腺组织衰老,导致大鼠甲状腺功能减退。

