3例携带微小额外标记染色体的胎儿及其父母染色体核型分析
范美荣,顾志乐,宋旭梅,随瑞枝
1 宁夏医科大学总医院医学实验中心,银川 750004;2 宁夏回族自治区银川市第一人民医院大庙社区卫生服务站
额外微小标记染色体(small supernumer‐ary markerchromosome,sSMC)是指在人类正常染色体核型基础上额外增加的一条染色体,通过细胞遗传学技术能够辨认、但却无法确定其来源和结构,其大小在中期分裂相中一般≤20 号染色体[1]。携带sSMC患者的临床表型可以正常,也可以表现出生长发育迟缓、智力障碍及器质性疾病等严重的临床表征。通常认为携带由异染色质、随体等不含遗传物质的染色体部分组成的sSMC 的患者表型多正常,且大多遗传自双亲[2]。而携带富含常染色体或性染色体遗传物质的sSMC 的患者则会出现相应临床表型,表型的严重程度主要取决于sSMC 遗传物质来源于哪条染色体、片段大小和嵌合比例等因素[3-4]。传统染色体核型分析法可识别sSMC,但无法确定sSMC片段来源及染色体变异对临床表型的影响,给临床产前诊断和遗传咨询带来极大困扰。精确分析sSMC的来源和sSMC结构组成是目前产前诊断的研究热点。微阵列比较基因组杂交(array comparative genomic hybridization,aCGH)技术是一种分子遗传学技术,通过对全基因组拷贝数变异(copy number variants,CNVs)进行全方面、高通量的检测,快速准确检测出基因组中的非平衡性变异,可精确判断sSMC的来源和性质,还可以进一步预判胎儿的临床表型及预测疾病严重程度[5],已广泛应用于疑难sSMC 的诊疗和产前诊断遗传咨询中。我们分析了3 例携带sSMC 胎儿的染色体核型,并进一步用aCGH 技术明确sSMC 的来源及胎儿可能临床表征,现将结果报告如下。
1 资料与方法
1.1 临床资料 选取2017 年1 月至2021 年12 月来本院产前诊断中心就诊并进行羊膜腔穿刺的孕妇,有三例胎儿羊水染色体核型分析结果显示增加一条sSMC。例1 孕妇,26 岁,孕1 产0,因唐氏筛查21-三体高风险(风险值为1/78)行产前诊断,超声学检查未发现异常。例2 孕妇,36 岁,孕1 产0,超声结果提示“胎儿宫内发育迟缓、脑积水、脊柱后凸”,因高龄妊娠及超声异常行产前诊断。例3 孕妇,38 岁,孕4 产1,第一胎为表型正常女孩,后经两次自然流产,因高龄妊娠及反复自然流产行产前诊断,超声学检查未发现异常。以上3 对夫妻签署知情同意后进行羊膜腔穿刺,胎儿羊水染色体结果显示异常后遂召回三对夫妇及例3 胎儿姐姐进行外周血染色体检查,同时采用3 例胎儿的羊水备管进行aCGH 检测。
1.2 羊水及外周血细胞染色体检测 ①按照传统羊水及外周血染色体核型的制备方法。培养后的羊水及外周血细胞经消化、低渗、预固定、固定、制片、显带等步骤后进行染色体核型分析。ZEISS 染色体核型分析系统每例计数20 个分裂像,分析至少5 个核型,嵌合体计数加至100 个分裂像。按照《人类细胞遗传学国际命名体制(ISCN2020)》确定胎儿染色体核型。②aCGH 检测 使用美国Af‐fymetrix CytoScan ®HD Array 微阵列芯片进行分析,实验方法依据厂家提供的标准操作规程进行。包括限制性酶消化、消化产物连接、PCR 扩增、PCR产物的纯化、片段化、片段化产物的标记、芯片杂交和芯片洗涤、染色、扫描等步骤。扫描获得的数据使用Chromosome Analysis Suite 软件进行结果分析。通过与DGV、DECIPHER、OMIM 等国际公认数据库比对进行结果判读。
2 结果
常规G 显带320-400 条带核型分析结果显示胎儿1 染色体核型为47,XX,+ mar[78]/46,XX[22](图1),即胎儿核型为一嵌合体,随机选取100个分裂像进行计数分析,其中78%的分裂像携带有sSMC,其余22%的分裂像为正常核型。其父母染色体核型均未见异常。胎儿2染色体核型为47,XY,+mar(图2),其父母染色体核型均未见异常。胎儿3和其父亲染色体核型均为47,XY,+mar(图3),其母亲及姐姐染色体核型未见异常。
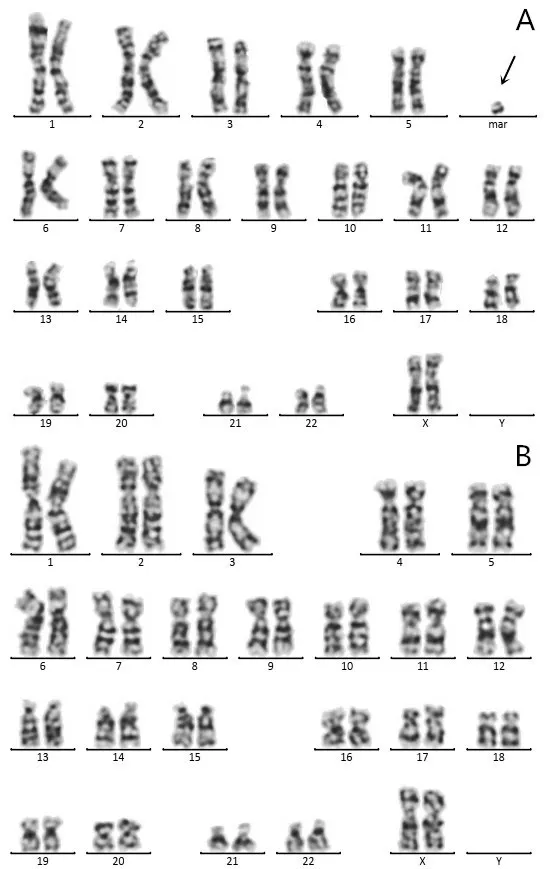
图1 胎儿1的47,XX,+mar[78]/46,XX[22]染色体核型
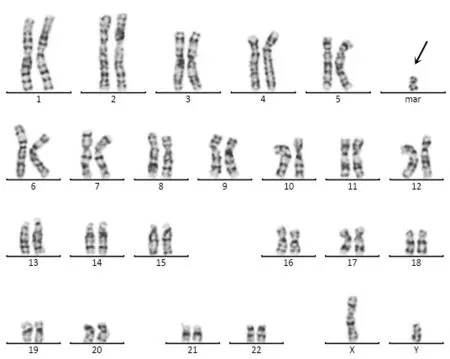
图2 胎儿2的47,XY,+mar染色体核型
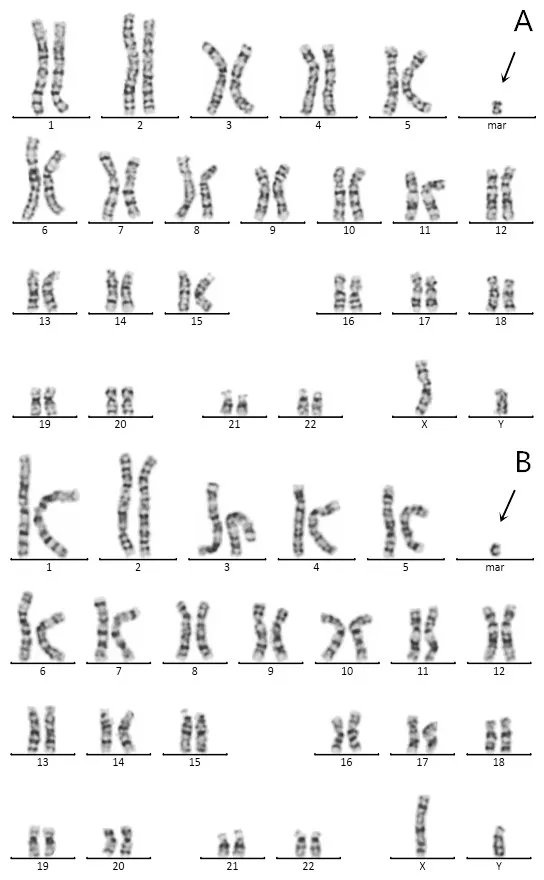
图3 胎儿3及其父亲的47,XY,+mar染色体核型
aCGH 检测结果显示胎儿1 在16 号染色体p11.2~q11.2 区段存在约15.5 Mb 的嵌合型重复(arr[hg19]16p11.2q11.2(31,047,011-46,516,484)x3),由于技术原因的限制对低于30%的嵌合,aCGH 无法检出,因而未检测到嵌合型核型。胎儿2在18 号染色体p11.32~p11.21 区段存在约15.0 Mb 片段的2 次重复(arr[hg19]18p11.21p11.32(136,227-15,170,636)x4)。胎儿3 的aCGH 检测结果显示为正常。
3 讨论
sSMC 的形态通常可表现为带有着丝粒的染色体小片段、双着丝粒染色体或环状染色体等。最常见的是携带双着丝粒染色体的sSMC,其次为带有着丝粒的染色体小片段,而环状sSMC 较少见[6]。LIEHR 等[7]回顾分析了大量相关病例后得出结论:sSMC在产前诊断的病例中发生率为0.077%,在存在异常超声的胎儿中发生率为2.04%,在新生儿中发生率为0.043%,在智力或生长发育障碍患者中发生率为0.288%。可见在存有异常表型的群体中,sSMC是其一个重要的遗传学病因。
来源于16 号染色体的sSMC 非常罕见,本研究中胎儿1 的aCGH 结果显示在16 号染色体p11.2-q11.2区段存在约15.5 Mb重复,内含22个OMIM基因,具体位点为31、047、011~46、516、484。该区段约4 Mb 位于16p11.2 微重复综合征(OMIM#614671)(具体位点为28、500、000-35,300,000)区域内,为主要致病区域,其余部分覆盖16 号染色体着丝粒和异染色质区域,通常无致病性。16p11.2 微重复综合征是一类染色体异常疾病,主要临床表现为低体重、发育迟缓、小头畸形、语言迟滞、孤独症谱系障碍、精神分裂症等。个体表现差异大,具有高度临床异质性[8-9]。但对于16p11.2微重复综合征致病的关键基因,如法洛四联症等心脏疾病的候选基因HIRIP3、与特发性脊柱侧凸密切相关的的TNX6、SH2B1 等基因、与脑和神经发育密切相关的MVP、SWZ6L2、KCTD13、DOC2A、MAPK3 等基因,本研究中胎儿1的aCGH结果显示其重复区域中并未涉及。在胎儿1 的16 号染色体重复区域中,无剂量效应敏感基因存在,故此片段重复的临床意义不明。BAR‐BER 等[10]报道一例携带有16 号染色体p11.2~q11.2 重复的胎儿,5 岁就诊时表现为生长发育迟缓、神经发育障碍、小头畸形等症状,随访至10岁时表现出孤独症谱系障碍症状。Zerem 等[11]报道一例携带有16 号染色体q11.2~q12.1 区域重复的4 岁胎儿,生长发育迟缓,具体表现为出生后12 个月可以坐立,18 个月可以爬行,24 个月独立行走,4 岁仍不会说话,同时表现出智力低下、特殊面容等症状。本研究中胎儿1 的父母染色体核型结果均正常,故胎儿为新发异常,超声检查结果虽未见异常,但不排除出生后出现如相关文献报道的生长发育迟缓、智力障碍等症状。临床医师在遗传咨询时告知夫妇双方上述查询结果后,孕妇选择终止妊娠,引产胎儿外表无特殊异常,其家属拒绝对胎儿做进一步检查。
胎儿2 的aCGH 结果证实在18 号染色体p11.21~p11.32 区段存在约15.0Mb 的片段2 次重复。查询DGV、DECIPHER、OMIM 等数据库显示该区域重复为临床致病性拷贝数改变,提示该样本符合18p 四体综合征(OMIM#614290)核型特征。该综合征是由sSMC 导致的典型综合征之一,临床可表现为新生儿喂养困难、生长发育迟缓、肌张力异常、智力低下、小头畸形、脊柱侧凸、斜视等[12]。胎儿2的双亲染色体核型分析结果均正常,故该胎儿为新发变异,母亲高龄为该病的诱因之一,其机制可能为卵母细胞减数分裂时同源染色体的不分离以及着丝粒的错误分裂,导致18号染色体短臂的两个拷贝形成等臂染色体[13]。18p 四体综合征重复区域包括USP14、SMCHD1、LPIN2、TGIF1、LAMA1 等54 个OMIM 基因,其中USP14 作为泛素蛋白酶体系统的主要成员之一,对细胞的生长、迁移、炎症小体活化、激酶活化等过程均起到促进作用,在细胞增殖和凋亡、信号传导和DNA 损伤修复中也起重要的调控作用[14],异常表达会造成生长发育迟缓或瘫痪等症状,这可能是胎儿2 出现宫内发育迟缓的原因之一。SMCHD1基因异常表达可导致下游相关蛋白结构构象及甲基化程度改变,可造成骨骼肌细胞的凋亡坏死,与面肩肱型肌营养不良症相关[15],与胎儿2 脊柱侧凸的表型密切相关。TGIF1 属于转录抑制因子,可通过调节类维生素A 来控制前脑的结构,异常表达会影响神经轴发育的信号通路,可致胎儿产生全脑畸形、前脑无裂畸形、垂体发育异常、脑积水等症状[16]。LAMA1 基因异常表达可引起小脑及小脑蚓部发育不全、小脑囊肿、视网膜营养不良、眼球运动异常及高度近视等症状[17]。TGIF1 和LAMA1 基因的异常表达与胎儿2 脑积水的严重表型密切相关。SEBOLD 等[18]对43 名18p 四体综合征患者进行总结分析发现所有患者均有发育迟缓及精神障碍的症状。绝大多数患者出生时患有新生儿并发症,如喂养困难、呼吸窘迫及新生儿黄疸等。同时还可能存在其他一些表型,如小头畸形(50%患者)、斜视(50%患者),癫痫(20%患者)、心脏疾病(25%患者)、脊髓脊膜膨出(6%患者)、脊柱侧凸(37%患者)、隐睾(39%男性患者)等。后续随访,发现43 名患者的平均智商为48,部分患者出现焦虑症、烦躁及自闭症表型[19]。遗传咨询中在告知夫妇双方2 号胎儿上述可能出现的严重表型后,孕妇选择终止妊娠,引产胎儿由于孕周尚小,未见明显外部畸形。
近端着丝粒染色体(即第13、14、15、21、22 号染色体)形成sSMC 的可能机制为在减数分裂期间姐妹染色单体发生了U 型交叉互换,近端着丝粒染色体短臂断裂后没有与原来的染色体长臂连接,而是短臂互相连接最终形成sSMC[20]。目前人类基因组测序没有能够分析出近端着丝粒染色体短臂及着丝粒附近区域的具体的基因序列,也就是说这类由近端着丝粒染色体的短臂所组成的sSMC 不含致病基因,不会产生临床症状。本研究中3 号胎儿羊水细胞染色体核型分析结果为47,XY,+mar,通过检查其父母外周血染色体,发现胎儿父亲同样存在一条sSMC,大小和形态均相同,所以胎儿的sSMC 属于家族遗传的sSMC。aCGH 检测结果显示3 号胎儿羊水细胞的分子遗传学结果正常,考虑到胎儿超声检查无明显异常,加之胎儿父亲和胎儿携带相同的sSMC且父亲无特殊临床表现,因而推测增加的sSMC 为近端着丝粒染色体短臂构成的部分四体核型的可能性较大。本文推测该孕妇其他两次自然流产的可能原因为丈夫携带的sSMC 在减数分裂过程中易形成不平衡的配子而造成。经充分遗传咨询后建议其继续妊娠,定期产检,目前该孕妇已产下一表型正常、发育良好的健康男婴。
综上所述,由于携带sSMC 患者的表型效应受其来源、嵌合程度、片段大小以及是否含有重要功能基因等多方面的影响,临床表型复杂多变。因此对于产前诊断病例中发现的sSMC,需要结合传统细胞遗传学方法及更加全面精准的分子遗传学检测手段来进行综合分析,避免先天性缺陷胎儿的出生,为产前遗传咨询提供科学准确的依据。

