孕早期大鼠剖宫取出胚胎后机械刮宫方法构建宫腔粘连模型
谭琴,刘晓云
遵义医科大学第三附属医院(遵义市第一人民医院)妇产科,贵州遵义 563000
宫腔粘连(intrauterine adhesion,IUA),又称Asherman 综合征[1],指由于人工流产、刮宫、流产后出血、人工胎盘摘除、息肉切除等医源性损伤,及感染、生殖器结核、子宫内膜炎等病理性损伤从而引起月经异常、胎盘异常、周期性下腹痛及继发不孕等各种临床症状的一种妇科疾病[2]。目前IUA 的发病机制、临床症状、治疗及治疗后宫腔再粘连的发生机制尚不明确。研究[3]发现,IUA 的主要危险因素是流产后刮宫。以往研究人员使用物理损伤、化学损伤、机械损伤和两种方法相结合的双重病理损伤模型[4-5]等多种方法构建动物IUA 模型。以上模型均建立在非妊娠动物的基础上,并且导致IUA 的物理或化学方法引起的子宫内膜损伤与IUA患者的实际临床原因以及IUA在体内随后的病理变化存在一定差异,导致构建的IUA 模型在模拟人类IUA 病发生机制时不够完全准确[6]。因此,探索和构建更符合人类IUA 的动物模型是十分必要的。2021年7月—12 月,我们以妊娠早期大鼠为研究对象,采取孕早期大鼠剖宫取出胚胎后机械刮宫方法构建IUA 模型,并通过观察模型大鼠IUA 组织的组织病理学变化进行建模判断,旨在为进一步探索IUA 发病机制和治疗方法提供一种更理想的动物模型。现将结果报告如下。
1 材料与方法
1.1 实验动物、试剂及仪器 SPF 级8~9 周龄SD雌性大鼠48 只,体质量240~280 g,阴道涂片法筛选出动情周期稳定大鼠;SPF 级9~10 周龄SD 雄性大鼠8 只,体质量300~320 g;动物均由遵义医科大学实验动物中心提供。雌性大鼠每4 只一笼,饲养于遵义医科大学第三附属医院中心实验室,昼夜各12 小时,温度、湿度适宜,自由觅食,饮水。实验前适应性喂养1周。苏木精-伊红(HE)染液(北京中杉金桥),Masson 染液试剂盒(北京索莱宝),4%多聚甲醛(武汉德博士),TGF-β1(北京中杉金桥),SP 法免疫试剂盒(北京中杉金桥)。
1.2 SD雌性大鼠分组及IUA造模方法 将48只动情周期稳定的雌鼠随机分为A、B、C、D 四个组,每组12 只。A、B、C 组雌鼠与雄鼠和笼喂养,阴道涂片法筛选出妊娠大鼠,记为妊娠第0.5天,于妊娠第5.5~6.5 天采用孕早期流产后机械刮宫方法构建IUA 模型。具体如下:操作前禁食、禁饮12 h,2%戊巴比妥钠0.2 mL/100 mg 腹腔注射麻醉,麻醉后将雌鼠固定于操作台上。备皮消毒铺无菌洞巾,逐层分离下腹壁,暴露出红润的“Y”形子宫。将子宫拉到体外,于子宫中段纵向开一约0.5 cm 的纵形切口,用专用刮匙完整取出两侧胚胎后在子宫切口的上下来回地搔刮子宫内膜,搔刮至子宫内壁毛糙时停止,缝合切口,生理盐水冲洗腹腔后关腹。A、B、C 组刮宫后继续饲养1、2、3 个动情周期。D 组为常规饲养非孕鼠,不与雄鼠和笼,打开宫腔后即缝合并关腹,不刮宫。造模后,所有实验大鼠均可苏醒,苏醒后精神状态良好,进食、排便及活动正常;各组大鼠手术切口均未发生感染,伤口愈合良好,无死亡。
1.3 大鼠IUA模型的评价 子宫形态改变、子宫内膜腺体数目减少、纤维化程度增加表示建模成功;TGF-β1的相对表达量用于评估IUA 的严重程度,和笼实验用于评估宫腔粘连对大鼠妊娠能力的影响。
1.3.1 各组大鼠子宫形态及子宫内膜腺体数目观察 造模完成后每组各取6 只大鼠,处死后收集双侧子宫标本,观察大鼠子宫解剖形态的变化。取子宫组织,4%多聚甲醛固定24 h,脱水、透明、浸蜡、包埋、切片等步骤制作石蜡切片。HE染色后测算各组大鼠子宫内膜腺体数目。将切片置于65 ℃电热烤箱中至石蜡溶化,浸泡于二甲苯Ⅰ和二甲苯Ⅱ中各10 min。然后依次置于100%、100%、95%、95%、85%、75%的酒精中浸泡2 min,蒸馏水冲洗1 min。苏木素染色10 min,水洗,盐酸酒精分化15 s,自来水反蓝10 min,伊红染色1 min。65 ℃电热烤箱中烘干玻片,中性树脂封片,倒置相差显微镜下观察,每张切片随机选择4个200×放大倍率视野进行腺体计数,取平均值,腺体数目减少表少建模成功。
1.3.2 各组大鼠子宫内膜纤维化程度观察 采用Masson 染色法观察各组大鼠子宫内膜纤维化程度。取子宫内膜组织,新鲜配制的Weigert铁苏木素染色10 min,酸性乙醇分化15 s,Masson 蓝化液染色5 min,丽春红品染色5 min,磷钼酸2 min,苯胺蓝染色2 min。以上每一次操作后均用纯水水洗后再进行下一步操作。65 ℃烘干玻片,中性树脂封片,倒置相差显微镜下观察,每张切片随机选择4 个200×放大倍率视野进行纤维化评估,取平均值,纤维化程度增加表示建模成功。按0~3[7]的改良半定量评分:子宫内膜组织无纤维化计0分、内膜组织松散纤维化计1分、中度纤维化计2分、致密纤维化计3分。
1.3.3 各组大鼠子宫内膜组织TGF-β1检测 采用免疫组化法检测。按照通用SP 检测试剂盒说明书进行免疫组化操作,倒置相差显微镜下观察,每张切片随机选择4个400×放大倍率视野进行染色程度与染色范围判断,其分值相加后求出积分值。染色程度判断标准为阴性计0 分、弱阳性计1 分、中等阳性计2 分、强阳性计3 分;染色范围判断标准为无阳性染计0 分、≤25%计1 分、26%~50%计2 分、51%~75%计3 分、≥76%计4 分[8]。实验重复3 次,取平均值,TGF-β1相对表达量增加表示IUA程度加重。
1.3.4 各组大鼠妊娠能力观察 采用和笼实验。有生育能力的成年SD 雄性大鼠8 只,将每组剩余6只大鼠随机以3:1 比例与雄鼠和笼,和笼后进行阴道涂片,涂片可见精子计为妊娠第0.5天,若未见精子,继续和笼直至阴道涂片见精子为止。将妊娠大鼠分笼饲养,于妊娠第14.5 天处死孕鼠,摘除子宫统计双侧子宫内胚胎数目,观察胚胎植入变化。
1.4 统计学方法 采用SPSS17.0 统计软件进行数据处理。计量资料采用shapiro-wilk test 方法进行正态性检验,正态分布的计量资料用以±s表示,组间比较采用独立样t检验,多样本均数间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠子宫解剖形态 造模后D 组大鼠子宫形态规则、弹性丰富;A 组子宫形态欠规则、弹性较差;B 组子宫部分宫腔内见血凝块,部分见下段粘连,上段积液,C 组子宫形态改变与B 组相似。造模后各组大鼠子宫解剖形态见图1。
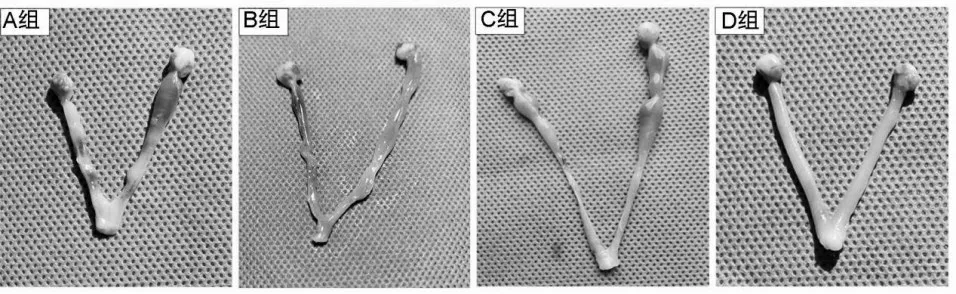
图1 造模后各组大鼠子宫解剖形态
2.2 各组大鼠子宫内膜腺体数目 造模后D 组大鼠子宫内膜结构完整、腺体丰富,形态规整;A 组大鼠子宫内膜结构破坏、腺体数目减少,腺腔扩张;B组大鼠子宫内膜变薄或者缺失、腺体数目显著减少,腺腔扩张或者闭合;C 组大鼠子宫内膜腺体改变与B 组相同。 A、B、C、D 组大鼠子宫内膜腺体数目分别为(6.771 ± 1.417)、(3.104 ± 1.505)、(3.063 ± 1.341)、(11.979 ± 1.780)个。与D 组相比,A、B、C 组大鼠子宫内膜腺体数目少(P均<0.05);与B、C 组相比,A 组大鼠子宫内膜腺体数目多(P均<0.05)。
2.3 各组大鼠子宫内膜纤维化评分比较 造模后D组大鼠子宫内膜间质见少许松散淡蓝色纤维;A组大鼠子宫内膜间质见中量稍致密蓝色纤维;B组大鼠子宫内膜间质见大量致密深染蓝色纤维,C组大鼠子宫内膜间质见大量致密深染蓝色纤维。A、B、C、D组大鼠子宫内膜纤维化评分分别为(1.729 ± 0.449)、(2.667±0.476)、(2.583±0.498)、(0.687±0.468)分。与D组相比,A、B、C组大鼠子宫内膜纤维化评分高(P均<0.05);与B、C组相比,A组大鼠子宫内膜纤维化评分低(P均<0.05)。
2.4 各组大鼠子宫内膜TGF-β1相对表达量比较造模后A、B、C、D 组大鼠子宫内膜TGF-β1相对表达量分别为(6.127 ± 0.710)、(6.291 ± 0.724)、(4.041 ± 0.742)、(2.125 ± 0.936)。与D 组相比,A、B、C 组大鼠子宫内膜TGF-β1相对表达量升高(P均<0.05);与B、C组相比,A组大鼠子宫内膜TGF-β1相对表达量低(P均<0.05)。
2.5 妊娠第14.5 天各组大鼠双侧子宫胚胎情况比较 造模后妊娠第14.5 天D 组大鼠双侧子宫均见大量胚胎植入,排列紧密。A 组大鼠子宫形态不规则,可见胚胎植入,但数目显著减少,排列稀疏。B、C 组大鼠子宫腔下段闭塞,上端积液,未见胚胎植入。A、B、C、D 组大鼠双侧子宫胚胎数目分别为(2.08 ± 1.16)、0、0、(6.75 ± 1.14)个。与D 组相比,A 组大鼠双侧子宫胚胎数目少(P<0.05)。造模后各组大鼠双侧子宫内胚胎见图2。
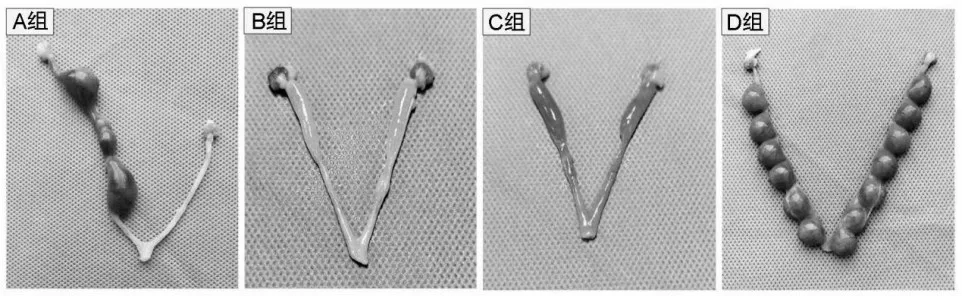
图2 各组大鼠双侧子宫内胚胎
3 讨论
近年来,IUA 的发病呈年轻化趋势[9]。自20 世纪70年代以来,许多研究者尝试了各种方法来建立动物IUA模型。祖珍玉等[10]以新西兰大白兔为实验对象,用刮匙刮除子宫内膜模拟临床刮宫术,结果显示,在不给予雌孕激素的前提下,模拟刮宫14 天后子宫形态基本恢复、腺体数目与对照组相比无差异、纤维化程度与对照组相比略升高,但差异无统计学意义。表明子宫内膜倾向于在单纯机械损伤不久后修复和再生。由于实验动物的子宫内膜再生性很强,使得构建的IUA 动物模型很难保持稳定性。随后研究人员探索了结合两种或两种以上的损伤方法来构建IUA动物模型。刘芳等[11]通过基于刮宫术切除卵巢减低雌孕激素水平或使用细菌脂多糖诱导宫内感染,获得了双重病理损伤IUA 模型。尽管这些物理或化学损伤方法对子宫内膜均造成不同程度的损伤,甚至导致IUA,但这种子宫内膜损伤或者粘连相关病变并不完全符合IUA临床实际。
非妊娠SD 大鼠的子宫腔直径小、子宫壁厚,单纯机械刮宫难以有效刮除子宫内膜并造成损伤,而且大鼠子宫内膜自我修复能力较强,从而使得构建的动物模型既不稳定也不符合IUA发病的主要临床病因学。与非妊娠大鼠相比,妊娠大鼠的子宫在妊娠期间会变得越来越薄和柔软,胚胎清除后,子宫腔扩大,机械性刮宫可充分刮除上皮层甚至损伤基底层,这一过程是对人类刮宫程序更加精准的模仿。本研究结果发现,与D 组比较,A 组大鼠子宫内膜变薄,腺体数目减少,纤维化程度增加;与A 组比较,B组子宫内膜严重变薄甚至缺失,腺体数目严重减少甚至闭合,子宫内膜呈现严重纤维化。可以得出流产后机械刮宫法导致子宫内膜损伤是一个渐进性过程,其随着时间推移损伤逐渐加重,这与临床IUA的演变过程相符。子宫内膜受损伤后可引起子宫内膜变薄,腺体数目减少、间质萎缩,腺上皮生长缓慢,同时纤维组织明显增生,内膜逐渐瘢痕化。其中子宫内膜腺体数量及纤维化程度被大多数研究者作为评价损伤子宫内膜修复及再生的指标[12-13]。本研究结果发现,与B 组相比,C 组大鼠子宫内膜厚度及腺体数目无明显改变,子宫内膜纤维化程度无明显改变,表明子宫内膜受损严重,不能有效修复与再生,提示构建的IUA模型是有效且稳定的。
TGF-β1是一种强效的促纤维化介质[14],常被用于评估动物模型中IUA的严重程度。本研究结果显示,D组大鼠子宫内膜中TGF-β1呈现弱阳性表达,表达范围小;而A 组大鼠子宫内膜中TGF-β1呈中等阳性表达,表达范围较D 组增加;B、C 组子宫内膜中TGF-β1呈强阳性表达,几乎全染色,提示IUA的严重程度逐渐增加。
子宫内膜损伤后再生可能取决于两个主要因素:快速再生的子宫内膜表面上皮细胞有效的覆盖子宫内膜伤口,以及较轻的炎症反应[15-16]。在妊娠大鼠流产后机械刮宫模型中,流产后卵巢功能尚未恢复,雌激素处于低水平状态[9],不能有效促进子宫内膜表面上皮快速再生并覆盖子宫内膜伤口,使得基质组织暴露和基质纤维活性增加,从而导致IUA的发生。而胚胎成功植入子宫内受许多因素的调节,包括子宫内膜容受性、雌孕激素水平、子宫内膜局部环境、胚胎及胚胎分泌的信号因子等[17]。其中,子宫内膜的厚度过薄可能会影响子宫内膜的容受性,从而导致胚胎着床的失败[18]。因此厚度合适的子宫内膜能够为胚胎的植入提供优良的附着场所,是确保妊娠结局良好的关键条件。本研究结果发现,与D 组比较,A 组大鼠子宫形态欠规则,弹性较差,内膜厚度变薄,腺体数目减少,纤维化程度增加,使得子宫内适宜胚胎植入的环境遭到破坏,从而导致胚胎植入的数量减少,且排列不规则。而B、C 组子宫下段粘连、上段积液,内膜严重减少甚至缺失,腺体数目严重减少甚至闭合,纤维化严重,子宫内膜不能有效修复与再生,从而不能成功植入胚胎。
综上所述,采用孕早期流产后机械刮宫方法成功构建IUA大鼠模型,该模型大鼠妊娠能力降低,子宫内膜组织腺体数目少、纤维化程度高、TGF-β1表达高。

