子宫颈鳞状细胞癌组织TIM-3、LAG-3、TIGIT的表达变化及其意义
李玉英,赵丽,王蕾,焦今文,袁芳
1 青岛大学第一临床医学院,山东青岛 266071;2 青岛大学附属医院妇科
子宫颈鳞状细胞癌(以下简称宫颈鳞癌)是女性最常见的妇科恶性肿瘤之一,是女性第四大常见癌症,目前发病率仅次于乳腺癌。近年宫颈恶性肿瘤发病率逐年上升[1]。免疫治疗已成为目前宫颈癌治疗的研究热点,细胞毒性T淋巴细胞相关抗原-4(cy‐totoxic T lymphocyte associated antigen-4,CTLA-4)抑制剂和程序性细胞死亡蛋白-1(programmed death-1,PD-1)/程序性死亡受体配体-1(Programmed death-li‐gand1,PD-L1)抑制剂目前已用于黑色素瘤、肺癌、肾癌和霍奇金淋巴瘤[2]等的治疗中。CTLA-4 可与CD28 竞争性结合CD80、CD86,抑制CD28 将活化的信号传递给T 细胞,使T 细胞不能彻底活化,促进肿瘤细胞的“免疫逃逸”[3]。仅10%~30 的宫颈鳞癌患者采用CTLA-4、PD-1/PD-L1 免疫治疗效果较好。T细胞免疫球蛋白黏蛋白分子3(T cell immunoglobulin do‐main and mucin domain containing molecule 3,TIM-3)、淋巴细胞活化基因3(lymphocyte-activation gene 3,LAG-3)、T细胞免疫球蛋白和免疫受体酪氨酸基抑制模体(T-cell immunoglobulin and immuno Tyrosine inhibitory motif(ITIM)domain)是最新发现的免疫抑制分子。目前TIM-3、LAG-3 及TIGIT 在宫颈鳞癌中相关研究报道较少。我们观察了宫颈鳞癌组织中TIM-3、LAG-3和TIGIT的表达变化,并分析其与宫颈鳞癌患者临床病理参数及预后的关系,旨在为宫颈鳞癌的免疫治疗提供新靶点。现将结果报告如下。
1 资料与方法
1.1 临床资料 宫颈鳞癌、子宫颈上皮内病变(cervical intraepithelial neoplasia,CIN)、正常宫颈组织均来自于青岛大学附属医院病理科2013年3月—2016年8月份存档的手术切除或活检保存的蜡块标本。宫颈鳞癌及CIN 患者均不合并其他类型肿瘤,术前均未接受放化疗治疗,且临床资料完整。因宫颈癌行子宫切除且术后病理证实为宫颈鳞状细胞癌、有完整随访资料的鳞癌患者40 例,年龄33~70岁(50.23±7.87),其中肿瘤高分化3 例、中分化23例、低分化14 例;根据国际妇产科联盟(Internation‐al Federation of Gynecology and Obstetrics,FIGO)2009年分期标准为ⅠA~ⅠB1患者34例,ⅠB2~ⅡA患者6 例;出现淋巴结转移9 例;浸润肌层程度<1/2患者21 例,≥1/2 患者19 例。子宫颈锥切术后且术后病理证实为CIN 的患者20 例,因子宫肌瘤行全子宫切除术且术后病理证实为子宫平滑肌瘤患者的正常宫颈组织30 例。本研究符合《赫尔辛基宣言》的原则,征得患者及其家属的知情同意、医学伦理委员会的批准。
1.2 宫颈鳞癌、CIN 及正常宫颈组织TIM-3、LAG-3、TIGIT 检测 采用免疫组织化学染色法。TIM-3、LAG-3抗体购自北京博奥森生物技术有限公司;TIGIT 抗体购自美国abcam 公司,超敏兔及鼠两分法试剂盒(PV-9001)、DAB 试剂盒购自北京中杉金桥公司。将石蜡切片标本于二甲苯及乙醇中脱蜡水化,PBS 浸泡抗原修复,一抗(TIM-3 抗体、LAG-3抗体及TIGIT抗体)以1∶50浓度滴于标本载玻片上,4 ℃过夜,恢复室温培养后滴加二抗,DAB 显色剂显色,苏木素再次复染,脱水,中性树胶封片,于显微镜下观察染色结果。TIM-3、LAG-3、TIGIT 主要在细胞膜、细胞质中表达。细胞染色强度为无着色计0分、淡黄色计1分、棕黄色计2分、棕褐色计3分;阳性细胞数占总细胞数的百分比得分为<5%计0 分、5%~25%计1分、26%~50%计2分、51%~75%计3分、>75%计4 分。将细胞染色强度与阳性细胞数占总细胞数百分比的得分乘积为最终半定量分析结果,乘积0 分计为细胞阴性,成绩≥1 分计为阳性。测算TIM-3、LAG-3、TIGIT的阳性细胞率。
1.3 资料收集及统计学方法 收集纳入者年龄、肿瘤直径、临床分期、肿瘤分化程度、浸润深度、淋巴结转移及脉管转移等资料。采取电话询问、短信等方式对宫颈鳞癌患者进行随访,患者手术日期为随访起点,死亡为随访终点,2020 年1 月为随访截止时间。采用SPSS25.0 统计软件进行数据处理。计数资料比较采用χ2检验或者是Fisher’s 确切概率法。TIM-3、LAG-3 和TIGIT 表达与宫颈鳞癌患者临床病理参数的关系,采用Kaplan-Meier 法进行单因素生存分析,并绘制生存曲线,采用逐步回归法建立COX 比例风险回归模型分析宫颈鳞癌患者预后的影响因素。P<0.05为差异具有统计学意义。
2 结果
2.1 宫颈鳞癌、CIN及正常宫颈组织TIM-3、LAG-3、TIGIT 阳性表达率比较 宫颈鳞癌组织中TIM-3、LAG-3 及TIGIT 阳性表达率分别为57.5%(23/40)、65.0%(26/40)、65.0%(26/40);CIN 组织TIM-3、LAG-3 及TIGIT 阳性表达率分别为25.0%(5/20)、30.0%(6/20)、30.0%(6/20);正常宫颈组织TIM-3、LAG-3 及TIGIT 阳性表达率分别为3.3%(1/30)、3.3%(1/30)和6.67%(2/30)。与正常宫颈组织比较,颈鳞癌组织、CIN 组织及正常宫颈组织TIM-3、LAG-3、TIGIT 阳性表达率均升高(P均<0.05);与CIN 组织比较,宫颈鳞癌组织TIM-3、LAG-3、TIGIT阳性表达率均升高(P均<0.05)。
2.2 不同病理参数的宫颈鳞癌患者宫颈癌组织TIM-3、LAG-3、TIGIT 表达情况比较 同病理参数的宫颈鳞癌患者宫颈癌组织TIM-3、LAG-3、TIGIT表达情况见表1。TIM-3、TIGIT 阳性表达与宫颈鳞癌患者肿瘤浸润深度相关(χ2=3.879,5.871;P均<0.05),与患者年龄、肿瘤直径、临床分期、分化程度、淋巴结转移和脉管浸润情况均无关(P均>0.05)。LAG-3 阳性表达与宫颈鳞癌患者各临床病理参数均无关(P均>0.05)。
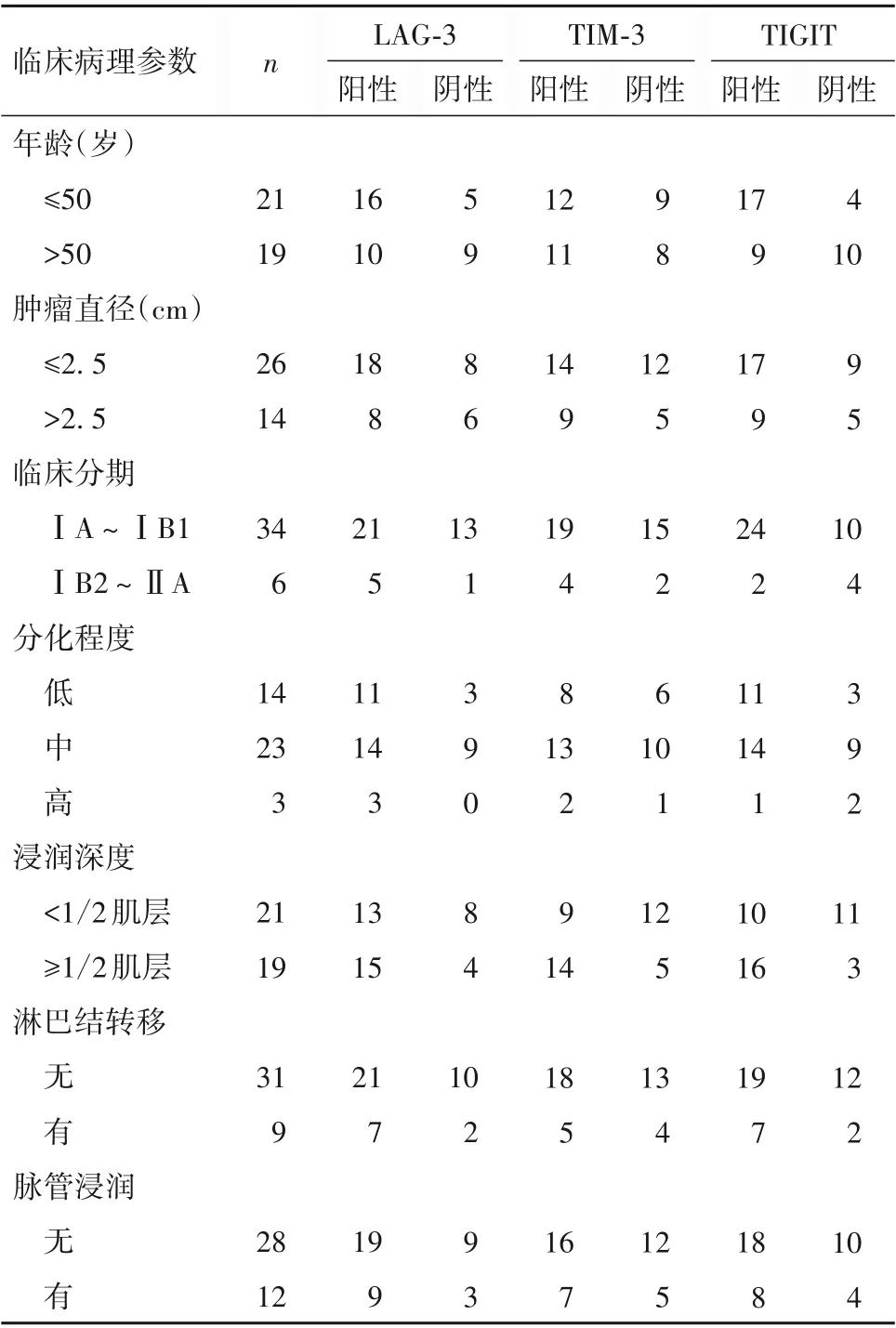
表1 不同病理参数的宫颈鳞癌患者宫颈癌组织TIM-3、LAG-3、TIGIT表达情况(例)
2.3 不同TIM-3、LAG-3 表达的宫颈鳞癌患者的预后 40 例宫颈鳞癌患者随访时间为1~62 个月,中位随访时间30 个月,TIM-3、LAG-3 阳性表达宫颈鳞癌患者的生存曲线明显低于阴性表达者(P均<0.05)。不同TIM-3、LAG-3 表达的宫颈鳞癌患者的生存曲线见图1。
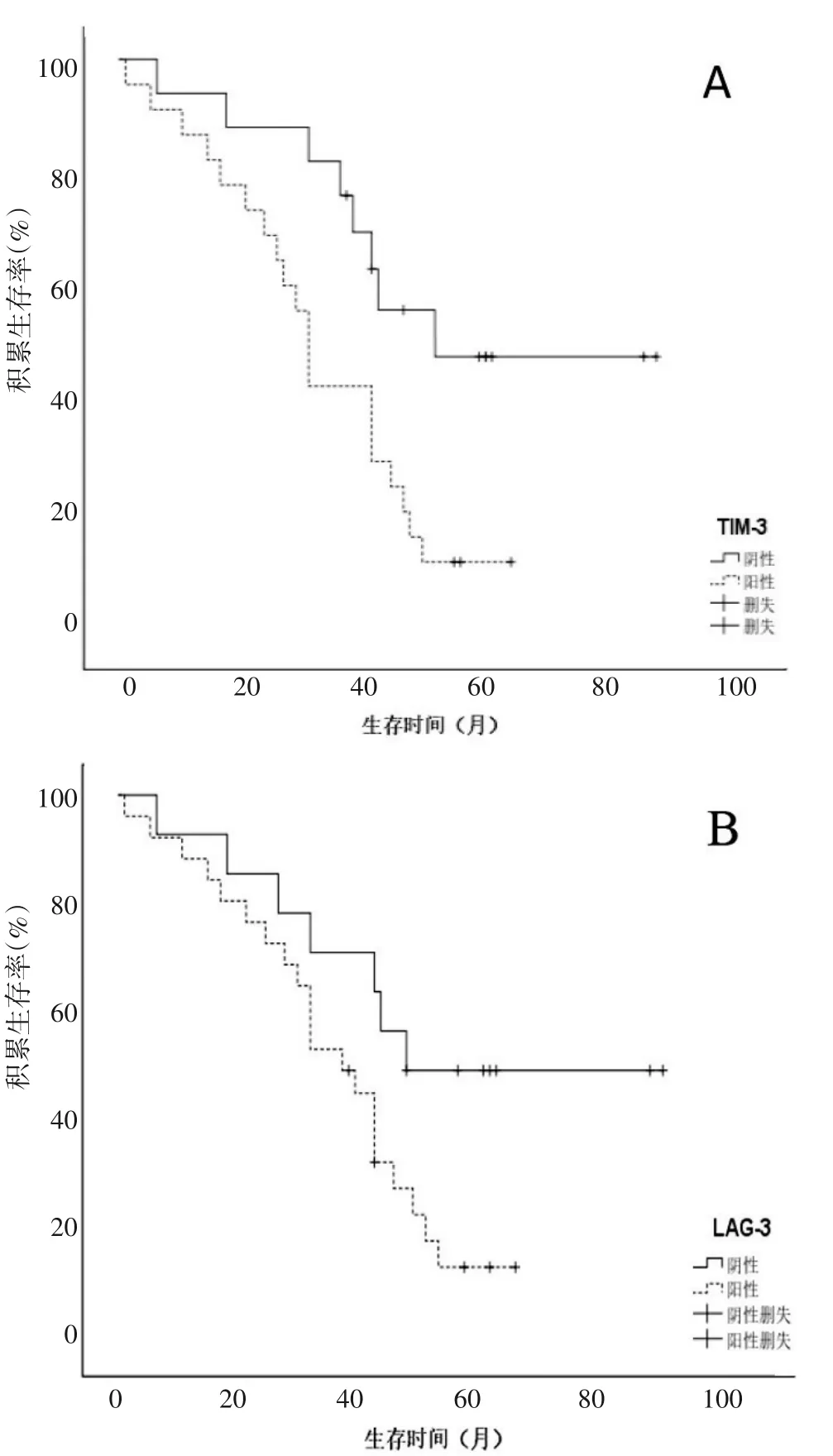
图1 不同TIM-3、LAG-3表达的宫颈鳞癌患者的生存曲线
2.4 宫颈鳞癌患者预后的影响因素分析 单因素分析结果提示,宫颈鳞癌患者的生存时间与TIM-3阳性表达、LAG-3阳性表达、淋巴结转移和分化程度有关(P均<0.05),而与患者年龄、肿瘤直径、临床分期、浸润深度、脉管浸润无关(P均>0.05)。COX 多因素回归分析结果为,淋巴结转移、分化程度和TIM-3 阳性表达实影响宫颈鳞癌患者生存的独立危险因素(HR分别为4.553,3.979,0.285;95%CI分别为0.994~20.843,1.051~15.064,0.109~0.750;P均<0.05)。
3 讨论
宫颈癌的发病率呈逐年递增。与手术、化疗和放疗等传统治疗方法不同,免疫治疗可通过调节或者操纵患者的免疫系统来发挥治疗作用[4],在肿瘤微环境中,免疫检查点可以抑制T细胞抗肿瘤效应;而免疫检查点抑制剂通过阻断这些分子,可以从一定程度激活T 细胞,恢复其抗肿瘤免疫效能[5];目前应用于临床的抗PD-1、PD-L1和CTLA-4等免疫检查点抑制剂在黑色素瘤、胶质母细胞瘤、非小细胞肺癌和结肠癌等应用在病理应答率和无复发生存期等方面取得显著的临床效果[6],且目前针对PD-1、PD-L1 等免疫检查点的治疗已经应用于宫颈癌的治疗,但是由于不同患者具有多样的抗原,相同抗原的一致率较低,以致单药治疗的应答率较低,部分患者出现不良反应甚至产生获得性耐药性。目前对于转移性宫颈癌免疫治疗[7],已有免疫检查点抑制剂应用于临床,但是随着免疫相关不良反应事件发生以及较低的免疫应答率,研究者们开始寻找新的免疫检查点。
TIM-3 蛋白是TIM 家族中的主要组员[8],在免疫抑制反应过程中发挥重要作用。TIM-3 是由N 端免疫球蛋白可变区、粘蛋白结构域、跨膜结构域和细胞尾部构成[9]。其不仅直接表达于Th1 细胞,在肿瘤浸润淋巴细胞(Tumor infiltrating leukocytes,TILs)、巨噬细胞和抗原呈递细胞(antigen presenting cells,APCs)等分子上广泛地表达。表达于TILs表面TIM-3主要通过与其配体半乳糖凝集素-9(Galectin-9,Gal-9)结合调控免疫细胞的功能,下调对Th1细胞反应,进而促进Th1 细胞凋亡,抑制T 细胞抗肿瘤活性[10]。TIM-3 参与自身免疫性疾病发展过程,且随着病情的进一步发展,TIM-3 阳性表达呈下降趋势。在艾滋病病毒感染患者中,TIM-3 作为一种免疫受体可以抑制T 细胞的免疫反应,进一步促进T 细胞的衰竭。对TIM-3 的阻断作为PD-1 和CTLA-4 抑制剂之外新型肿瘤免疫治疗策略正在进行研究。本研究中,在宫颈鳞癌中TIM-3的阳性表达率高于CIN组和正常组织,CIN 组高于正常宫颈组,由此结果分析TIM-3 可能在宫颈鳞癌发展过程中发挥促进作用。我们还分析了TIM-3 与宫颈鳞癌等各种临床病理参数的关联,并发现TIM-3阳性表达率主要与肿瘤浸润深度有关表明随着浸润深度的增大,其阳性表达也呈现递增趋势。据TIM-3阳性表达与卵巢癌、胃癌等恶性肿瘤的不良预后相关联,可能参与疾病的发展进程。但是TIM-3 在临床研究中的作用同样存在相互矛盾之处,食管鳞状细胞癌患者TIM-3蛋白的表达与患者PFS无明显相关性。在本研究结果中,TIM-3蛋白阳性表达宫颈鳞癌患者的PFS 显著短于TIM-3阴性患者,与其在鼻咽癌、肝癌中的阳性表达结果相一致[11],表明其在宫颈癌发展过程中起促进作用。通过对单一因素和多因素的回归模型分析,TIM-3可成为评估宫颈癌预后的独立危险因素,预测其可成为宫颈癌免疫治疗的检查点之一。
LAG-3 是一种由498 个氨基酸组成的Ⅰ型跨膜蛋白[12],主要表达于活化T 细胞(CD4+T 细胞、CD8+T 细胞)、NK 细胞、调节性T 细胞(Treg 细胞)和浆细胞样树突状细胞(plasmacytoid dendritic cells,pDC),与CD4 蛋白具有高度的结构同源性,能够结合MHCII 类分子,抑制T 细胞的增殖及活化[13];大量研究表明,除MHCII类分子以外,半乳糖凝集素-3(Galectin-3)、肝窦内皮细胞凝集素(liver sinusoidal endothelial cell lectin,LSECtin)和α-突触核蛋白纤维也作为LAG-3 配体[14],目前对于LAG-3 作用机制尚不清楚,仍然需要大量的数据研究。WOO 等[12]研究发现,在临床研究中,免疫蛋白LAG-3 与PD-1 在TILs 中共表达,此结果为后续LAG-3 免疫检查点抑制剂与其他ICIs联合应用奠定了临床试验基础。目前已经研究出了针对两种蛋白作用途径的阻断剂,但是尚未应用于临床。在恶性肿瘤与慢性感染等疾病的发生发展过程中均存在T 细胞的失活与衰竭,PD-1呈高表达,免疫蛋白LAG-3作为PD-1共抑制受体在恶性肿瘤或慢性感染患者免疫微环境中T细胞上高表达,严重影响患者生存时间及不良预后。目前对于LAG-3 作用机制尚不清楚,仍然需要大量的数据研究。本研究结果示,在宫颈鳞癌中LAG-3 的阳性表达率高于CIN 组和正常组织,CIN 组高于正常宫颈组,表明LAG-3在子宫颈鳞状细胞癌的发生、发展过程中可能起促进作用。在40例宫颈鳞癌患者样本中,免疫蛋白LAG-3阳性表达与肿瘤直径、浸润深度、淋巴结转移、脉管浸润等无明显关系。K-M生存分析结果显示LAG-3 阴性表达的宫颈鳞患者PFS较LAG-3阳性宫颈鳞癌患者PFS生存时间更长,差异有统计学意义(P<0.05),预示LAG-3 可能影响患者生存预后。多因素结果分析显示各临床病理因素均不是LAG-3 阳性表达的独立危险因素,与DATAR[15]在非小细胞肺癌中得出的结论不一致,这可能与选取样本量不足以及实验方法等有关。在未来的研究中可以在大样本中进行检测,进一步验证其结论。
TIGIT(又称VSIG9,VSTM3,WUCAM)是TIGIT基因编码的免疫球蛋白PVR(脊髓灰质炎病毒受体)家族成员之一[16],主要表达于CD4+T 细胞、CD8+T 细胞以及NK 细胞上,TIGIT 通过结合两个配体CD115 和CD112 传递抑制信号,发挥抗肿瘤免疫效[17]。目前TIGIT 信号传导机制上不清楚,一些实验证明,TIGIT 在调节中枢神经系统自身免疫方面具有抑制作用,正如在免疫检查点TIM-3 中观察到的结果一致,抑制TIGIT 会加剧自身免疫疾病的发生。在晚期胃癌、神经胶质母细胞瘤患者活化T细胞中发现高表达的免疫蛋白TIGIT,提示其可作为一种免疫治疗策略改善患者生存预后。本研究结果发现在正常宫颈、CIN组和宫颈鳞癌患者中,TIGIT蛋白表达率呈递增趋势,差异有统计学意义,表明TIGIT 可能在宫颈癌发展过程中发挥促进作用;在40例宫颈鳞癌患者中,TIGIT阳性表达率在肌层浸润深度≥1/2中为84.21%,在肌层浸润深度<1/2患者阳性表达率为47.62%,差异有统计学意义,表明浸润深度可能促进宫颈鳞癌进一步发展;此对照分析食管鳞癌组织中的免疫调节蛋白TIGIT阳性表达率结果相一致,可以得出TIGIT蛋白阳性表达与子宫颈鳞癌发生、浸润等一系列过程过程有关[18];但是免疫检查点TIGIT阳性表达与患者分化程度、淋巴结转移、脉管浸润等无明显关系。根据K-M 生存分析结果示TIGIT 阳性表达与PFS无明显相关。而在急性髓系白血病患者关于TIGIT 生存因素分析的研究实验结果中,TIGIT蛋白阴性表达PFS明显长于阳性表达患者,这与本研究课题的结果相悖;造成这种差异原因可能是基于不同类型实体肿瘤所处的体内免疫调控微环境不同,且选择的检测诊断方法也不同以及样本量大小的差异,有待进一步扩大检测样本含量深入研究。
综上所述,宫颈鳞癌组织中免疫检查点TIM-3、LAG-3和TIGIT 高表达,TIM-3、LAG-3与宫颈鳞癌患者生存时间呈负相关,TIM-3 阳性表达是影响宫颈鳞癌患者生存时间的独立危险因素。宫颈鳞癌组织中TIM-3、LAG-3、TIGIT表达升高。TIM-3、TIGIT阳性表达与宫颈鳞癌患者肿瘤浸润深度有关及患者预后有关。TIM-3、LAG-3可能参与了宫颈鳞癌的发生发展。TIM-3、LAG-3 和TIGIT 可能成为宫颈鳞癌的治疗靶点的。本研究尚存在纳入样本量较少等不足,后续应该进一步扩大样本量来探究TIM-3、LAG-3和TIGIT在宫颈癌中的作用机制。

