细菌产纤维素酶和脂肪酶固体培养基及接种和培养时间的研究
张东升, 徐一馨, 宋双民, 周 玮
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
鉴于许多行业对纤维素水解酶和脂肪酶需求的增加,选择一种简单、直观、快速、准确的方法筛选和鉴定产纤维素酶和脂肪酶细菌是极其重要的[1-2]。目前,通常采用平板法初步筛选产纤维素酶和脂肪酶细菌,该方法简单、直观、快速,适合大规模筛选和鉴定[2-4]。因此,平板法能否准确识别细菌产酶特性,将影响细菌鉴定的准确性。除了环境条件,平板法准确鉴定细菌产酶特性的关键因素是培养基,培养基必须满足细菌生长且保证阳性细菌产酶,阴性细菌不产酶,这样的培养基一直被不断地更新替换,以便找到一种能灵敏和准确地鉴定细菌产酶的培养基。本文就目前鉴定产纤维素酶和脂肪酶的最佳培养基进行了研究。国外鉴定产纤维素酶细菌培养基,由Hankin等[5]最早提出使用羧甲基纤维素钠替代天然纤维素作为碳源,纤维素酶的产生时间由原来7 d缩短到2 d;由Wood[6]最先使用刚果红取代十六烷基三甲基溴化铵(HAB)做为染色剂,提高了透明圈视觉的可视性,后又由Wood[7-8]和Fatma[4]进行了验证,至此,羧甲基纤维素钠做为碳源、刚果红做为染色剂成为筛选和鉴定产纤维素酶细菌培养基的公认成分。最初使用的平板培养基除了含有羧甲基纤维素钠和刚果红外,还含有较多的无机矿物盐、无机氮 ((NH4)2SO4、NaNO3)和酵母膏等成分,较少使用蛋白胨[4,9-11]。但近年来,很多文献报道产纤维素酶的细菌培养基成分简单,仅含有蛋白胨和羧甲基纤维素钠[12-15]。迄今为止,利用平板法鉴定产脂肪酶细菌培养基中的降解底物尚未统一,目前使用较多的底物有三丁酸甘油酯[15-19]、三油酸甘油酯[20-21]和Tween-80[22-23]等,其中三油酸甘油酯被公认是鉴定脂肪酶的最佳底物[22],而对三丁酸甘油酯和Tween-80 的说法不一,有人认为三丁酸甘油酯和Tween-80不是脂肪酶降解的最佳底物[24],而有人认为是脂肪酶降解的最佳底物[16,22];除上述最常见的脂肪酶鉴定底物外,期刊[25]和实验指导书[26]也选用自然油脂作为脂肪酶鉴定底物;国外对脂肪酶最佳底物筛选的文章较多[2,15-16,20,24],Samad等[22]比较了三丁酸甘油酯、三油酸甘油酯、Tween-20、60、80为底物的培养基,表明Tween-80为脂肪酶最佳底物,而三丁酸甘油酯和三油酸甘油酯产生的晕圈边界不清,导致测量不准确。培养基里除了底物种类决定脂肪酶鉴定是否准确外,用来识别细菌脂肪酶产生的方法也至关重要,目前大多数文献使用平板显色法[18-19,22],也有使用钙沉淀晕圈法[26],两种方法哪种更加敏感和准确,尚无文献报道。综上所述,选择一种满足绝大多数细菌生长并同时产纤维素酶或脂肪酶的培养基是极其重要的。本文研究了实验指导书和期刊上常用鉴定细菌纤维素酶和脂肪酶培养基,同时考察了菌种的培养时间和接种后培养时间对细菌纤维素酶或脂肪酶活性的影响,选择一种细菌纤维素酶或脂肪酶产生的最佳培养基以及最佳接种和培养时间,为实验指导书的编写和快速、准确地鉴定纤维素酶和脂肪酶产生菌提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源及培养 本研究所有菌种均为大连海洋大学自主分离并经生理生化和16S rRNA鉴定的一些益生菌株及教学实验课使用的标准菌株,均属异养细菌(表1)。实验前先将-80 ℃保存的菌株经营养琼脂或2216E平板活化、纯化,4 ℃保存备用,再从冰箱中取出活化,25 ℃恒温培养16~20 h,作为实验菌种。
1.1.2 培养基 牛肉膏蛋白胨、2216E培养基。①各种产纤维素酶培养基。A培养基[13]: 蛋白胨 10.0 g,酵母粉 10.0 g,羧甲基纤维素钠(CMC-Na) 10.0 g,NaCl 5.0 g,KH2PO41.0 g,琼脂15.0 g,蒸馏水1 000 mL;B培养基[12]:蛋白胨10 g,酵母粉 5 g,羧甲基纤维素钠 10 g,NaCl 5 g,琼脂 15 g,水 1 000 mL;C冻水培养基[27]:蛋白胨 5 g,NaCl 5 g,羧甲基纤维素钠 8 g,琼脂 15 g,水 1 000 mL;D培养基[28]:KH2PO42 g,(NH4)2SO44 g,MgSO40.3 g,CaCl20.3 g,FeSO45 mg,MnSO41.6 mg,ZnCl21.7 mg,CoCl22.0 mg,羧甲基纤维素钠 20 g,琼脂粉 15 g,蒸馏水 1 000 mL;S培养基[29]:第一层:琼脂 20 g,水1 000 mL;第二层:NH4NO31 g,CaCl20.1 g,K2HPO40.5 g,FePO40.02 g,KH2PO40.5 g,MgSO4·7H2O 0.5 g,NaCl 1 g,酵母膏 0.05 g,羧甲基纤维素钠 8 g,琼脂 15 g,水 1 000 mL。上述培养基pH值7.0~7.2。②各种产脂肪酶培养基。Tween-20培养基[22,30]:蛋白胨 10 g,NaCl 5 g,CaCl2·H2O 0.1 g,Tween-20 10 g,琼脂 15 g,蒸馏水 1 000 mL,pH值7.0~7.4,1.6%中性红溶液 1 mL;Tween-60培养基[22,30]:蛋白胨 10 g,NaCl 5 g,CaCl2·H2O 0.1 g,Tween-60 10 g,琼脂 15 g,蒸馏水1 000 mL,pH值7.0~7.4;Tween-80培养基[22,30]:蛋白胨 10 g,NaCl 5 g,CaCl2·H2O 0.1 g,Tween-80 10 g,琼脂15 g,蒸馏水1 000 mL,pH值7.0~7.4;葡萄糖-Tween-80培养基[27]:葡萄糖 20 g,酵母粉 5 g,蛋白胨 5 g,CaCl2·H2O 0.1 g,Tween-80 10 g,琼脂 15 g,蒸馏水 1 000 mL,pH值7.0~7.4;三丁酸培养基[22,30]:蛋白胨 10 g,NaCl 5 g,CaCl2·H2O 0.1 g,甘油三丁酸酯 10 g,琼脂 15 g,蒸馏水 1 000 mL,1.6%中性红溶液 1 mL,pH值7.0~7.4;三油酸培养基[22,30]:蛋白胨 10 g,NaCl 5 g,CaCl2·H2O 0.1 g,三油酸甘油脂 10 g,琼脂 15 g,蒸馏水 1 000 mL,1.6%中性红溶液1 mL ,pH值7.0~7.4;油脂培养基[26]:蛋白胨 10 g,NaCl 5 g,牛肉膏 5 g,香油 10 g,琼脂 15 g,蒸馏水 1 000 mL,1.6%中性红溶液1 mL,pH值7.0~7.4;无氮-Tween-80培养基[22]:Tween-80 10 g,琼脂15 g,蒸馏水1 000 mL,1.6%中性红溶液1 mL, pH值7.0~7.4。上述培养基配制完成后,含糖培养基115 ℃灭菌30 min,不含糖培养基121 ℃灭菌20 min,冷却后倒平板,待用。
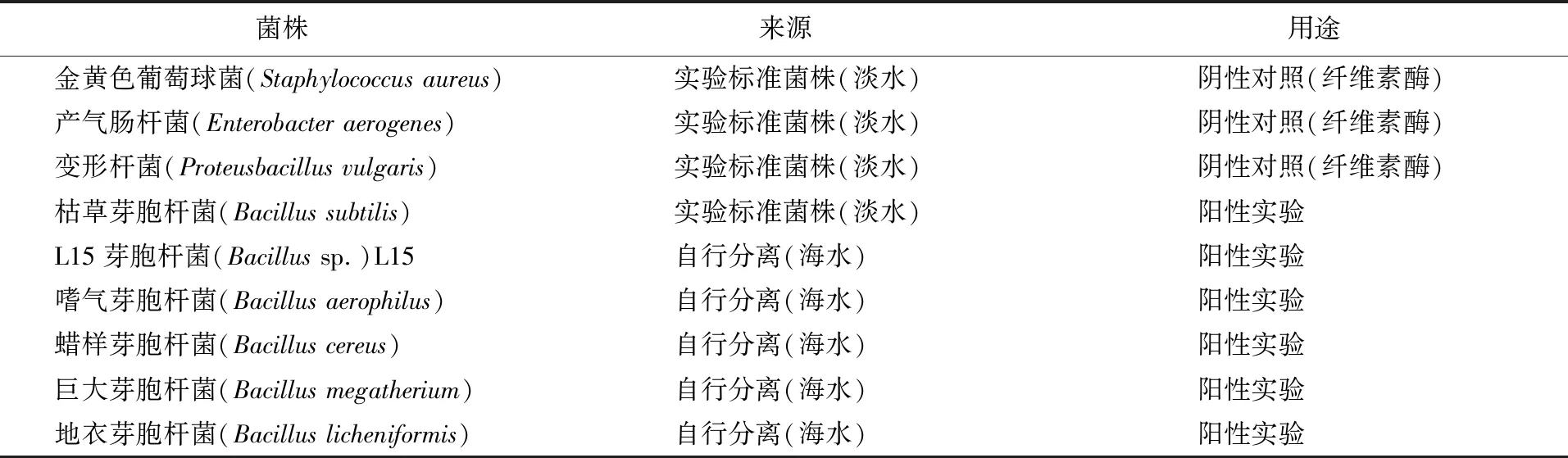
表1 实验菌株
1.2 方法
1.2.1 培养基对细菌生长和纤维素酶或脂肪酶产生的影响 首先按象限法将平板均分4份,在4象限内点种同一种细菌,将1.1.1实验菌株接种到1.1.2纤维素酶或脂肪酶培养基上,同一菌株同种培养基重复2个平板,25 ℃培养,每隔24 h观察细菌生长和酶的产生情况,培养72 h时,测量纤维素酶培养基上已生长细菌的菌落直径,然后采用0.2%的刚果红染液[13]染色1 h,1 mol/L NaCl溶液脱色1 h,倒出NaCl溶液,5%的醋酸溶液固定40 min,观察透明圈产生情况,并测量透明圈直径,透明圈直径与菌落直径比代表纤维素酶活性,公式为a=R/r,其中:a表示纤维素酶活性;R表示纤维素酶透明圈直径;r表示菌落直径。比值越大,认为该菌株产纤维素酶能力越强;当脂肪酶培养基培养细菌120 h时,测定其晕圈直径(R)与菌落直径(r)比值(a),即为脂肪酶活性;最终将细菌均能生长及产纤维素酶或脂肪酶的培养基,选做培养细菌产纤维素酶或脂肪酶的最适培养基,进行后续试验。
1.2.2 琼脂含量对细菌纤维素酶和脂肪酶活性的影响 将琼脂含量分别设为13‰、15‰、18‰、20‰,选择1.2.1中的最适培养基和操作步骤点种阳性菌,25 ℃恒温培养72 h(纤维素酶)和120 h(脂肪酶),测量纤维素酶或脂肪酶的活性并观察透明圈或晕圈与边界的清晰度,选择最佳琼脂含量。
1.2.3 海水、淡水培养基对细菌纤维素酶和脂肪酶活性的影响 根据1.2.1和1.2.2实验的最适培养基和最佳琼脂含量,分别用陈海水、蒸馏水配制培养基,根据1.2.1点种阳性菌种,25 ℃分别培养72 h(纤维素酶)和120 h(脂肪酶),测定海水、淡水培养基对纤维素酶和脂肪酶产生的影响。
1.2.4 菌种培养时间对细菌纤维素酶和脂肪酶活性的影响 按照1.2.1方法,点种不同培养时间的阳性细菌于琼脂含量为13‰的最佳培养基中,25 ℃分别培养72 h(纤维素酶)和120 h(脂肪酶),比较接种不同培养时间的细菌纤维素酶和脂肪酶活性,确定接种细菌的最佳培养时间。
1.2.5 培养时间对细菌纤维素酶和脂肪酶活性的影响 接种培养18 h的细菌于琼脂含量为13‰的最适培养基上,25 ℃分别培养24、48、72、96、120、144 h,测定细菌纤维素酶和脂肪酶的活性,确定测定纤维素酶和脂肪酶的最佳培养时间。
1.2.6 数据统计 采用SPSS 19.0统计软件计算所有数据均值(Mean±Std),同一实验设计、不同组别的纤维素酶或脂肪酶均值之间进行多重比较时,当各组均值方差齐性大于0.05时,采用Tukey进行显著性比较;当各组均值方差齐性小于0.05时,采用Game-howell进行显著性比较,显著性设定为0.05。
2 结果与分析
2.1 培养基对细菌生长和纤维素酶或脂肪酶产生的影响
不同培养基对细菌生长和纤维素酶的产生具有较大影响(表2)。以无机氮为氮源的培养基(D、S)细菌生长较差,且生长的细菌仅有少数产纤维素酶;而以蛋白胨为氮源的培养基(A、B、C)上生长的细菌较多,且阳性菌株均产纤维素酶,说明蛋白质是纤维素酶产生的最佳氮源。除此以外,培养基必须含某些矿物盐和生长素(A、B培养基),用来筛选和鉴定细菌是否产纤维素酶的最佳培养基应含蛋白胨、酵母膏、CMA-Na和必需矿物盐,由于A和B培养基成分相近,而A培养基仅比B培养基多了KH2PO4成分,但在A培养基上菌落和纤维素酶直径较大,因此最终确定A培养基为目前细菌产纤维素酶最适培养基,并进行后续试验。

表2 不同培养基对细菌生长和纤维素酶产生的影响
以蛋白胨为氮源,含有不同碳源的脂肪酶产生培养基,对细菌生长和脂肪酶产生的影响较大(表3,图1)。Tween-20最有利于细菌生长和脂肪酶的产生,其次为Tween-60和Tween-80,被认为用来筛选脂肪酶的最佳底物三油酸甘油酯,仅一株细菌生长,因此确定用Tween-20培养基进行后续实验。用来观察脂肪酶产生的试剂显色法较差,难以鉴别出脂肪酶活性较低的细菌,且变色圈与周围培养基界线不清,Ca2+与脂类分解产物脂肪酸生成的晕圈与周围培养基界限清晰,能鉴定出产脂肪酶活性较低的细菌(图2),因此确定Ca2+作为脂肪酶产生的最佳指示剂。
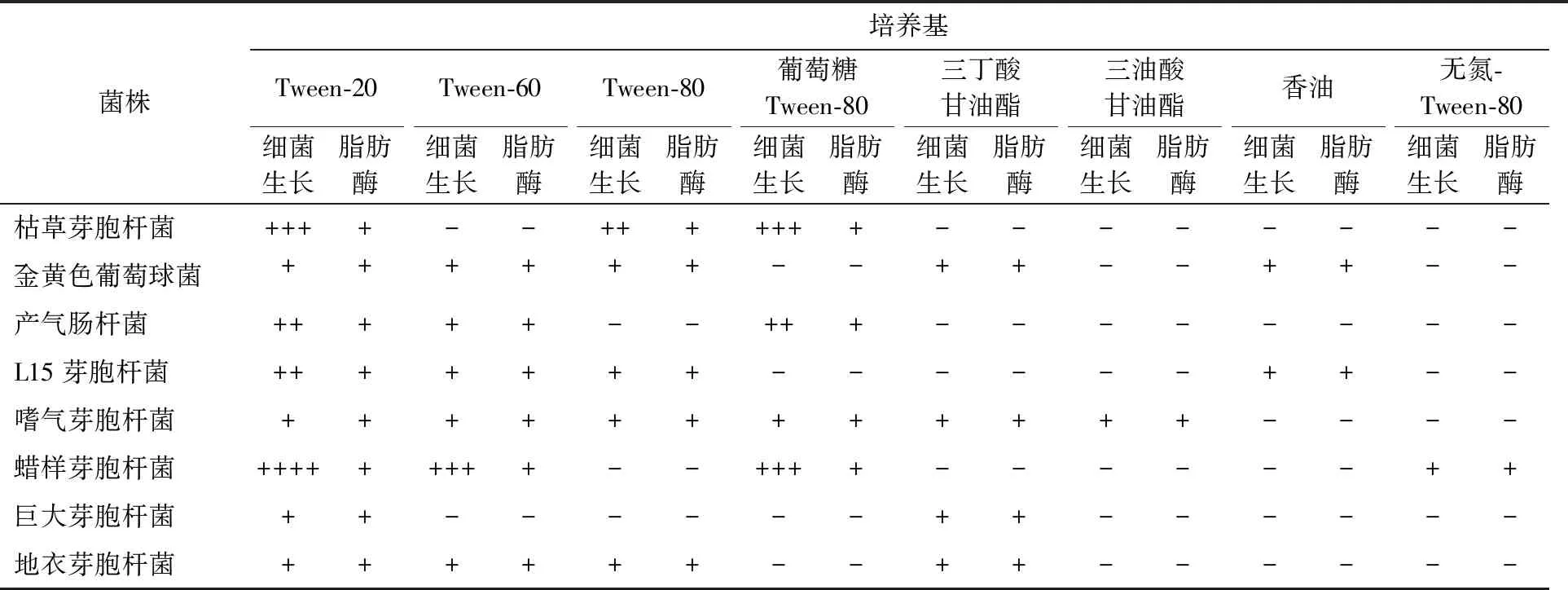
表3 碳源对细胞生长和脂肪酶产生的影响

图1 嗜气芽胞杆菌在不同碳源培养基上的晕圈及透明圈Fig.1 Halo or transparent circlesof B.aerophil on different carbon source mediaa为菌落,b为晕圈,c为透明圈,箭头为晕圈或透明圈与周围培养基的界限a is the colony, b is the halo, c is the transparent circle, and the arrow is the boundary between the halo or transparent circle and the surrounding medium
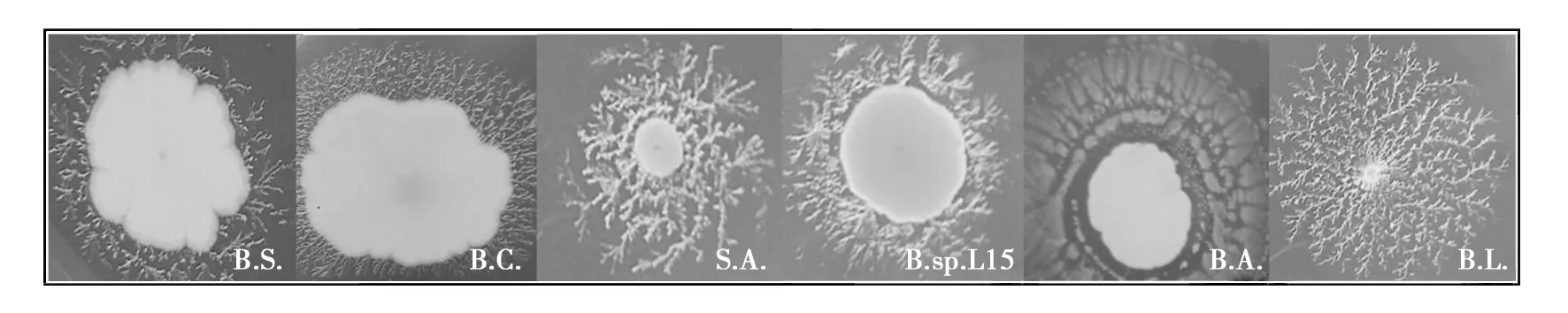
图2 不同菌种在Tween-20培养基上的晕圈形态Fig.2 Halo morphology of different strains on tween-20 mediumB.S.、B.C.、S.A.、B.sp.L15、B.A.、B.L.分别代表枯草芽胞杆菌、蜡样芽胞杆菌、金黄色葡萄球菌、L15芽胞杆菌、嗜气芽胞杆菌、地衣芽胞杆菌,下图同B.S., B.C., S.A., B.sp.L15, B.A., B.L. respectively represent Bacillus subtilis, Bacillus cereus, Staphylococcus aureus,Bacillus sp. L15, Bacillus aerophil and Bacillus licheniformis, the same below
2.2 琼脂含量对细菌纤维素酶和脂肪酶活性和清晰度的影响
琼脂含量对细菌纤维素酶和脂肪酶活性和清度晰的影响均与细菌种类有关(图3、4)。总体来说,琼脂含量为13‰时,纤维素酶活性较低,琼脂含量为15‰和20‰时,纤维素酶活性较高,其中B.sp.L15、B.L.两株细菌在琼脂含量为15‰时,酶活性显著高(P<0.05),其余菌株在琼脂含量不同时,酶活性差异不显著,但琼脂含量为13‰时,纤维素酶产生的透明圈与周围介质界限最清晰,20‰时最不清晰(图4A)。琼脂含量对细菌脂肪酶活性的影响与对纤维素酶活性的影响略有不同,琼脂含量为13‰时,大多数细菌脂肪酶活性较高,但所有菌株在培养基琼脂含量为13‰时,脂肪酶晕圈与周边培养基界限最清晰(图4B)。综合琼脂含量对纤维素酶和脂肪酶活性和边界清晰度的影响,选择琼脂含量13‰为平板法鉴定纤维素酶和脂肪酶的最佳用量。
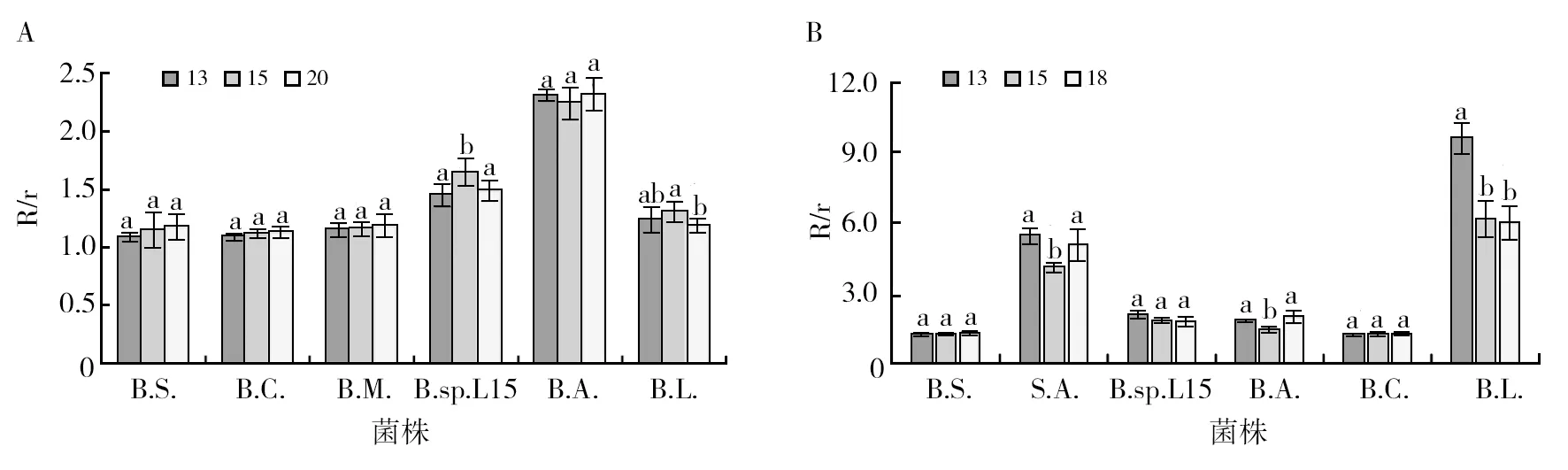
图3 琼脂含量对细菌纤维素酶(A)和脂肪酶(B)活性的影响Fig.3 Effect of AGAR content on cellulose (A) and lipase (B) activities of bacteria13、15、18、20为培养基的琼脂含量(‰);B.S.、B.C.、B.M.、B.sp.L15、B.A.、B.L.、S.A.分别代表枯草芽胞杆菌、蜡状芽胞杆菌、巨大芽胞杆菌、芽胞杆菌L15菌株、嗜气芽胞杆菌、地衣芽胞杆菌、金黄色葡萄球菌;同一细菌柱状图上的小写字母不同代表产酶差异显著(P﹤0.05),小写字母相同代表差异不显著;R/r为透明圈直径/菌落直径比(n=8),下图同13, 15,18, and 20 were AGAR content of the medium (‰) ;B.S., B.C.,B.M.,B.sp.L15, B.A., B.L.,S.A. represents B. subtilis, B. cereus, B. megacephalus, B.sp.L15 strain, B. aerophilus, B. licheniformis, S. aureus respectively. Different lowercase letters on the bar chart of the same bacterium indicated significant difference in enzyme production (P<0.05), while the same lowercase letters indicated no significant difference. R/r Transparent circle diameter/colony diameter(n=8), the same below
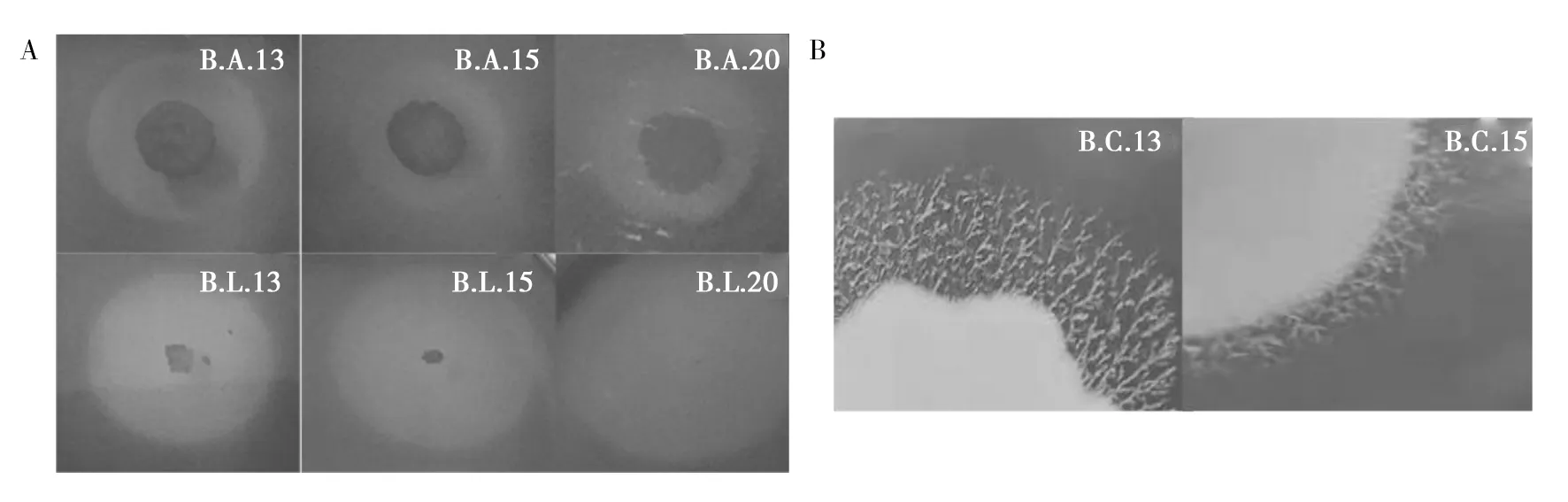
图4 琼脂含量(‰)对纤维素酶透明圈(A)和脂肪酶晕圈(B)清晰度的影响Fig.4 Effect of AGAR content(‰)on the clarity of cellulase transparent circle (A) and lipase halo (B)
2.3 海水、淡水溶剂对细菌纤维素酶和脂肪酶活性的影响
本研究显示使用同一种培养基,分别用蒸馏水和海水配制时,凡在海水、淡水培养基上生长的阳性菌株,均产纤维素酶或脂肪酶,其活性与菌株来源海水、淡水无关,而在海、淡水培养基产纤维素酶或脂肪酶的活性差异与菌株有关。本研究证实所有阳性菌株均在海水配制的培养基上产生的纤维素酶高于淡水配制的培养基,但大多数菌株在海水配制的培养基上脂肪酶活性较高,少数菌株在淡水培养基上脂肪酶活性较高(图5)。
2.4 菌种培养时间对细菌纤维素酶和脂肪酶活性的影响
接种培养时间不同的菌种对纤维素酶和脂肪酶活性较小的细菌影响较小,对活性较大的细菌影响较大(图6)。就纤维素酶和脂肪酶活性较大的细菌而言,接种培养16~24 h的菌种,纤维素酶活性最高,接种培养24~32 h的菌种,脂肪酶活性最高(P<0.05)。因此,为了比较不同细菌产酶情况,建议接种产纤维素酶细菌菌种的最佳培养时间统一为18 h,接种产脂肪酶细菌菌种的最佳培养时间为28 h。
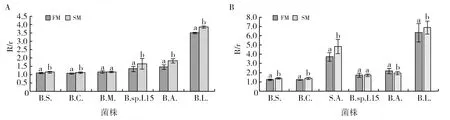
图5 海水、淡水培养基对细菌纤维素酶(A)和脂肪酶(B)活性的影响Fig.5 Influenceof marine and fresh water media on cellulase (A) and lipase (B) activities of bacteriaFM:淡水培养基;SM:海水培养基FM: fresh medium; SM: sea medium
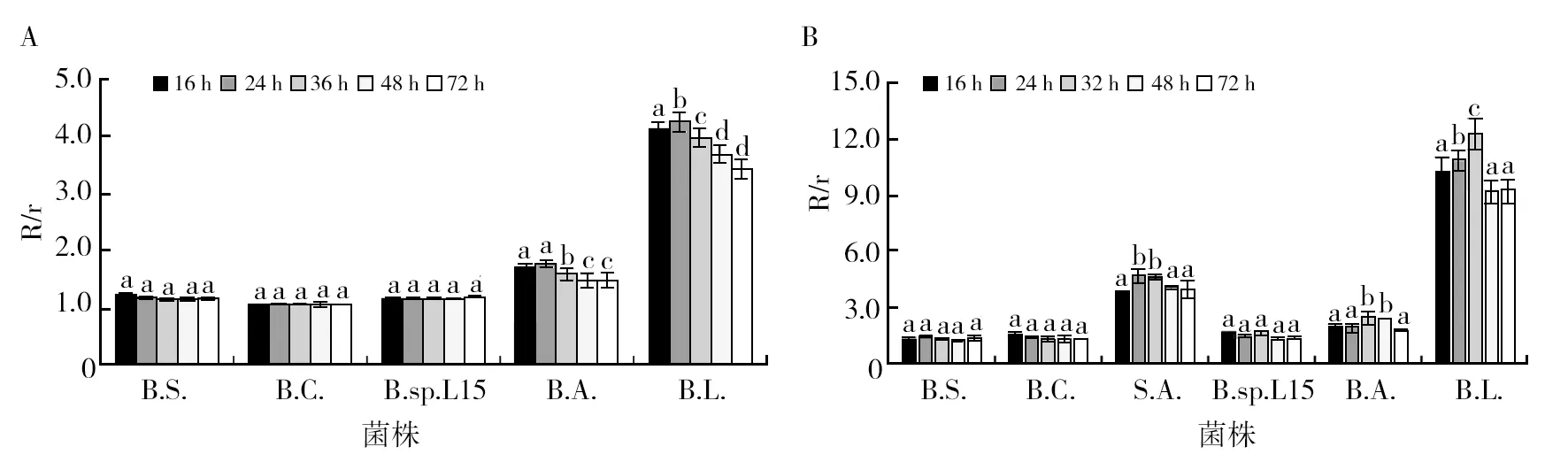
图6 菌种的培养时间对纤维素酶(A)和脂肪酶(B)活性的影响Fig.6 Influence of culture time of an inoculum on cellulase (A) and lipase (B) activities
2.5 接种后的培养时间对细菌纤维素酶和脂肪酶活性的影响
不同培养时间对细菌纤维素酶和脂肪酶活性均有影响(图7),均对酶活性较高的菌株影响显著(P<0.05)。细菌纤维素酶产生时间较早,在培养到24 h时,即产生纤维素酶,不同菌株酶活性最大时,需要培养时间不同,变化在24~72 h之间;而细菌的脂肪酶产生时间较晚,有些菌株需培养到96 h时,才有脂肪酶晕圈产生,但产生最大脂肪酶活性的时间不定,大部分菌株培养到120 h时,脂肪酶活性比96 h有较大的增长,随后有些菌株脂肪酶活性降低,有些菌株缓慢增长,因此建议测定纤维素酶活性的最佳培养时间为48 h,测定脂肪酶活性的最佳培养时间为120 h。
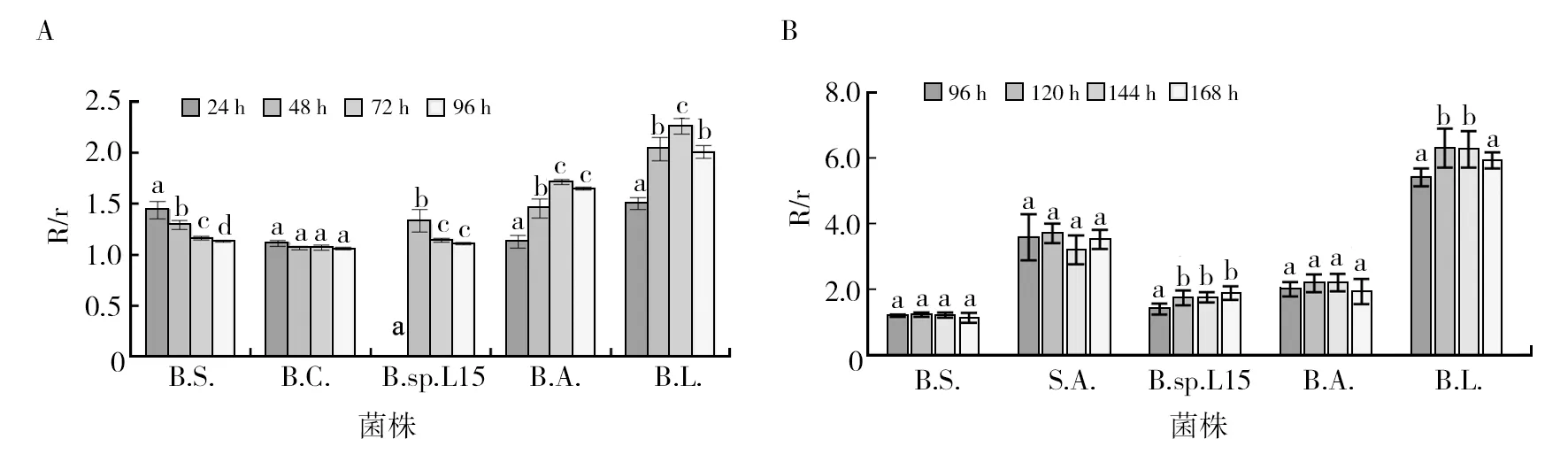
图7 接种后的培养时间对细菌产纤维素酶(A)和脂肪酶(B)活性的影响Fig.7 Effect of culture time after inoculation on cellulase (A) and lipase (B) activity of bacteria
3 讨 论
3.1 氮源和碳源对细菌生长和纤维素酶及脂肪酶产生的影响
合适的碳源和氮源是细菌生长和繁殖的必要条件,大部分异养细菌生长繁殖需要有机氮源,目前已确定鉴定细菌产纤维素酶培养基的最佳碳源为羧甲基纤维素钠,但最佳氮源尚未确定。有些实验指导书[27,29]和期刊上[28,31]鉴定细菌产纤维素酶培养基使用的是无机氮源,而有些选用的是有机氮源[13-14]。本研究对无机和有机氮源进行了比较,证明有机蛋白胨是鉴定细菌产纤维素酶培养基中的最佳氮源,与文献观点一致[32],而无机氮源并不是细菌产纤维素酶的理想氮源,这可能与产纤维素酶的细菌均为异养菌有关。
国内外对细菌产脂肪酶培养基的研究主要集中在对脂肪酶降解底物的筛选上[2,11,15-16,20,22],尽管普遍认为三油酸甘油酯是脂肪酶的最佳底物,但三油酸甘油酯难乳化,较少使用[22],而目前的常用底物是三丁酸甘油脂[18-19]和Tween-80[20,22,24]。本研究表明三油酸甘油酯和三丁酸甘油酯不是用来鉴定细菌脂肪酶的理想底物,与文献报道类似[22],但本研究显示Tween-80也不是脂肪酶鉴定的最佳底物,这与Samad等[22]报道不同,本研究使用较多细菌种类进行验证,而Samad等使用细菌种类较少,且实验所用的培养基仅含碳源,无氮源,这可能导致结论不同。本研究证实以Tween-20为底物的培养基是鉴定脂肪酶活性的最佳底物,而Tween-20适合长链脂肪酶,因此,认为鉴定脂肪酶的最佳底物为Tween-20;用Ca2+作为观察脂肪酶产生效果优于变色方法,可能由于Ca2+与脂肪酸反应生成的沉淀,肉眼对此敏感所致。
3.2 琼脂含量对细菌纤维素酶和脂肪酶活性和清晰度的影响
目前,用平板法鉴定细菌产纤维素酶和脂肪酶活性,仍存在透明圈和周围介质界限不清[1-2],致使测量结果不准确。本研究表明透明圈和周围培养基界限清晰度与琼脂含量呈负相关,与文献报道[33]一致,这是因为当琼脂含量多时,琼脂形成的大分子结构致密,影响平板内其他营养物和细菌分泌物(如纤维素酶和脂肪酶分子)迁移速率的均一性,影响了酶分子迁移速率不一致,导致透明圈与周围培养基界限不清晰或晕圈边界不规则。
3.3 海水、淡水溶剂对细菌纤维素酶和脂肪酶产生和活性的影响
淡水分离的细菌是否可在海水培养基里产纤维素酶和脂肪酶?反之,海水分离细菌是否可在淡水培养基里产纤维素酶和脂肪酶?其结论可为益生菌的应用提供技术支持,本研究显示所有菌株在海水培养基上纤维素酶活性较高,这可能与细菌防止海水中钠盐过多进入细胞内需要较高的能量,促使细菌分泌较多的纤维素酶以满足细菌在海水中生长所致,也与细菌的最适盐度有关,所有芽胞杆菌的最适盐度均为0~20;而少数实验菌株在海水中分泌的脂肪酶略低于淡水,这可能与细菌分解的脂肪酶产生的能量较高有关,可能某些菌株脂肪酶的分泌不需要海水中某些离子的参与,其原因还有待于进一步研究。
3.4 菌种的培养时间对细菌纤维素酶和脂肪酶产生时间和活性的影响
有关文献鉴定和筛选产纤维素酶和脂肪酶细菌时,一般接种培养18 h的菌种[12-13,18,27-28],接种其他培养时间的菌种,对纤维素酶和脂肪酶活性是否具有显著影响,尚未见报道。本研究显示,鉴定细菌产纤维素酶菌种的最佳培养时间与文献报道相近,接种培养了24 h之前的菌种最好,而鉴定产脂肪酶细菌的最佳菌种培养时间比文献晚,菌种的培养时间在24~32 h之间最好,这可能与细菌本身分泌脂肪酶的时间较后有关,具体原因需进一步研究。接种不同培养时间的同一菌种对细菌开始产纤维素酶和脂肪酶的时间没有影响,这可能与细菌分泌纤维素酶和脂肪酶的时间与细菌本身基因有关。
3.5 接种后的培养时间对纤维素酶和脂肪酶活性的影响
在筛选和鉴定细菌是否产纤维素酶或脂肪酶时,往往采用平板培养细菌48 h[12,28]或48~72 h[18]。本研究证实,细菌培养到48 h时,细菌纤维素酶活性最大,与文献一致,细菌培养到120 h时,脂肪酶活性最大,与文献不同。培养时间影响细菌产纤维素酶和脂肪酶活性,这种结果推测可能与细菌在固体培养基上的生长发育程度有关,在液体培养基里细菌酶活性最大发生在细菌稳定期的前期[34-35],但不同细菌稳定期发生的时间不同,因此最大酶活性发生的培养时间也不同,不同菌种或同一菌种培养条件不同,其稳定期时间不同,本研究测定的温度为25 ℃,与文献不同,但纤维素酶活性最大的培养时间与文献相同,说明本研究的实验结果具有很好的参考价值,可供研究者参考使用。
综上所述,鉴定和筛选产纤维素酶细菌的最佳培养基为含蛋白胨的A培养基,琼脂含量为13‰,菌种的培养时间为16~24 h,测定时的培养时间为48 h;脂肪酶的最佳培养基为含有Tween-20的培养基,琼脂含量为13‰,菌种的培养时间为24~36 h,测定时的培养时间为120 h。
致谢:本研究阳性菌种(嗜气芽胞杆菌Bacillusaerophilus、蜡样芽胞杆菌B.cereus、巨大芽胞杆菌B.megatherium、地衣芽胞杆菌B.licheniformis)由大连海洋水产动物医院提供。