ε-多聚赖氨酸和谷胱甘肽影响抗真菌药物对烟曲霉作用效果
仲国维, 娄新宇, 徐凤娇, 曹佳颐, 吕荟杰
(南京医科大学公共卫生学院 卫生检验与检疫学系,江苏 南京 211166)
烟曲霉是一种重要的人类病原真菌,其孢子在环境中普遍存在。持续大量吸入这些孢子可以导致鼻窦炎、哮喘,对免疫缺陷人群来说,侵袭性感染甚至可以引起较高的死亡率[1-4]。迄今为止,三唑类药物是治疗侵袭性曲霉病(invasive aspergillosis,IA)的一线抗真菌药物,主要包括氟康唑(fluconazole,FLC)、伊曲康唑(itraconazol,ITC)以及伏立康唑(voriconazole,VRC)[5-8]。作为目前较常用的全身抗真菌药物之一,ITC结构环上3位氮原子能与游离氧竞争性结合细胞色素P450亚铁血红素的铁离子,最终抑制真菌细胞膜中14-α-去甲基化酶(Cyp51A/Erg11A)合成麦角甾醇并积累毒性甾醇,导致细胞膜不完整,菌体无法生长[8-9]。然而,近年来随着唑类药物在临床和农业生产中广泛而持续地使用,烟曲霉唑类耐药率呈上升趋势,最终导致唑类抗真菌治疗无效[8,10-12]。目前,新型抗真菌药物棘白菌素类(echinocandins)中的卡泊芬净(caspofungin acetate, CS)正在被推荐为侵袭性曲霉感染的挽救疗法,其作用机理是通过抑制细胞壁β-(1,3)葡聚糖的合成,使曲霉细胞不能形成完整的细胞壁[9]。与唑类药物情况类似,随着CS的应用,临床上已经出现少量耐药菌株。因此,烟曲霉感染及其对常见抗真菌药物的抗药性正逐步成为人类健康的一大威胁,尤其是频繁的城市改建和人口的大量流动都加剧了世界公共卫生面临的这一问题的严重性[1-4]。研究发现,烟曲霉耐药的主要机制为靶点基因突变导致的药物和靶点结合力呈不同程度的下降。因此,防止耐药菌出现的一个途径就是寻找不同的药物组合,利用不同靶点药物的协同作用[13]。ε-多聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由小白链霉菌(Streptomycesalbulus)经发酵产生的多肽类物质,由25~35个赖氨酸残基通过α-羟基和ε-氨基之间的酰胺键构成同型均聚多肽,其分子量为5 kDa左右,具有广泛的抗菌作用,在人体内可分解成必须氨基酸赖氨酸[14-16]。ε-PL对酿酒酵母(Saccharomycescerevisiae)以及梨果黑斑病菌(Alternariaalternata)的生长具有一定的抑制作用,且成浓度依赖关系[14,16]。目前的研究表明,ε-PL的抑菌机制是破坏真菌细胞膜产生孔隙,影响初级代谢,如碳水化合物、醇、脂类和氨基酸的代谢水平[16]。有研究将ε-PL与乳酸链球菌素(nisin)在体外联用,发现该组合通过解体细胞膜产生协同杀菌效果[16]。谷胱甘肽(glutathione, γ-L-glutamyl-L-cysteinyl-glycine, GSH)是好氧原核生物和真核生物中含量最丰富的硫醇,在许多生物过程中起着至关重要的作用,例如防御有害异物、重金属和活性氧ROS,稳定细胞膜、线粒体膜和细胞核膜结构[18-19]。GSH的生物合成是由γ-L-谷氨酰-L-半胱氨酸合成酶(γ-L-glutamyl-L-cysteine synthetase, γ-GCS)和GSH合成酶连续两步催化合成的[18,20]。在构巢曲霉(Aspergillusnidulans)中,γ-GCS的编码基因为gcsA,gcsA基因敲除得到构巢曲霉营养缺陷型菌株[21]。在GSH和抗真菌药物作用方面,有研究显示GSH与抗坏血酸在小鼠体内可拮抗氟康唑的抗菌作用[22]。基于ε-PL和GSH两种多肽在体内外影响抗菌效果的研究,本研究首次研究了ε-PL和GSH与临床常见抗真菌药物ITC、VRC和CS在体外联合抗烟曲霉的效果及其可能的作用机制。此外,通过敲除烟曲霉谷胱甘肽合成酶基因gcsA和gshA,以此了解烟曲霉细胞内GSH对唑类药物耐受性的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 本研究所使用的菌株及来源见表1。

表1 菌株及来源
1.1.2 培养基 ①MM基础培养基:每升含20×Salts(每升含NaNO3120 g, KCl 10.4 g, KH2PO430.4 g, MgSO4·7H2O 10.4 g) 50 mL,微量元素(每升含ZnSO4·7H2O 22 g, H3BO311 g, MnCl2·4H2O 5 g, FeSO4·7H2O 5 g, CoCl2·5H2O 1.6 g, CuSO4·5H2O 1.6 g, (NH4)6MO7O241.1 g, EDTA 50 g) 1 mL,葡萄糖10 g,pH 6.5,固体培养基添加2 g琼脂粉;②YAG丰富培养基:每升含酵母粉5 g,葡萄糖20 g,微量元素1 mL,固体培养基添加2 g琼脂粉;③YUU丰富培养基:YAG的基础上添加5 mmol/L尿苷和10 mmol/L尿嘧啶。培养基的具体配制见参考文献[9]。
1.1.3 主要试剂与仪器设备 ε-PL购自Sigma公司;GSH购自上海阿拉丁有限公司;DMSO购自北京索莱宝有限公司;ITC、VRC和CS均购自南京森贝伽有限公司;活性氧检测试剂盒(Reactive Oxygen Species Assay Kit)购自上海碧云天有限公司。试剂均为粉末,纯度均>99%,PCR相关试剂购自南京诺唯赞有限公司。多功能酶标仪(M200,瑞士Tecan SUNRISE)。
1.2 方法
1.2.1 平板点菌实验 用0.01%无菌Tween-80溶液将培养2 d的烟曲霉孢子洗至1.5 mL 离心管中,10 000 r/min,4 ℃离心5 min,用无菌去离子水清洗两遍,离心去上清。无菌生理盐水重悬孢子,血球计数板计数并将孢子浓度调整为1×107个/mL。移液枪吸取2 μL菌悬液点到相应的固体培养基上,37 ℃培养48 h。
1.2.2 最低抑菌浓度测定 ITC和VRC用DMSO溶解配制成4 mg/mL储存液,CS用无菌水配制成4 mg/mL储存液。E-test实验法:使用YAG或添加一定浓度ε-PL和GSH的固体培养基作为基底,取100 μL 1×106个孢子/mL待测试菌的孢子悬液和20 mL融化的培养基混匀。略干,然后用灭菌的镊子夹取E-test试条贴于平板中间,37 ℃培养48 h。ITC、VRC最低抑菌浓度MIC(minimum inhibitory concentration)值判定为100%抑制生长时的最低药物浓度,CS最低有效浓度MEC(minimum effective concentration)值判定为抑制菌丝体生长呈小而圆形紧缩状态时的最低药物浓度。
1.2.3gcsA和gshA基因缺失菌株的构建 本研究中使用的所有引物见表2,均由南京金斯瑞生物有限公司合成。采用融合PCR结合同源重组替换的方法进行gcsA基因缺失菌株的构建。首先,用引物gcsAP1/P3和gcsAP4/P6分别扩增长度约为1 kb的gcsA基因的上下游同源臂,然后用pyr4 F/R从质粒pAL5上扩增筛选标记pyr4基因。再将上述三个片段混合作为模板,用引物gcsAP2/P5将左同源臂、筛选标记和右同源臂融合。最后,将融合片段转入ku80缺失突变体A1160细胞中,经过同源重组后,gcsA基因被pyr4基因替换,得到缺失突变体。gshA基因的敲除同上述方法。

表2 本研究所用引物
1.2.4 细胞内ROS检测 黑色透明玻璃底的细胞培养皿内加入2 mL液体YAG培养基,将待检测菌株的孢子(1×105个)加入培养基中,37 ℃培养10 h后,用PBS洗涤菌丝3次,加入终浓度15 μmol/mL的DCFH-DA(2, 7-Dichlorofuorescin Diacetate),然后37 ℃避光孵育30 min。用PBS洗涤菌丝3次。加入200 μL含有 1 μg/mL ITC、1 μg/mL ITC+1 mg/mL ε-PL或1 μg/mL ITC+10 mg/mL GSH组合的PBS溶液,37 ℃避光孵育3 h。被染色和处理的菌丝体在波长495 nm的激发光下,用多功能酶标仪检测波长530 nm的发射荧光强度实现细胞内ROS的定量。未染色菌丝体作为空白对照。
2 结果与分析
2.1 常见氨基酸抗菌效果
前期研究发现外源添加常见氨基酸能影响烟曲霉对ITC的耐受性[9]。有些氨基酸例如色氨酸、苯丙氨酸和酪氨酸能拮抗ITC;有些则能增强ITC的杀菌效果,例如赖氨酸、组氨酸和精氨酸[23]。为了观察氨基酸单独存在时对烟曲霉是否具有抑制作用,通过培养基添加实验分别检测了19种氨基酸(10 mg/mL,pH值6.5~7.0)对烟曲霉的抑菌效果。结果表明除组氨酸、半胱氨酸、色氨酸、酪氨酸和赖氨酸这5种氨基酸抑菌作用明显外,其他氨基酸均无明显的抑菌作用。在添加组氨酸、半胱氨酸和色氨酸时,烟曲霉菌落相比对照明显变小;而在赖氨酸存在时,烟曲霉的孢子产量相对于对照明显减少(图1)。
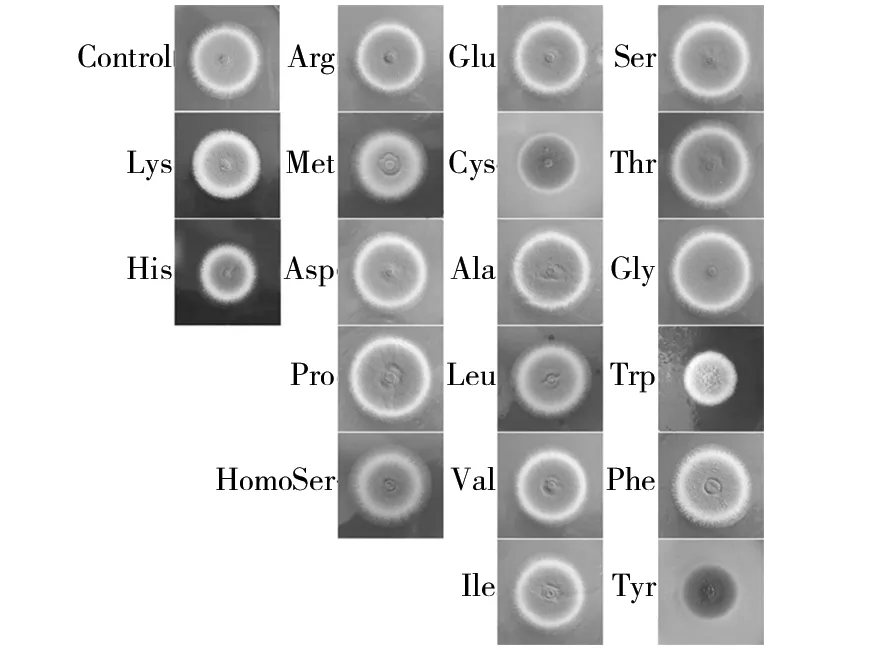
图1 19种不同外源性氨基酸对烟曲霉A1160c的体外作用效果Fig.1 In vitro effects of 19 different exogenous amino acids on A. fumigatus A1160c
2.2 ε-PL与抗真菌药物的协同作用
有研究发现,赖氨酸能够增强两性霉素B的体外抗真菌效果[24]。但由于单体的抗菌肽在复杂的生物环境中可被盐、多阴离子聚合物以及蛋白质水解酶迅速降解,从而限制了其治疗潜力[25-27]。弱抗真菌肽通过多聚化形成的多价肽,如ε-PL,与其单体相比具有更好的抗真菌活性[27]。基于以上研究,本研究将ε-PL与唑类药物中的ITC、VRC,以及棘白菌素类药物CS分别进行体外联用,检测其联用效果,探究ε-PL是否可以增强临床抗真菌药物对烟曲霉的活性。结果如图2A所示,从菌落大小上来看,1 mg/mL的ε-PL对烟曲霉有轻微的抑菌作用,与单独使用0.1 μg/mL ITC相比,1 mg/mL ε-PL与0.1 μg/mL ITC联用对烟曲霉的抑制效果最为明显,1 mg/mL ε-PL与0.1 μg/mL CS联用抑菌效果次之,1 mg/mL ε-PL与0.1 μg/mL VRC联用抑菌效果排最后。
E-test实验显示,1 mg/mL ε-PL可以将ITC、VRC和CS三种抗菌药物的MIC值分别从2、0.125、0.38 μg/mL下降至1、0.064、0.094 μg/mL(图2B)。综上,ε-PL和ITC或CS联用具有协同杀灭烟曲霉的作用,其中以ε-PL联合CS的抗菌效果最佳。因此,ε-PL具有成为ITC和CS的协同增效杀菌剂的潜力。
2.3 GSH与抗真菌药物的拮抗作用
如图3A平板点菌实验结果所示,对照菌A1160c的长势在添加1 mg/mL GSH的平板上与在MM平板上无明显区别,而其长势在GSH和抗真菌药物CS或ITC同时存在时比在CS或ITC单独存在时要好。据此结果可知,GSH能够拮抗CS或ITC的活性。
为了探明敲除烟曲霉GSH合成的相关基因对烟曲霉生长的影响,将烟曲霉γ-GCS基因gcsA(locus_tag=AFUB_035300)和GSH合成酶基因gshA(locus_tag=AFUB_054160)分别在A1160菌株中做了定点敲除。结果显示,相比对照菌株A1160c,在MM平板上gcsA基因缺失菌株(命名为ΔgshA)无法生长,而gshA基因敲除菌株(命名为ΔgshA)的生长情况与A1160c几乎一致(图3)。另外,抗真菌药物作用于ΔgshA时没有表现出耐药或者更加敏感的表型(图3)。
2.4 外源添加GSH对ΔgcsA致死表型的影响
ΔgcsA在MM培养基上不能生长,推测其可能和构巢曲霉ΔgcsA一样都是营养缺陷型菌株[21]。为了研究培养基中添加GSH能否回补烟曲霉ΔgcsA的生长,将A1160c、ΔgcsA、ΔgshA三株菌在一系列浓度梯度的GSH平板上培养,如图4所示,8 mmol/L的GSH更能部分弥补ΔgcsA的营养缺陷表型。表明γ-L-谷氨酰-L-半胱氨酸是菌体生长必需的多肽,可以代替GSH,而外源补充的GSH不能完全被ΔgshA菌体吸收利用。

图2 ε-PL与抗真菌药物的协同抗菌作用Fig.2 Synergistic effect of ε-PL and antifungal drugs on A1160cA: YAG平板点菌测试ε-PL(1 mg/mL)与ITC、VRC、CS(0.1 μg/mL)三种抗真菌药物联用时的抗菌效果;B: ε-PL(1 mg/mL)与ITC、VRC、CS(0.1 μg/mL)三种抗真菌药物联用的E-test药敏试验A: Effect of ε-PL (1 mg/mL) in combination with ITC, VRC or CS (0.1 μg/mL) on A1160c when cultured on YAG agar plates; B: E-test showing synergistic antifungal effect of ε-PL (1 mg/mL) and ITC, VRC, or CS (0.1 μg/mL)

图3 GSH与抗真菌药物的联用对A1160c和ΔgshA的作用效果Fig.3 The effect of GSH combined with antifungal drugs and GSH on the A1160c and ΔgshA strainsA: MM或MM添加抗真菌药物和GSH的平板上点菌培养48 h比较A1160c和ΔgshA菌落表型;B: 诊断PCR验证相比A1160c,ΔgshA菌株中的gshA基因全长被pyr4基因替代A: Colony comparison of wild-type (A1160c) and ΔgshA. Strains were grown on MM agar plates supplemented with ITC, VRC, CS and GSH at the indicated concentrations for 48 h; B: PCR analysis showing the full-length gshA was replaced by pyr4 gene in ΔgshA

图4 ΔgcsA和ΔgshA在添加不同浓度GSH的培养基上的生长情况Fig.4 The growth of ΔgcsA and ΔgshA on medium supplemented with the indicated concentrations of GSH
2.5 ITC和ε-PL联合用药时菌体内ROS含量变化
已有研究发现ITC可以刺激菌体内产生大量ROS,从而增强其抗菌作用,如H2O2可参与多种信号途径的活化,导致细胞凋亡[22,28]。为确认ε-PL和GSH分别在ITC抗菌中的作用效果是否与菌体内ROS的浓度有关,检测了ITC单独作用以及分别与ε-PL和GSH联用时菌体内ROS的含量。结果如图5A所示,在1 μg/mL ITC的基础上分别加入1 mg/mL ε-PL或10 mg/mL GSH刺激菌丝体时,ε-PL显著地增强了ITC刺激菌体内产生ROS的能力,而GSH则减少了ITC刺激菌体细胞产生的ROS。该结果与先前的研究发现,ε-PL通过刺激细胞内ROS生成而诱导细胞凋亡,而GSH可以降低唑类药物诱导的ROS的结果一致[16,22]。为进一步证明ROS与ITC联用时的协同作用,测试了0.1 μg/mL ITC联合1 mmol/L H2O2的抗菌效果,表明H2O2确实能够增强ITC的抗菌活性(图5B)。

图5 ROS参与ε-PL与ITC的协同作用Fig.5 ROS involves in synergistic effect of ε-PL and ITCA:ITC单独作用以及分别与ε-PL和GSH联用时菌体内的ROS含量。荧光强度值为3个生物学重复的平均值(***P<0.001);B:1 mmol/L H2O2增强了0.1 μg/mL ITC的抗菌活力A:ROS measurement in mycelia when ITC was alone and ITC combined with ε-PL or GSH. Fluorescence intensity values are presented as the means ± SD of three biological replicates and analyzed by one-way ANOVA with unpaired Student′s t-test (***P<0.001); B:Combination of 1 mmol/L H2O2 and 0.1 μg/mL ITC enhanced the activity against A. fumigatus
3 讨 论
通过平板测试、MIC值测定、基因敲除和ROS检测等实验研究了常见氨基酸以及常见多肽ε-PL和GSH对体外抗烟曲霉效果的影响。常见氨基酸中只有组氨酸、半胱甘酸、色氨酸、酪氨酸和赖氨酸这5种氨基酸有一定程度的抑菌作用。赖氨酸多聚化形成的ε-PL与ITC联用产生抗真菌的协同作用,推测该作用机制为ε-PL可以增强ITC刺激菌体细胞产生ROS的能力。相比与唑类药物联用,ε-PL与CS联用产生了更高强度的协同作用。ε-PL可以破坏真菌细胞膜,而CS的靶点是细胞壁,推测二者通过作用于不同的靶点从而发挥协同抗菌效果。
GSH在生物体内具有解毒和消除ROS的作用,生物体缺少GSH合成的关键酶GCS将无法生长,必须通过外源摄入补充。本研究发现gcsA基因对于烟曲霉生长尤为重要,缺失后即使外源添加不同浓度的GSH也无法完全恢复至正常的生长表型。已有研究指出,抗坏血酸和GSH等具有还原性的物质可以拮抗氟康唑的抗菌活性[22]。本研究发现GSH不仅对ITC有拮抗作用,同时对CS也有拮抗作用。结合ROS检测结果,认为GSH与抗真菌药物的拮抗作用不是直接作用于药物的靶点,而是通过消除上述抗真菌药物诱导菌体细胞产生的ROS而实现的。
活性氧ROS是由分子氧衍生而来的各种分子,可对DNA、蛋白质和脂质造成氧化损伤,最终导致细胞死亡[16]。除抑制麦角甾醇合成特定作用方式,很多唑类药物在抗真菌过程中一般具有ROS诱导作用,而诱导产生的ROS有助于增强抗真菌药物的抗菌效果[22]。相反,淬灭或减少唑类诱导的ROS积累则导致唑类抗真菌活性显著降低,产生一定程度的药物耐受。本研究也表明ε-PL以及GSH与抗真菌药物在体外的联合作用与ROS的生成和消除有着密切联系,这一发现可为临床抗真菌感染的联合用药治疗策略提供参考。