多株功能菌种混合培养条件的响应面优化及其生长关系
白红娟 , 卫燕红, 李 斌, 王海宾, 杨官娥, 蒋雪琴, 胡锦俊, 宋 雨
(1. 中北大学 环境与安全工程学院, 山西 太原 030051;2. 山西医科大学 药学院, 山西 太原 030001)
微生物制剂在治理农田土壤重金属(铅、镉、铬、锌和铜等)污染和抑制病虫害等方面具有绿色、经济、高效的优势[1]。目前,常用的制剂有光合细菌、芽胞杆菌、乳酸杆菌等单一菌剂[2-8],以及多株菌种按一定比例组成的复合菌剂[9-12]。由于单一菌剂和复合菌剂制备有自身的局限性,因此开发混合培养方法制备多株功能菌种制剂具有重要意义。与单一菌种培养相比,混合培养的工艺简单,成本较低,菌株之间的相互协同共生能充分发挥群体的联合作用,促进微生物的生长繁殖,底物被充分利用,提高生物量与菌株抗逆性,降低染菌率,从而取得最佳应用效果[13]。Nguyen等[14]采用酵母菌-醋酸菌混菌培养,发现混合培养可显著提高活菌数和生理代谢功能;许丽娟等[15]将酿酒酵母和干酪乳杆菌混合培养与单株培养进行比较,两者的活菌数各增加了0.39×108cfu/mL和2.53×108cfu/mL。同时,混合培养能产生更多的代谢产物或新的代谢产物。例如,将醋酸杆菌和乳酸杆菌混合培养,不仅能够增加原有代谢产物异戊酸、乙酸乙酯、甲酸辛酯的含量,还会产生新的代谢产物2,3-丁二酮[16]。不同菌种之间的混合培养不仅能够形成稳定的菌群,还能增加培养液中还原糖和有机酸的含量,促进多酚化合物的代谢[17]。本课题组在前期研究中发现光合细菌单一菌剂能有效修复铅、镉或铬[4-5]污染的土壤;文献报道沼泽红假单胞菌和枯草芽胞杆菌按一定比例组成的复合菌剂能修复镉污染土壤,且能促进作物生长[11];植物乳酸杆菌单一菌剂能够防治病原微生物并修复污染土壤中铜和锌[7]。为此,本研究将光合细菌(PSB)、枯草芽胞杆菌(BS)和植物乳酸杆菌(LP)进行混合培养,利用单因素和响应面试验优化培养基配方以及培养条件,通过功能菌的加性模型法、生长动力学以及混合培养的生长关系分析它们之间的生长关系,以期为多功能菌剂的混合培养提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 光合细菌(Photosynthetic bacteria,PSB),包括球形红细菌(Rhodobactersphaeroides)H菌株、沼泽红假单胞菌(Rhodopseudomonaspalustris)N菌株和深红红螺菌(Rhodospirilliumrubrum)M菌株,均由山西大学光合细菌研究室分离、鉴定并保存。植物乳酸杆菌(Lactobacillusplantarum, LP)为中北大学生物工程实验室保存,枯草芽胞杆菌(Bacillussubtilis, BS)购自中国微生物菌种保藏管理中心。
1.1.2 培养基 光合细菌(PSB)培养基:苹果酸2.5 g,酵母膏1.0 g,(NH4)2SO41.25 g,MgSO40.2 g,CaCl20.07 g,K2HPO40.9 g,KH2PO40.6 g,pH值为7,蒸馏水 1 000 mL;枯草芽胞杆菌(BS)和植物乳酸杆菌(LP)培养基分别采用NB和MRS培养基。功能菌培养基以光合细菌(PSB)培养基为基础培养基。
1.1.3 主要试剂及仪器设备 苹果酸、(NH4)2SO4、MgSO4、CaCl2等均为分析纯,酵母膏为生物试剂,购自天津市科密欧化学试剂有限公司。高压蒸汽灭菌锅(BXM-30R,上海博讯实业有限公司医疗设备厂);分析天平(AL204,梅特勒-托利多仪器上海有限公司);超净操作台(SW-CJ-1F,苏州安泰空气技术有限公司);人工气候箱(KRQ-300,上海德州市昊诚实验仪器有限公司);高速离心机(HC-3018,安徽中科中佳科学仪器有限公司)。
1.2 方法
1.2.1 菌株活化 分别将实验室保存的球形红细菌H菌株、沼泽红假单胞菌N菌株以及深红红螺菌M菌株于PSB液体培养基中活化,将这3株细菌按活菌数1∶1∶1混合培养48 h,即为PSB种子液。将BS和LP分别接种于NB和MRS液体培养基培养48 h,备用。
1.2.2 菌株抑菌试验 滤纸片法[18]测定功能菌之间的抑菌情况。向每个加有固体混合培养基的平板中,各加入100 μL的上述三种菌悬液(活菌数均为1×106cfu/mL),涂布均匀后,于平板中等距离放入4个直径为6.00 mm无菌滤纸片,在3个滤纸片上分别滴加15 μL上述三种菌液中的一种菌悬液(活菌数均为1×106cfu/mL),另外一个滤纸片滴加无菌水作对照,培养48 h,观察抑菌圈产生状况,每次试验做3个平行。
1.2.3 功能菌混合培养条件的单因素及响应面优化 ① 功能菌混合培养条件优化的单因素试验:以PSB培养基为基础培养基,将功能菌(PSB种子液∶BS∶LP=1∶0.6∶0.3,活菌数比)接种到250 mL锥形瓶中,装液量为100 mL,光照培养箱中静置培养,分别考察以下因素对功能菌菌株生长的影响:外加碳源 (葡萄糖、果糖、蔗糖或淀粉),碳源添加量(5、10、15和20 g/L),氮源1.25 g (蛋白胨、黄豆粉、硫酸铵、氯化铵或尿素)。这几种功能菌生长的适宜温度范围均为20~40 ℃,PSB和BS适宜的pH范围为5~9,LP适宜的pH为6.5左右,设置培养温度20、25、30、35、40 ℃,初始pH 5、6、7、8、9,接种量为接种后的初始培养活菌数分别为1.26×109、1.58×109、1.90×109、2.22×109、2.54×109cfu/mL,培养时间12、24、36、48、60 h。活菌数的测定采用平板菌落计数法。② 功能菌混合培养条件的响应面优化:在单因素试验结果基础上,根据Box-Behnken实验设计原理[19]选择对功能菌混合培养条件有显著影响的3个因素培养温度(A)、初始pH(B)、培养时间(C)为自变量,以总活菌数(Y)为响应变量,利用Design-Expert 10.0软件进行三因素三水平的响应面实验优化,设计见表1。
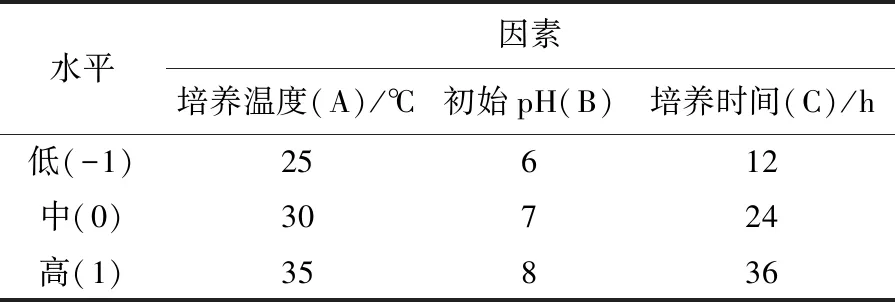
表1 响应面优化菌种混合培养条件的实验因素及水平Table 1 Response surface methodology for optimizing mixed culture conditions of strains
1.2.4 功能菌混合培养的生长关系 ① 加性模型法对微生物两两相互作用类型的预测:参照文献[20]方法,利用加性模型计算相互作用分数。相互作用分数计算公式:
式中,α1、α2和α3分别代表PSB和BS、PSB和LP、BS和LP两两混合培养的相互作用分数,NCO1、NCO2和NCO3分别代表PSB和BS、PSB和LP、BS和LP两两混合培养48 h的活菌数,NPSB、NBS和 NLP分别代表PSB、BS和LP纯培养48 h的活菌数。α>0表示协同作用,α<0表示拮抗作用。② 功能菌生长动力学模型分析:选择修正的Gompertz[21]方程式对实验数据进行拟合,得到待估参数以及拟合曲线。
式中,t为时间(h);yt为t时的菌液浓度(109cfu/mL);ymin为最小菌液浓度(109cfu/mL);A为菌数增长的对数值;μmax为最大比生长速率(h-1);λ为延滞期(h)。③ 功能菌混合培养的生长关系:测定3种功能菌在最佳培养条件下混合培养与纯培养过程中的细胞生长量, 通过比较两种培养条件下细胞对数生长期的繁殖代数(N)、生长速率常数(R)与世代时间(G)的差异,分析3种功能菌混合培养时的生长关系。计算公式:繁殖代数N=3.322(lgx2-lgx1);生长速率常数R=N/(t2-t1);世代时间G=1/R。式中,t1、t2为菌种进入对数生长期初期与末期的培养时间;x2、x1为菌种进入对数生长期初期与末期的活菌数。
1.2.5 数据处理 利用软件Design-Expert 10.0对响应面设计实验结果进行分析。实验数据均为3次重复的平均值±标准误差值,采用Microsoft Excel 2019和Origin 8.0软件分析与作图,运用SPSS22.0软件对数据进行统计分析。
2 结果与分析
2.1 菌株抑菌试验分析
菌株抑菌试验是鉴定菌株间能否共存的常用方法,试验结果如图1所示。

图1 3种功能菌的抑菌情况Fig.1 Bacteriostasis situation of the three functional strains
从图1可以看出,滤纸周围无抑菌圈,说明这三种功能菌PSB(H菌株、N菌株和M菌株)、BS和LP之间无抑制作用,可以共存,因此这三种功能菌可以混合培养。
2.2 功能菌混合培养的培养基成分和培养条件优化的单因素试验
对功能菌混合培养条件进行优化,以促进混合菌株的生长。图2为功能菌混合培养的培养基成分和培养条件优化的单因素试验结果。由图2A可知,在混合培养过程中,葡萄糖作为外加碳源时,BS和LP的活菌数最高,分别为3.84×109cfu/mL和1.37×109cfu/mL;而蔗糖作为外加碳源时,PSB的活菌数最高,为10.4×109cfu/mL。总的来说,这3种菌在这4种外加碳源中均能很好生长,而蔗糖作为外加碳源时的总菌数最高,为13.52×109cfu/mL,因此,选择蔗糖作为混合菌混合培养的外加碳源。由图2B可知,当蔗糖添加量为10 g/L时,总活菌数最高,再增加蔗糖用量时,总活菌数反而会下降,因此选择10 g/L作为蔗糖的添加量。由图2C可知,当硫酸铵作为氮源时,PSB、BS和LP均生长最好,总活菌数最多,因此选择硫酸铵作为菌种混合培养的氮源。由图2D可知,随着培养温度的不断升高,PSB、BS和LP三者的活菌数呈现先上升后下降的趋势。当培养温度为30 ℃时,除BS菌株(35 ℃时活菌数最高)外,其余活菌数均最高,总活菌数为13.52×109cfu/mL;再随着温度的升高,总活菌数降低,可能是温度过高影响了菌株的酶活性。由图2E可知,随着初始pH由酸性向碱性变化时,活菌数呈先上升后下降趋势,初始pH 6~8时,PSB、BS和LP的活菌数无显著差异,但pH 5和pH 9时,活菌数明显低于pH 7时的活菌数,可能是pH过高或过低会破坏酶的结构,导致酶的活性降低。由图2F可知,接种量对活菌数没有显著影响,接种量在接种后的初始活菌数为1.90×109cfu/mL时,总活菌数增长最大,所以选择该接种量为最佳接种量。由图2G可知,PSB、BS和LP的活菌数均随培养时间延长呈先上升后下降趋势,24 h时三者的活菌数最高,总活菌数达到13.52×109cfu/mL,之后活菌数逐渐降低。
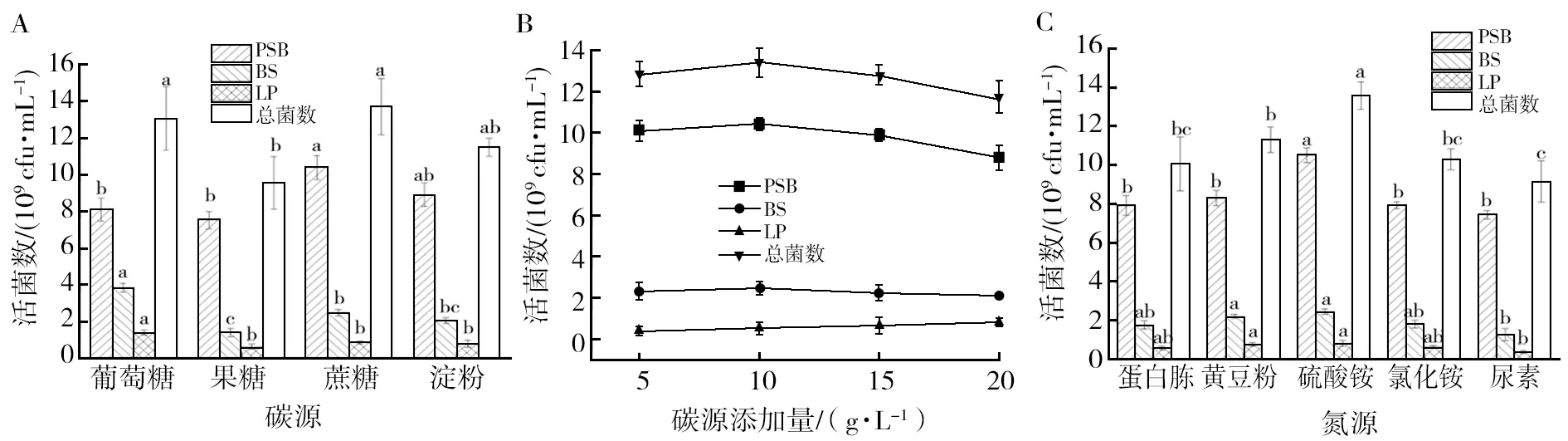
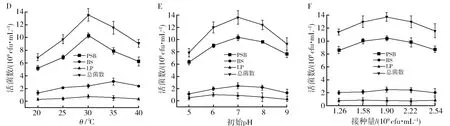

图2 碳源种类(A)、碳源添加量(B)、氮源种类(C)、培养温度(D)、初始pH(E)、接种量(F)和培养时间(G)对混合功能菌生长的影响Fig.2 Effect of carbon source (A), carbon source addition (B), nitrogen source (C), culture temperature (D),initial pH (E), inoculum(F)and culture time (G) on growth of mixed functional strains字母不同表示差异显著性(P<0.05)Different letters indicate significant difference (P<0.05)
2.3 菌种混合培养条件响应面试验优化结果
根据单因素试验结果,选出对功能菌混合培养条件影响显著的3个因素培养温度(A)、初始pH (B)、培养时间(C)进行响应面优化。响应面设计方案及结果见表2,方差分析见表3。由表3可知,回归模型(P<0.01)表明方程模型极显著,失拟项值(P=0.928 7>0.05),失拟项不显著。该回归模型的总决定系数R2=0.999 8,说明该模型可信度高,拟合程度较好,试验误差小,因此该回归方程模型成立,能够准确分析总活菌数与培养温度(A)、初始pH(B)及培养时间(C)3个因素之间的关系及其交互作用的影响。回归模型的一次项A、B、C、交互项AC、BC及二次项A2、B2、C2对活菌数影响极显著(P<0.01),交互项AB对活菌数影响不显著(P>0.05)。通过F值和显著水平得到影响功能菌生长的各因素顺序为培养时间(C)>培养温度(A)>初始pH(B)。
通过软件Design Expert 10.0模拟,响应面可以直观地看出培养温度、初始pH、培养时间3个因素交互作用对活菌数的影响(图3)。图3中曲面弧度表示两个因素共同作用对活菌数的影响程度,弧度越大表明影响作用越强烈,反之越弱。3因素两两交互项对活菌数影响的强弱顺序为AC>BC>AB。
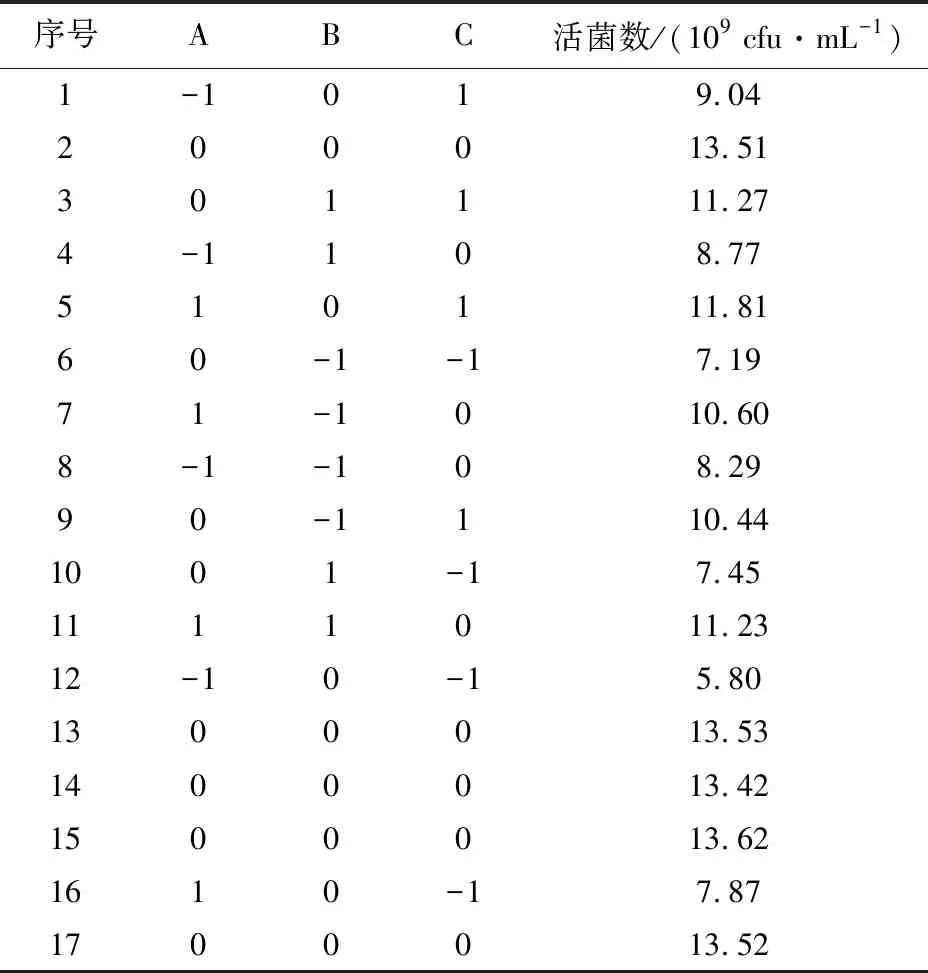
表2 响应面试验设计与结果
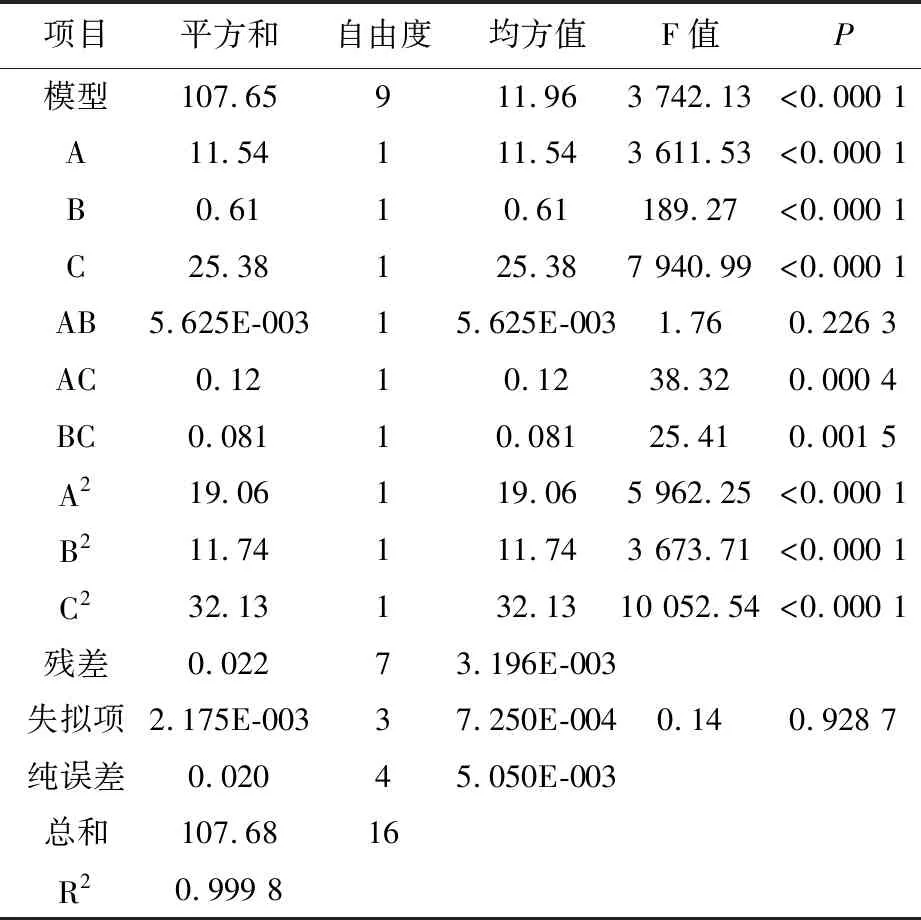
表3 响应面二元回归方程方差分析结果
根据响应面软件分析结果,功能菌混合培养的最佳条件为培养温度31.5 ℃、初始pH值7.1,培养时间28.0 h。最佳培养条件下进行3次验证试验,得到PSB活菌数为(10.55±0.23)×109cfu/mL,BS活菌数为(2.49±0.11)×109cfu/mL,LP活菌数为(0.86±0.08)×109cfu/mL,各个功能菌的活菌数均有所上升。根据每种功能菌的活菌数计算得出3种菌的总活菌数为13.9×109cfu/mL,与模型预测的最高总活菌数(14.01×109cfu/mL)相比,相对误差仅为0.79%,说明该模型具有准确性和有效性。
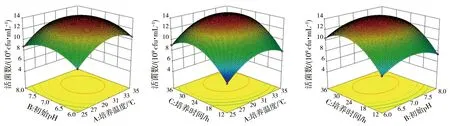
图3 各因素交互作用对混合菌种生长的影响Fig.3 The interaction of various factors on the growth of mixed strains
2.4 3种功能菌混合培养的生长关系
2.4.1 两菌混合培养过程分析 根据加性模型计算结果得出,相互作用分数α1、α2、α3分别为0.087、0.399、0.145,均大于0,初步推测这3种功能菌两两之间为协同作用。
2.4.2 菌体生长动力学分析 菌体生长动力学模型拟合结果如图4和表4所示。在图4中,拟合值与实验结果基本保持一致,拟合菌体生长曲线与测得的实验值保持同步变化,且都存在一个延迟期,随后进入指数生长期,最后到达稳定期。除此之外,与纯培养相比,三者的活菌数都有不同程度的提高,混合培养条件下PSB为优势菌种,活菌数增加明显,表明混合培养对PSB的促进作用最大,BS和LP的活菌数增长幅度较小。由表4可知,各方程的相关系数均在0.95以上,修正的Gompertz方程能较好地反映混合前后3种功能菌的生长过程,模型拟合良好,能准确反映功能菌混合培养生长过程中菌体生长的动态变化规律。对各功能菌纯培养和混合培养时的生长特征参数进行比较发现,混合后3种功能菌的最大比生长速率μmax均增大,延滞期λ均减小,说明混合培养能够促进菌株的生长。
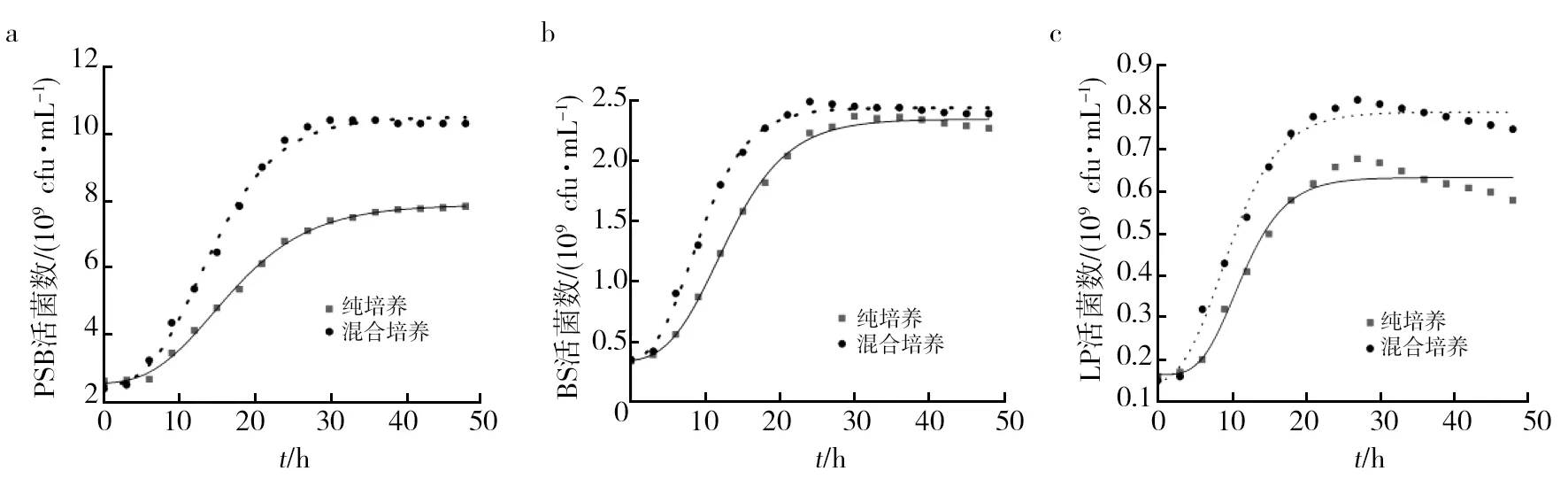
图4 PSB(a)、BS(b) 和 LP(c)的生长曲线Fig.4 Growth curve of PSB(a)、BS(b) and LP(c)
2.4.3 功能菌混合培养的生长关系 通过生长动力学方程计算得出各功能菌纯培养时和混合培养时的生长特征参数,结果见表5。从表5中可以看出,PSB、BS和LP在混合培养时,其生长速率均表现出比纯培养快,世代时间比纯培养短的特征。其中,混合培养PSB和LP的生长速率常数均分别提高了0.03 h-1,世代时间分别提高了7.0 h和4.3 h,极大地提高了生长效率;而混合培养BS相对来说提高的少一些,生长速率和世代时间分别提高了0.02 h-1和2.0 h。因此,实验表明PSB、BS和LP三者之间存在互为有利的互生关系。

表4 PSB、BS和LP的生长动力学
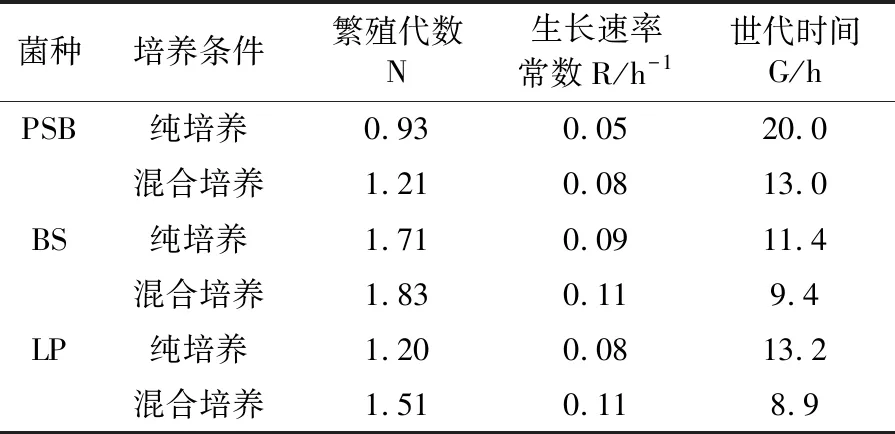
表5 功能菌在不同培养条件下的生长特征比较
3 讨 论
微生物生长不仅取决于菌种本身的特性,还需要合适的培养条件。培养条件的优化是菌株应用到实际生产中所经历的一个重要环节,直接关系到菌剂的质量和生产效益[22]。本研究通过单因素和响应面试验优化混合功能菌的培养条件,促进混合功能菌的生长,为功能菌的混合培养提供参考。本研究中PSB以苹果酸为碳源,BS和LP以糖类为碳源,考察添加糖类作为混合菌的外加碳源,用量参照NB和MRS培养基;这3种菌均能利用酵母膏生长,因此以BS和LP能够利用的几种常用氮源为研究对象,考察不同氮源对混合菌的影响,用量参照光合细菌培养基中(NH4)2SO4的用量。单因素和响应面试验结果表明,功能菌混合培养的最佳培养条件为外加碳源10 g/L蔗糖,氮源1.25 g/L (NH4)2SO4,培养温度31.5 ℃,初始pH 7.1,接种量为接种后的初始活菌数1.90×109cfu/mL,培养时间28.0 h。这3种菌混合培养后,活菌数均有不同程度的提高。韩梅等[23]的研究成果也表明,混合培养能够促进多菌株生长,提高微生物活性。此次试验证实响应面优化PSB、BS和LP的培养条件具有可行性,为进一步综合利用菌株的混合培养提供参考。
在微生物培养过程中,可以通过建立数学模型实现对微生物动态变化的快速预测和评价,了解微生物代谢过程[24]。Deseure等[25]以乳酸作为碳源,在准连续模式下运行的光-生物反应器中培养荚膜红细菌时,通过Gompertz模型的建立,计算该菌的生长,有助于连续发酵过程中细菌生长过程的自动化和控制。宋增光等[26]通过研究发酵过程中的动态变化,建立紫红曲菌发酵薏米的菌体生长动力学模型,模型的预测值和实测值拟合效果良好,所建Logistic模型能较好反映紫红曲菌发酵薏米过程中的生长动力学变化。Sharma等[27]使用修正的Logistic模型模拟植物乳杆菌CRA52在乳清渗透培养基中的增长,该模型很好地解释了植物乳杆菌CRA52的生长行为以及乳酸和植物乳杆菌素的形成。本研究选择修正的Gompertz方程拟合出菌株纯培养和混合培养的生长曲线,分析各功能菌生长的动态变化规律,直观地了解各功能菌的生长过程,通过模型的建立实现对微生物动态变化的快速预测和评价。在此基础上,进一步通过分析菌种混合培养与纯培养时的生长特征,确定混合菌的生长关系。冯栩等[28]将分离的4株功能菌进行纯培养和混合培养,通过构建动力学模型对各菌种在不同时间的菌体生长量进行预测,进而比较各菌纯培养和混合培养时的生长特征参数,判断混合培养条件下各个菌种之间的生长关系。谢航等[29]通过比较地衣芽胞杆菌、荚膜红假单胞菌和假丝酵母菌在纯培养和混合培养条件下的繁殖代数、生长速率常数与世代时间的差异,确定这3种功能菌混合培养的生长关系。本研究根据动力学方程求出PSB、BS和LP纯培养和混合培养时的生长特征参数,随着生长速率常数的提高和世代时间的缩短,初步证明了PSB、BS和LP对彼此的生长具有不同程度的促进作用,三者之间为互为有利的互生关系。其相互促进生长的原因可能是培养前期BS的生长消耗了其中的氧气,为PSB和LP的生长提供了厌氧环境;PSB的光能代谢过程可以将纯培养中单一的反应进行彻底,进一步提高活菌数;LP维持了混合菌种生长过程中的pH。因此这3种功能菌混合培养后,活菌数均有不同程度的提高,这与李勤生等[30]研究的光合细菌与异养细菌混合培养能够相互促进生长的结论一致,可能是由于菌种之间的相互协同共生作用促进了微生物的生长繁殖。此次试验仅测定了混合培养过程的活菌数,对培养过程中的溶解氧、pH、代谢产物尚未进行检测,需通过进一步试验进行分析,初步探明菌种之间的协同共生作用机理,为混合培养过程进行更有效的理论指导。
复合微生物菌剂中含有多类菌种,通过微生物菌种之间的生命活动及其代谢产物的协同共生作用,修复重金属污染和防治病原微生物的效果远远大于单一菌种。例如,在镉、砷污染严重的土壤中,施用沼泽红假单胞菌、胶质红假单胞菌、粪假单胞菌、苯甲酸盐红长命菌,能促使小麦、菜豆、烟草和水稻等作物稳产,同时降低了作物对重金属的吸收,比单一菌的实施效果更好[31]。Zervas等[32]研究表明,叶层细菌甲基杆菌属(Methylobacteriumspp.)菌株可以通过分泌代谢物细菌素、羟基苯甲酸等保护植物免受病原微生物的侵害,并且能够持续生长。本研究通过混合培养方法制备的多功能菌剂拓展了单一菌株的功能,在后续的研究工作中进一步将该多功能菌剂应用于土壤重金属污染的修复和防治病虫害,并对菌种混合培养功能进行评价,为该多功能菌剂的进一步推广应用提供参考。