酶标仪分光光度法在微生物耐性研究上的应用
肖 蓉, 胡 展, 罗容珺, 杨 华, 雷 平, 郭照辉, 李咏梅, 付祖姣
(湖南省微生物研究院 湖南省农用微生物应用工程技术研究中心,湖南 长沙 410009)
活体微生物制剂利用微生物在不同环境中的自我繁殖能力,在改善微生物群落结构、降低污染、提升土壤地力、促进作物生长和抗病能力等方面发挥着越来越重要的作用[1-4]。截至2019年11月,在农业部登记的微生物肥料产品达6 617个,其中农用微生物菌剂约3 000个,占比近50%,使用的微生物种类超过170个,涵盖了细菌、放线菌和真菌各大类别(http://www.biofertilizer95.cn/zhdjcpml)。至2019年11月,登记的微生物农药产品有468个,主要涉及芽胞杆菌、真菌和病毒等微生物(http://www.chinapesticide.org.cn/hysj/index.jhtml)[5]。此外,微生物在饲料、食品、环保和能源等领域的应用也在逐年增加。虽然微生物在农业、饲料业、环境等领域已经取得了很好的成绩,但微生物在环境中的应用效果严重受限于其定殖水平和对环境的耐受能力[6-8]。耐受能力弱的微生物在产品货架期或投入环境后,可能因为存活率过低很难被检测到[9],或者即便能检测到,也因为增殖力弱而难以达到预期效果。因此,对微生物进行包括紫外线、盐、酸碱度和温度等环境条件的耐受水平分析是对于功能微生物的应用具有重要意义。传统微生物环境耐受水平分析主要是通过平板分离获得对单克隆菌落数量的统计,或通过试管、摇瓶进行微生物培养,再根据菌体光密度分析其生长曲线[10-11]。为了摸索简便可行的操作方法,研究人员采用96孔培养板培养微生物,以获得微生物对不同抗生素的耐受水平[12],或实现对功能菌株的高通量筛选[13],证实了96孔培养板对微生物进行微量培养的可行性和便利性。还有学者比较了酶标仪微量法和分光光度法在测定大肠埃希菌发酵菌液浓度上的差异,结果显示两者获得的菌液吸光度值无显著性差异,但酶标仪微量法测得的结果准确度和精密度更高[14]。平板分离法是评价微生物环境耐受水平的最经典方法,但该方法操作繁琐、耗时长,且因为操作繁琐会导致结果误差较大。随着酶标仪应用的不断深入[15-17],其在微生物检测上的便利性和重要性也日益凸显。本研究通过比较酶标仪分光光度法和传统平板分离法检测微生物对不同环境条件耐受水平上的差异,期望为微生物的耐性研究提供一种快速、简便且高效的方法。
1 材料与方法
1.1 材料
1.1.1 供试菌株 解淀粉芽胞杆菌(Bacillusamyloliquefaciens)20-10、嗜线虫沙雷氏菌(Serratianematodiphila)C7-1、链霉菌(Streptomycessp.)Ahn30和TJA4由湖南省微生物研究院植物营养与保护室分离并保存。
1.1.2 培养基 ①LB培养基用于细菌的培养。②ISP2培养基 (g/L):酵母提取物10,麦芽提取物4,葡萄糖4,用于放线菌的培养[18]。
1.1.3 主要仪器与设备 微孔板恒温震荡器(MB100-4A,杭州奥盛);全波长酶标仪(Multiskan SkyHigh,Thermo Fisher Scientific);8通道移液器(1~10 μL 和30~300 μL,Thermo Fisher Scientific)。
1.2 方法
1.2.1 微生物菌悬液的制备 细菌在LB培养基上划线纯化,挑取单菌落接入10 mL新鲜LB液体培养基中,30 ℃培养过夜,备用。链霉菌在ISP2固体培养基上28 ℃划线纯化,挑取单菌落转接新鲜ISP2培养皿28 ℃培养3~5 d,待孢子长好,用灭菌不锈钢称量勺轻轻刮取孢子于适量的含0.5%吐温-80的水溶液中悬浮,制成孢子悬浮液。
1.2.2 平板分离法检测菌株紫外线耐受水平 取1~2 mL菌悬液加入24孔培养板中,置于30 W、254 nm波长紫外线灯正下方30 cm处分别照射2、5、10、30 min,以未经紫外线照射的处理为对照,每个处理重复3次。取1~2 mL链霉菌孢子悬浮液加入24孔培养板中,在相同紫外线条件下分别照射10、30、60 min。将紫外线照射后的菌悬液按比例用无菌水稀释至合适浓度,并分别取100 μL稀释样品涂布LB或ISP2平板,每个稀释样品重复涂布2个平板,细菌30 ℃培养 48 h,链霉菌28 ℃培养72 h,统计菌落数。
1.2.3 酶标仪分光光度法检测菌株紫外线耐受水平 菌悬液或孢子悬浮液按1.2.2进行紫外线照射后,按2%(体积分数)的接种量接入预先添加200 μL/孔 LB或ISP2培养液的96孔培养板中,每个样品重复2次。以2%无菌水接种的培养液做空白对照。接种完成后在96孔板上贴上一层无菌专用封膜,再盖上96孔板盖,以避免孔内培养液在振荡过程中溅出互相污染。将96孔板放入微孔板恒温振荡器上,细菌30 ℃、500 r/min培养2、4、6、8 h,链霉菌28 ℃、500 r/min培养6、12、18、21、24、27 h,用酶标仪检测各培养液在600 nm的吸光度(OD600),以时间为横坐标,以吸光度为纵坐标,绘制菌株生长曲线。
1.2.4 酶标仪分光光度法检测细菌的pH耐受水平 将LB培养液用HCl或NaOH调整pH值分别为4、5、6、7、8、9。在96孔板中加入200 μL不同pH值的LB液体,以2%的接种量接入培养过夜的菌悬液,贴上封膜,并盖上板盖,放入微孔板恒温震荡器上30 ℃,700 r/min培养2、4、6、8 h。分别以不同pH值的未接菌培养液做空白对照,每个pH重复6次。用酶标仪检测各培养液的OD600,并绘制菌株生长曲线。
1.2.5 酶标仪分光光度法检测细菌的盐耐受水平 配制含1%、3%、5%、7%、9%NaCl的LB培养液。按1.2.4的方法加入培养液和菌悬液并培养,分别以不同盐浓度的未接菌培养液做空白对照。用酶标仪检测各培养液的OD600,绘制不同盐浓度下菌株的生长曲线。
1.2.6 数据处理 采用Excel软件对数据进行处理和统计,采用SPSS19.0软件(Duncan法)对不同处理间的差异进行显著性分析。
2 结果与分析
2.1 传统平板分离法和酶标仪分光光度法在细菌紫外线耐受性能检测上的差异分析
将解淀粉芽胞杆菌20-10、嗜线虫沙雷氏菌C7-1分别紫外线照射0~30 min,采用传统平板分离菌落计数方法统计活菌数,结果如图1所示。两种细菌分别经紫外线照射2、5、10和30 min后,活菌数均有所下降。其中,菌株20-10经紫外线照射2~10 min时,活菌浓度下降约一个数量级,菌株存活率为(28.58±2.23)%~(12.04±1.42)%,但当该菌株经紫外线照射30 min时,活菌浓度下降非常显著,直接下降2个数量级,降至(7.27×107±7.02×106) cfu/mL(表1),菌株存活率为(0.64±0.06)%。沙雷氏菌C7-1经紫外线照射后的活菌浓度下降趋势与菌株20-10一致,但活菌下降比例更多,菌株存活率仅为(10.32±0.57)%~(0.26±0.09)%。该结果说明嗜线虫沙雷氏菌耐紫外线性能比解淀粉芽胞弱。经统计学分析不同处理间的数据差异,发现无论紫外线照射多长时间,其活菌浓度均在对照基础上呈显著性下降(P<0.05),但照射2~5 min差异不显著,而照射(2~5)、10、30 min差异显著(表1)。
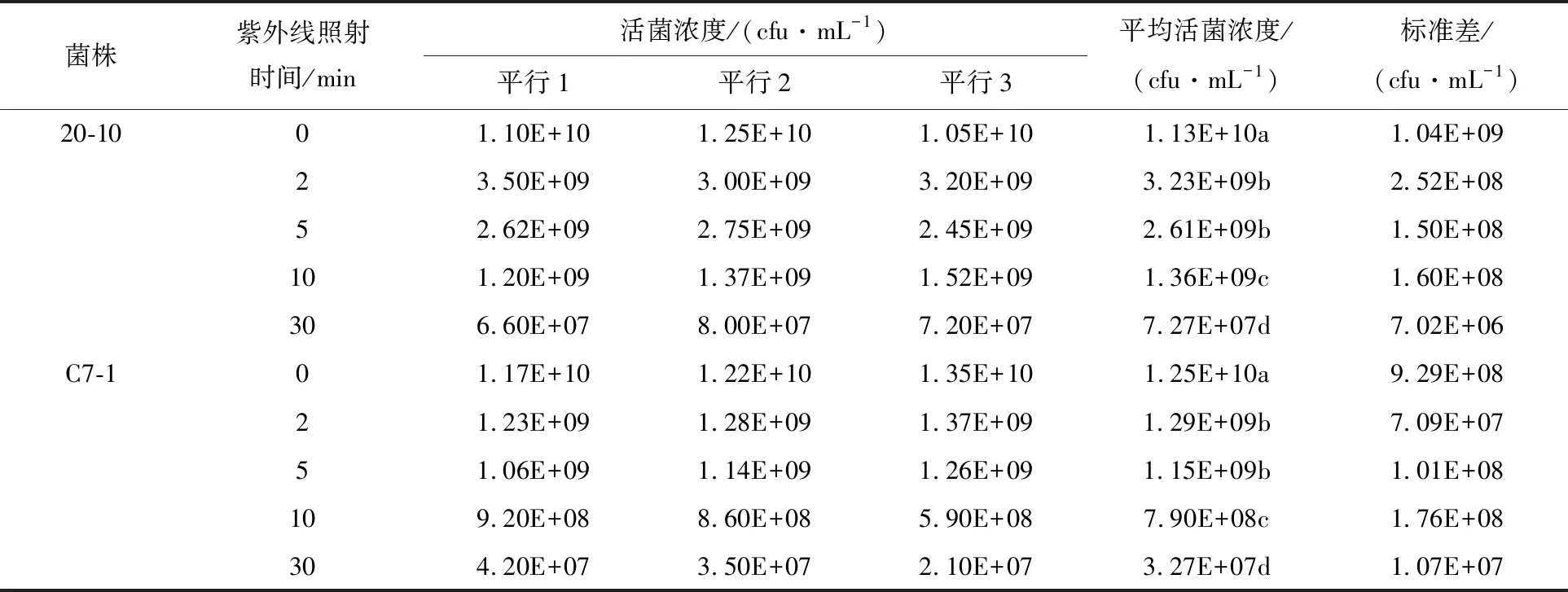
表1 细菌经紫外线照射后的活菌浓度
采用酶标仪分光光度法分析菌株20-10、C7-1经紫外线照射后的生长曲线(图2)。从生长曲线分析,菌株20-10经紫外线照射2、5、10 min后,生长曲线与对照基本一致,4~6 h的平均生长速度比对照分别下降了7.24%、11.96%和12.83%,但该菌株经紫外线照射30 min后的生长曲线与对照有明显差异,对数期时间延长,4~6 h的平均生长速度比对照下降了24.34%。不同处理间的数据经统计学分析发现,菌株20-10经紫外线照射不同时间后,生长所至的最高细胞光密度值之间差异不显著,但均显著低于对照(P<0.05)。菌株C7-1经紫外线照射2~30 min后,生长曲线基本与对照一致,对数期和稳定期时间也基本保持一致。对不同紫外线照射时间后的细胞光密度进行统计学分析发现,菌株在培养前2 h,紫外线照射后的菌株生长光密度均显著低于对照,当培养4 h时,除了紫外线照射30 min的处理外,其他处理的光密度与对照无显著差异,随后各处理分别达到各自的生长顶峰,但所有紫外线照射后的最高光密度值均显著低于对照(P<0.05)。
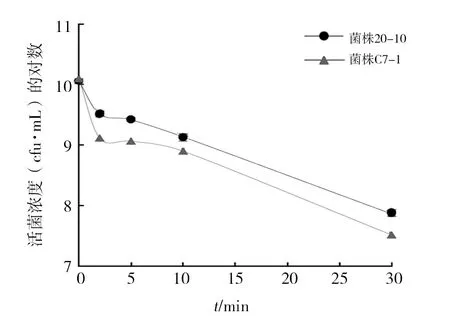
图1 细菌经紫外线照射后的活菌数(平板分离法)Fig.1 The number of viable bacteria after UV irradiation(Plate separation method)

图2 菌株20-10和C7-1经紫外线照射后的生长情况(酶标仪分光光度法)Fig.2 The growth of strain 20-10 and C7-1 after UV irradiation(Microplate reader method)
通过比较两种方法检测菌株耐紫外线性能的差异(表2),发现两者存在显著不同。传统平板分离法获得存活菌株的数目,一个菌株经紫外照射4个时间,重复3次,稀释3个浓度,每个浓度2个平行,所需平板数量90个,且每个平板都涉及加样、涂布,若2个菌株,则需至少0.5 d以上。此外,该方法培养时间较长,约需2 d,最后平板菌落数量统计依然还需要大量时间。而采用96孔培养板培养,一块板可以同时检测2个菌株,即便每个时间段使用单独培养板进行检测,平均一个菌株最多使用2块板。8通道移液器的使用,使96孔培养板加样时间大大缩减,培养时间只需8 h,酶标仪检测仅需几分钟就能完成检测,整个实验可控制在1 d内完成。结果分析表明,两种检测方法均能体现菌株对紫外线的耐受水平,均能进行显著性差异分析,且两者获得的显著性程度基本一致,经紫外线照射后,两个菌株的活菌浓度及生长所至最高光密度均显著低于对照。只是两种方法检测的结果不同,前者检测的是存活菌株的浓度,而后者获得的是存活菌株的生长曲线。

表2 两种方法检测细菌紫外线耐受性能的差异
2.2 传统平板分离法和酶标仪分光光度法分析链霉菌紫外线耐受性能的差异分析
考虑到链霉菌在实际中的广泛应用,本研究同样比较了两种方法在检测链霉菌紫外线耐受性能上的差异。传统平板分离法检测发现两株链霉菌Ahn30、TJA4的孢子经紫外线照射后,存活趋势一致(图3)。两个菌株的孢子悬浮液在紫外线照射10~60 min时,孢子浓度与对照相比,均显著下降1~2个数量级,且下降比例与时间呈正相关(表3)。经统计学分析,两株链霉菌经紫外线照射10~60 min后的活菌浓度与对照相比差异均显著(P<0.05),但不同紫外线照射时间的处理差异不显著(P>0.05)。
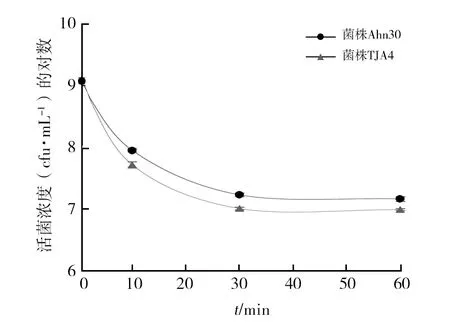
图3 链霉菌经紫外线照射后的活菌数(平板分离法)Fig.3 The number of viable streptomyces after UV irradiation(Plate separation method)
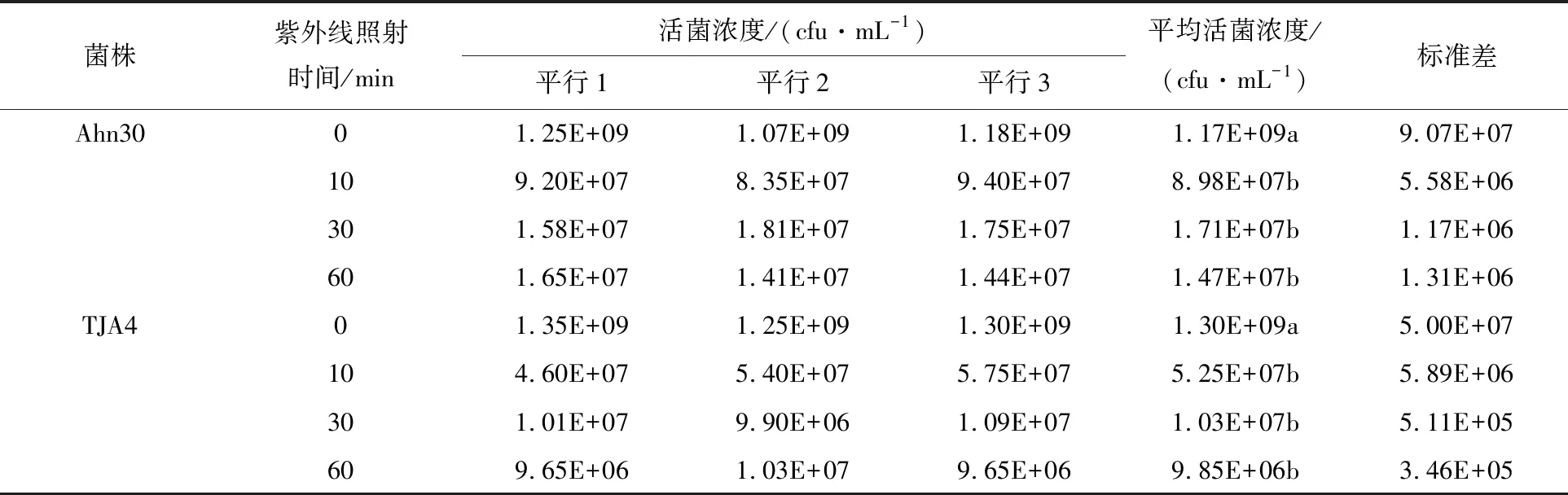
表3 链霉菌经紫外线照射后的活菌浓度
采用96孔培养板培养并经紫外线照射不同时间的孢子悬浮液,通过酶标仪检测不同时间培养物在600 nm处的吸光度,发现两株链霉菌经紫外线照射后,孢子萌发和菌丝延伸速度明显变缓(图4)。与未经紫外线照射的菌株相比,菌株Ahn30和TJA4在培养的前24 h光密度均显著低于对照(P<0.05),但这种差异在随后的培养中逐渐降低,菌株Ahn30培养至27 h差异已不显著,但菌株TJA4所需时间可能更长。两株链霉菌经紫外线照射后的孢子培养所至最高光密度的时间随着紫外线照射时间的延长而延后,但最高值均显著低于对照。
2.3 酶标仪分光光度法在检测微生物其他耐受特性上的应用
为了检测该方法的适用性,本研究分析了其在细菌和放线菌对pH和盐耐受上的检测效果(图5~7)。图5结果显示,菌株C7-1比20-10具有更广泛的pH适应性,前者在pH 5~9的范围内均能很好地生长,仅在pH 4的条件下生长变缓,而后者在pH 8的条件下生长最佳,其次为pH 6和pH 7,在pH 4下几乎不生长。从图6可以看出,菌株20-10能在1%~7%的盐浓度下生长,但随着盐浓度增加,迟缓期延长,当盐浓度达到7%时生长非常缓慢;而菌株C7-1在低于3%的盐浓度下能够生长,而当盐浓度提高至5%以上时几乎不生长。图7为链霉菌对盐的耐受水平,从图7可看出,菌株Ahn30能在0%~3%的盐浓度下生长,当盐浓度高于5%时几乎不生长;而菌株TJA4在0%~9%的盐浓度下均能生长,但随着盐浓度的升高延滞期延长,生长速度和最高活菌体密度都会降低。与细菌生长曲线相比较,虽然酶标仪分光光度法能检测放线菌在不同盐浓度下的生长情况,但链霉菌在96孔板中培养的平行差异非常大,这可能是因为随着培养时间的延长放线菌菌丝成团所致。鉴于此,本研究未分析该方法对链霉菌pH耐受的适用性。
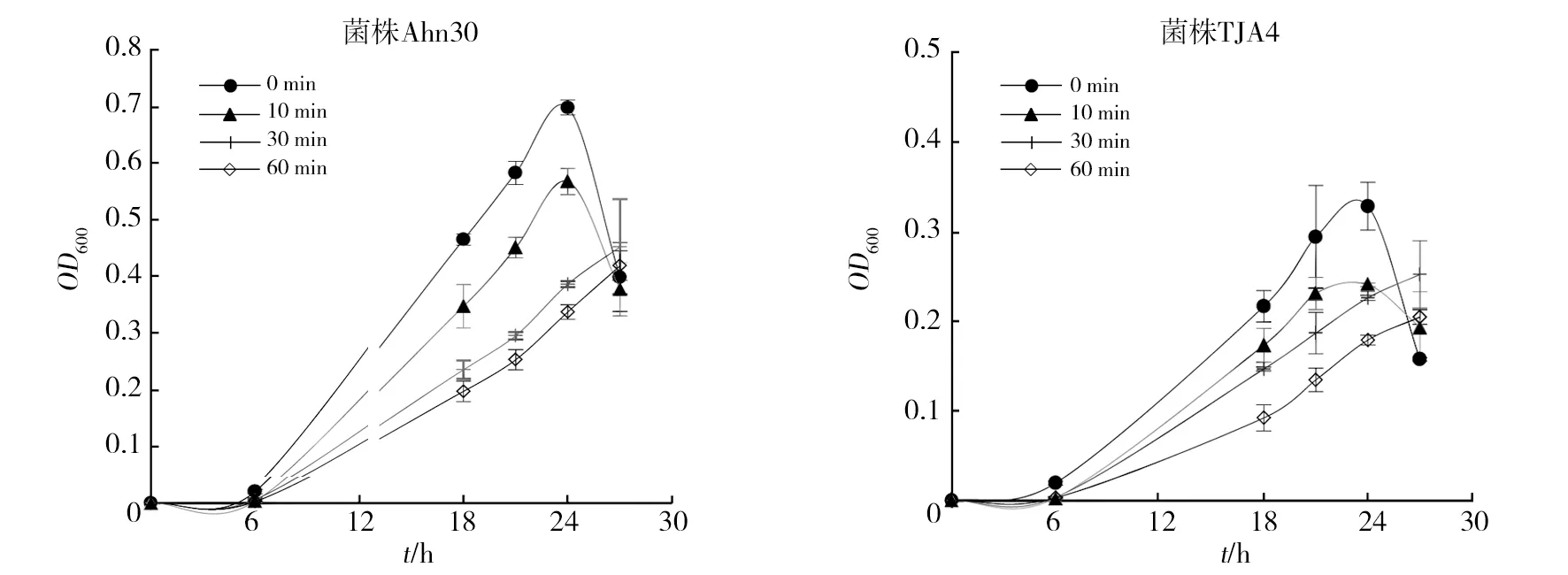
图4 链霉菌Ahn30和TJA4经紫外线照射后的生长情况(酶标仪分光光度法)Fig.4 The growth of strain Ahn30 and TJA4 after UV irradiation(Microplate reader method)
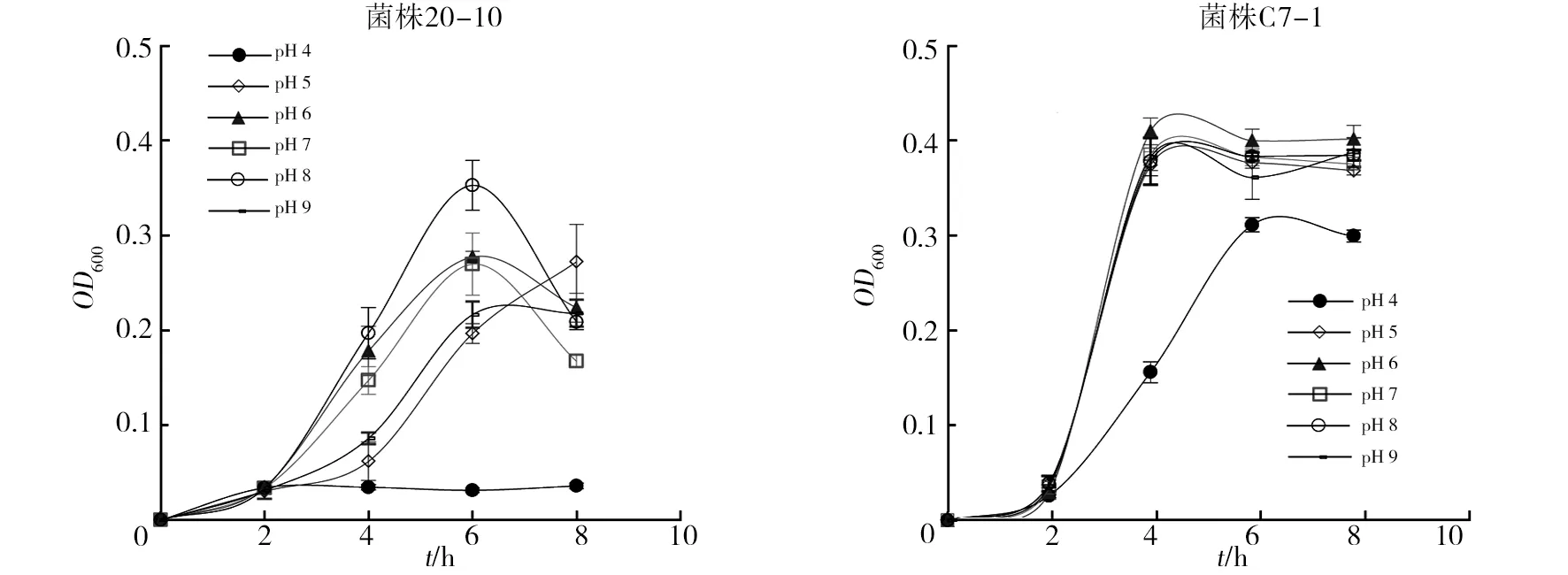
图5 菌株20-10和C7-1在不同pH条件下的生长情况(酶标仪分光光度法)Fig.5 The growth of strain 20-10 and C7-1 at different pH(Microplate reader method)
图6 菌株20-10和C7-1在不同盐浓度下的生长情况(酶标仪分光光度法)Fig.6 The growth of strain 20-10 and C7-1 at different salt concentrations(microplate reader method)
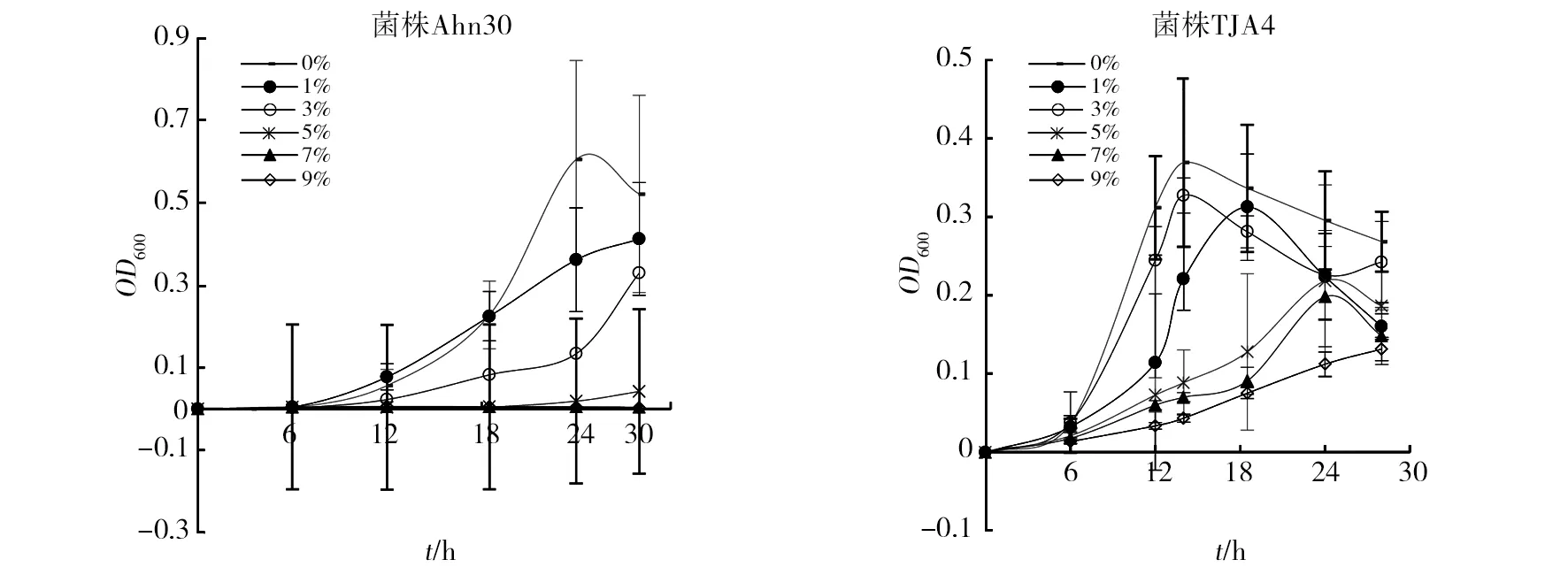
图7 链霉菌Ahn30和TJA4在不同盐浓度下的生长情况Fig.7 The growth of strain Ahn30 and TJA4 at different salt concentrations
3 讨 论
本研究采用传统平板分离法和酶标仪分光光度法分别检测了细菌和链霉菌对紫外线的耐受性能,并比较分析了两种方法的优缺点。两种方法均能分析微生物的紫外线耐受水平,但传统平板分离法是通过统计菌株经紫外线照射后的存活量来进行判断,而酶标仪分光光度法不能获得菌株的存活量,却可以根据其生长曲线分析存活菌株的增殖水平,进而判断该菌株的紫外线耐受性。两种方法都能获得菌株的耐受性,其结果也存在一定的互补性。本研究结果显示,传统平板分离法检测嗜线虫沙雷氏菌C7-1在紫外线照射下存活率要远低于解淀粉芽胞杆菌20-10,说明菌株C7-1对紫外线更敏感,但这种敏感性在菌株的增殖速度上并没有相应的体现。酶标仪分光光度法检测到菌株C7-1即使经紫外线照射后,其菌株增殖速度和水平也依然高于菌株20-10,这可能是因为菌株C7-1的生长速度本来就比菌株20-10快,虽然经过紫外线照射后的生长速度低于未经紫外线照射的对照,但相对于生长速度较低的菌株20-10,其生长速度依然较高,故其在相同时间的OD值也就比菌株20-10要高。两种方法除了在结果上表现出一定的差异外,在操作上的差异更大。传统平板分离法工作量大、耗时长,且经常会因为对初始活菌体密度判断不准,导致稀释梯度不合理,稀释平板菌落数过高或过低,而需要重做,后者操作简便、快速,且受初始活菌体密度影响小,即便初始活菌体密度很低,也仅影响生长曲线的延滞期,通过延长检测时间即可解决问题并获得理想的生长曲线。同时,因为酶标仪分光光度法操作简便,可通过增加平行,在数据分析时去掉人为因素导致的偏差较大的数据,即可减少平行间的误差,使结果更准确,平板分离法因为操作较复杂,很难再通过增加平行来减少人为误差。因此,若只需分析微生物在不同环境下的耐受水平,则可选择操作简便快速的酶标仪分光光度法,若需要获得微生物在不同环境下的存活量,则可采用传统平板分离法,若为田间应用参考,则可结合两种方法进行评估。
在采用酶标仪分光光度法进行微生物耐性分析时,需要批量培养微生物。本研究采用96孔细胞培养板批量培养不同处理的微生物。为了避免不同样品在高速振荡下产生孔间交叉感染,采用无菌封口膜对每个孔进行封口。但无菌封口膜的使用同样限制了每个小孔中的供氧量,使得好氧菌在培养4~8 h后即进入稳定期或衰亡期。因此,96孔培养板获得的微生物生长曲线与摇瓶培养状态下的微生物生长曲线不一致,对数期时间变短,且稳定期、衰亡期时间提前。这种情况可通过不加封口膜进行缓解。本研究尝试采用96孔板,但不使用封口膜进行菌株20-10和C7-1在不同盐浓度下的培养,发现两株细菌500 r/min培养8 h,平行间标准差基本都保持在10%以下,未见明显的相互污染现象,且由于培养过程未密封,保持自然供氧,菌株的对数期延长,生长曲线更趋向于摇瓶状态下的生长情况(结果未显示)。但无论封口与否,从两株细菌的生长曲线反映其对盐的耐受水平是一致的。
此外,本研究分析了酶标仪分光光度法在检测微生物对pH和盐的耐受水平中的适用性,发现该方法能很好地检测细菌对不同pH和盐浓度的耐受水平,但在进行链霉菌盐耐受试验时,其结果不如细菌理想:生长曲线不如细菌一样呈现典型的S型,且标准误差较大。这可能是因为链霉菌在液体培养后期菌丝体易成团,菌体密度与OD值之间很难呈现线性关系,使得平行间误差较大,且链霉菌孢子悬浮液即便添加吐温-80作分散剂,但其在液体中的分散性依然不如细菌,且接种量少,接种引起的人为和仪器误差较大。因此,该方法虽然能用于链霉菌对不同环境耐受性的检测,但仅限于对链霉菌培养早期生长状态的监测。
总之,直接采用96孔培养板对微生物进行批量培养,结合酶标仪对不同时间的96孔培养板进行吸光度测定,可以在短时间内检测大量菌株的生长性能、增殖活力、生长速率等指标。该方法相对传统平板分离法,减少了大量样本的稀释、涂布和计数,相对于摇瓶培养微生物再进行光密度检测法,减少了多个摇瓶的接种和频繁取样,大大缩减了工作量,且能获得同样准确的结果,对于研究微生物在不同环境因子中的耐受水平、优势菌株的诱变选育、微生物菌株的抗性筛选及活性分析等均是非常快速且有效的方法,具有广泛的适用性,是高通量操作的好帮手。