硅对不同抗性高羊茅耐盐性的影响
刘慧霞,林丽果,武文莉,林选栋,宋锐
(西北民族大学生命科学与工程学院, 甘肃 兰州 730030)
多年生禾本科高羊茅(Festucaarundinacea)是我国北方地区人工草地种植和天然草地补播的优良草种之一[1],其须根发达,植株强健,产量高,草质优,在提高载畜量和发挥生态功能中起着重要的作用。然而我国北方地区大多属于干旱半干旱区,灌溉是维护人工草地健康生长的核心策略[2]。长期多频次的灌溉,往往会在土壤蒸发和牧草蒸腾作用的驱动下,促使土壤深层盐分向表层聚集,导致土壤表层盐分逐渐积累[3],从而影响高羊茅牧草的生存、生长和繁殖[4]。低盐浓度下高羊茅可通过调节自身生理机制提高其耐盐性,高盐浓度会对高羊茅造成离子毒害和渗透胁迫,导致高羊茅生长异常、甚至枯竭或死亡[5]。施肥能够增强植物的耐盐性[6],而环境友好型元素硅,不仅能增强植物的耐盐性,还能提高作物产量、改善品质[7],致使添加硅元素提高植物耐盐性成为目前研究的热点。研究表明,添加硅能够提高盐胁迫下小麦(Triticumaestivum)[8]、黄瓜(Cucumissativus)[9]、玉米(Zeamays)[10]等植物的耐盐性。其主要原因是硅提高了植物超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等保护酶的活性。而且硅对植物耐盐性的影响随盐浓度、植物种类以及品种的不同而存在分异[11-13]。
硅是否对不同抗性的高羊茅品种具有相同的积极效应以及盐浓度、高羊茅品种、硅三者之间是否存在相关性仍需要科学试验提供证据。本研究以两种耐盐性不同的高羊茅品种为对象,采用盆栽试验研究了硅对不同盐浓度下两个抗盐性不同的高羊茅品种生物学特性和保护酶活性的影响,以期为我国北方干旱与半干旱地区高羊茅牧草的引种、耐盐品种的选育和高羊茅草地的管理提供科学依据。
1 材料与方法
1.1 试验设计
采用盆栽试验,三因素处理,分别为不同抗盐性的高羊茅品种XD(抗性较强)和K31(抗性较弱)(种子来源于北京百绿集团)、不同盐浓度和加硅与否。试验用盐为氯化钠,盐浓度设置为0、50、100、150、200、250、300、400 mmol·L-1,硅源用硅酸钠,浓度为2 mmol·L-1[14],计算盐分浓度时包括硅酸钠和氯化钠内的钠离子。每个盐浓度下设置添加硅(+Si)和不添加硅(-Si)两个处理,共32个处理,每个处理8个重复。试验于2015年5月在兰州大学人工智能温室内进行,采用高15 cm,口径20 cm的塑料盆,基质为珍珠岩和蛭石(体积比为1∶1)的混合物,每个花盆内播种饱满的高羊茅种子300粒,播种后用Hoagland营养液中添加相应浓度的硅酸钠和氯化钠溶液浇灌至盆底有液体渗出为止,从播种开始隔日浇灌。为避免盐激作用对高羊茅种子萌发的影响,盐浓度≤100 mmol·L-1的处理液,盐浓度每次递增25 mmol·L-1,盐浓度>100 mmol·L-1的处理液,盐浓度每次递增50 mmol·L-1,直至达到最终盐浓度。待高羊茅完全出苗后(高羊茅发芽时间21 d)间苗,每盆留50株长势均匀的幼苗(出苗不足50株的处理后续不再进行其他指标的观测),按前面浇灌方法继续培养至60 d时,各处理取4盆测定高羊茅各形态学指标;其余4盆进行抗氧化酶活性测定。因最终地上生物量干重低于对照50%时在实际生产中无意义[15],因此本研究将终止该处理的后续研究。
1.2 指标测定
1.2.1形态学指标测定 植株分蘖数、叶片数和株高的测定:每盆随机选取10株(如不足10株,全部选择),测定每株高羊茅的分蘖数、叶片数后,用直尺测量自然高度。
叶长、叶宽的测定:每盆中随机选取10株,取其地表往上数第2片功能叶,用CanoScanLiDE 35型叶面积仪测量。
地上生物量和含水量测定:每盆内选取长势均匀的幼苗10株,取地上部分,先称量其总鲜重Wf,后采用常规烘干法[16]测定其总干重Wd。
地上含水量=(Wf-Wd)/Wf×100%。
1.2.2抗氧化酶活性的测定 每盆中任意取功能叶进行SOD、CAT、POD酶活性的测定。其中SOD、CAT活性分别采用NBT法、硫代巴比妥酸滴定法[17],POD活性采用比色法测定[18]。
1.3 数据分析
采用SPSS 19.0 软件进行三因素方差分析,采用LSD法检验不同数据组间的差异显著性,Duncan法进行多重差异性比较,结果用均值±标准差(mean±SD)表示,数据制图采用Excel 2010软件。
2 结果与分析
研究结果表明,在盐浓度≥300 mmol·L-1时,无论添加硅还是不添加硅处理,两个品种的高羊茅每盆出苗率均不到50株,根据研究设计,后序结果中不再涉及。
2.1 三因数方差分析结果
三因素ANOVA分析结果表明,单一因素品种和添加硅对株高、分蘖数、叶长、叶片数、地上含水量、地上生物量、SOD、POD和CAT(表1)均具有显著影响(P<0.05),而对叶宽影响不显著;盐浓度对所有形态指标和保护酶活性均具有显著影响(P<0.05);盐浓度与硅的互作对株高、分蘖数、叶长、SOD、POD和CAT的影响显著(P<0.05);盐浓度与品种的互作对所有形态指标和保护酶活性均影响显著(P<0.05);硅与品种的互作对分蘖数、叶片数、地上含水量、SOD、POD和CAT影响显著(P<0.05);品种、盐浓度、硅处理三者的交互作用对株高、分蘖数、叶长、地上生物量、SOD和CAT影响显著(P<0.05)。

表1 高羊茅形态学指标和保护酶活性的三因数方差分析Table 1 Three-way ANOVA analysis for morphological indexes and protective enzymes activities of tall fescue
2.2 不同盐浓度下硅对两个高羊茅品种形态学指标的影响
2.2.1盐浓度对两个高羊茅品种形态学指标的影响 无论加硅还是不加硅,两个高羊茅品种XD和K31的株高、分蘖数、叶长、叶宽和叶片数(表2)均随盐浓度增加呈降低趋势,其中XD的株高和叶长在盐浓度200 mmol·L-1时显著降低,K31的株高和叶长在盐浓度100 mmol·L-1时显著降低(P<0.05);K31的分蘖数在盐浓度150 mmol·L-1时显著降低(P<0.05);XD的叶宽在盐浓度200 mmol·L-1时显著降低,K31的叶宽在盐浓度150 mmol·L-1时显著降低(P<0.05);K31的叶片数在盐浓度200 mmol·L-1时显著降低(P<0.05)。
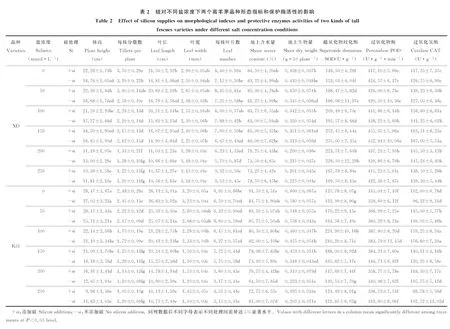
不添加硅时XD的分蘖数在盐浓度50 mmol·L-1时显著降低,叶片数在盐浓度150 mmol·L-1时显著降低,添加硅时XD的分蘖数在盐浓度100~200 mmol·L-1时显著降低,叶片数在盐浓度250 mmol·L-1时显著降低(P<0.05)。说明添加硅能够增强抗性较强品种XD的分蘖能力,增加高羊茅叶片数,为较高盐生境下增加产量提供了可能。
2.2.2硅对两个高羊茅品种形态学指标的影响 硅对XD和K31株高和叶长的影响与盐浓度高低密切相关(表2)。当盐浓度≤100 mmol·L-1时,加硅显著增加了XD株高和叶长(P<0.05),而当盐浓度>100 mmol·L-1时,加硅对XD的株高和叶长无显著影响;当盐浓度≤100 mmol·L-1时,加硅对K31株高和叶长没有显著影响,而当盐浓度150~200 mmol·L-1时,加硅显著增加了K31株高和叶长(P<0.05)。说明加硅能够缓解较高盐浓度对抗性较弱品种K31的盐害,而且硅对高羊茅株高和叶长的影响在不同浓度下具有一定的协同响应。
硅对高羊茅分蘖数和叶片数的影响与品种和盐浓度密切相关(表2)。表现为硅对同一盐浓度下K31分蘖数和叶片数没有显著影响,却对XD分蘖数和叶片数具有显著影响,即当盐浓度≤50 mmol·L-1时,添加硅显著增加了XD分蘖数和叶片数(P<0.05),当盐浓度>50 mmol·L-1时,加硅对XD分蘖数和叶片数无显著影响。说明添加硅能够减轻盐胁迫对抗性较强品种XD细胞分裂与生长的影响,促进高羊茅的生长。
2.3 不同盐浓度下硅对两个高羊茅品种地上含水量和生物量的影响
无论加硅还是不加硅,两个高羊茅品种的地上含水量和生物量(表2)均随盐浓度增加呈降低态势,其中XD地上含水量基本没有变化,XD地上生物量在盐浓度200 mmol·L-1时显著降低,K31地上生物量在盐浓度100 mmol·L-1时显著降低(P<0.05)。不添加硅时,K31地上含水量在盐浓度200 mmol·L-1时显著降低(P<0.05);添加硅时,随盐浓度增加K31地上含水量均没有显著变化,说明加硅能够缓解盐生境下抗性较弱品种K31叶片含水量的降低态势,为植物健康生长提供良好的水分环境。
硅对XD和K31地上含水量和生物量的影响与盐浓度和品种有关。添加硅对同一盐浓度下XD地上含水量影响均不显著,但在盐浓度为200、250 mmol·L-1时显著增加了K31地上含水量(P<0.05),增幅分别为23.64%、19.26%;当盐浓度较低时(≤100 mmol·L-1)添加硅显著增加了XD地上生物量(P<0.05),其中在盐浓度100 mmol·L-1时增量最大,增幅为37.50%;在较高盐浓度(150、200 mmol·L-1)时添加硅显著增加了K31地上生物量(P<0.05),分别增加28.57%、49.91%。说明盐生境下高羊茅生物量对硅的响应存在盐浓度高低的分异,在较高盐浓度下加硅能改善K31的生存环境,缓解盐浓度对其造成的盐害。
2.4 不同盐浓度下硅对两个高羊茅品种的抗氧化酶的影响
2.4.1盐浓度对两个高羊茅品种的保护酶活性的影响 无论加硅还是不加硅,两个高羊茅品种的保护酶(SOD、POD和CAT)活性均随盐浓度增加呈先增加后降低趋势(表2)。XD和K31的保护酶活性达到最大值时的盐浓度分别为150、100 mmol·L-1,与对照相比XD和K31的SOD增幅最大,分别为66.67%、69.36%,CAT的增幅次之,分别为31.76%、62.58%,说明SOD可能是高羊茅响应盐生境的主要保护酶;其中XD的POD活性在盐浓度100、150 mmol·L-1时有显著变化, K31的POD活性在盐浓度≤100 mmol·L-1时有显著变化(P<0.05)。结果说明随着盐分浓度的增加,高羊茅叶片保护酶活性增加,在一定程度上增加了高羊茅的耐盐性,但超过一定范围后,盐分浓度的增加已经破坏了高羊茅叶片的正常生理功能,使保护酶活性受明显的抑制,这种变化趋势与幼苗的生长情况和品种抗盐性强弱基本一致。
不添加硅时,XD的SOD活性在盐浓度≤200 mmol·L-1时有显著变化,K31的SOD活性在盐浓度≤100 mmol·L-1时有显著变化(P<0.05);XD的CAT活性在盐浓度为100、150 mmol·L-1时有显著变化,K31的CAT活性在盐浓度≤150 mmol·L-1时有显著变化(P<0.05)。
添加硅时,随着盐浓度增加XD的SOD活性均有显著变化, K31的SOD活性在盐浓度≤200 mmol·L-1时有显著变化(P<0.05);XD和K31的CAT活性在盐浓度≤100 mmol·L-1时有显著变化(P<0.05)。
2.4.2硅对两个高羊茅品种的保护酶活性的影响 硅对高羊茅SOD、POD和CAT活性的影响不仅与品种密切相关,而且与盐浓度密切相关。当盐浓度较低时,硅显著增加了XD的SOD和CAT活性,而对K31的SOD和CAT活性影响不显著,在较高盐浓度时,硅显著增加了K31的SOD和CAT活性,而对XD的SOD和CAT活性影响不显著,即盐浓度≤100 mmol·L-1时,添加硅显著增加了XD的SOD和CAT活性,在盐浓度100~200 mmol·L-1时,添加硅显著增加了K31的SOD活性,盐浓度150~200 mmol·L-1时,添加硅显著增加了K31的CAT活性(P<0.05);同一盐浓度下添加硅XD的POD影响不显著,对K31的POD影响显著,即当盐浓度150~200 mmol·L-1时添加硅显著增加了K31的POD(P<0.05)。说明较高盐生境下加硅能够有效调节K31保护酶活性,能在一定程度上弥补K31抗性的不足。
3 讨论
3.1 盐生环境中高羊茅形态学指标对硅响应的变化特征
植物形态学特征的变化与水分的吸收和散失密切相关[19],其中生物量是植物响应盐生境的综合体现[20],也是牧草产量和质量的最终反映。大量研究表明,硅通过降低植株体内钠离子毒害、减轻水分胁迫程度、改善养分平衡状况、参与渗透调节物质的运输和分配,提高植物的耐盐性[21-24];同时添加硅能够维持受盐害植物细胞壁水解酶活性的平衡、组分含量的均衡及细胞壁内外溶质的适应性分配,保持植物细胞的旺盛分裂以及调控细胞的向外伸长,提高细胞和组织培养繁殖效果,增强细胞的耐盐性,从而为植物幼苗的健康生长奠定基础[25-26]。然而,硅对植物耐盐性的影响程度与品种自身耐盐性的强弱有关,譬如,加硅能够提高大麦(Hordeumvulgare)的耐盐性,但硅对大麦耐盐品种‘鉴4’盐害的缓解程度显著大于盐敏感品种‘科品7号’[27];加硅能够缓解小麦叶片叶绿素分解而增强光合能力,提高小麦的耐盐性,且硅对抗盐小麦品种‘德抗916’的效应大于非抗盐小麦品种‘泰山9818’[28],同时这也在不同品种的番茄(Solanumlycopersicum)[21]、甜瓜(Cucumismelo)[12]等作物上得到了佐证。本研究表明,供试高羊茅的株高、叶长、叶宽、分蘖数、叶片数、地上部分含水量和生物量的降低程度与盐浓度和品种有关,这与朱义等[4]、麻冬梅等[29]的研究结果类似。添加硅显著增加了高羊茅的株高、叶长、分蘖数、叶片数、地上部分含水量和生物量,这与刘慧霞等[14]的研究结果一致,也趋同于盐胁迫下甜瓜、小麦,金丝小枣(Zizyphusjujuba)对硅的响应[30]。然而,两个高羊茅品种的株高、叶长、分蘖数、叶片数、地上部分含水量和生物量在同一盐浓度下对硅的响应存在分异,说明在较高盐生环境中,添加硅能够减轻抗性较弱品种K31的水分胁迫程度,降低植株的蒸腾,抑制水分散失,从而维持植株的正常长势长相,但硅对抗性较弱品种K31盐害缓解程度大于抗性较强品种XD,其主要原因可能是盐生境下硅对高羊茅体内渗透调节物质以及抗氧化酶活性的响应存在品种分异所致[31]。因此,将硅作为环境友好型元素添加时,不仅要考虑植物种类的响应,还要考虑同一物种不同品种的响应差异。
3.2 硅对高羊茅保护酶活性的响应与盐生环境有关
生物量是植物响应盐生境的外在体现,酶促和非酶促两类酶保护系统是植物适应盐生境的内在机制[5]。盐胁迫下,植物往往主动启动自身保护酶系统,以维持植物体内活性氧产生和清除的动态平衡,减轻其对膜结构和功能的破坏,避免膜透性和钾钠离子选择性吸收的改变,还参与细胞的光合、呼吸、木质素的形成等过程,在叶绿体、线粒体、细胞质中发挥重要作用[32]。但盐浓度过大酶活性的增强不足以弥补盐胁迫对植物体生长造成的伤害,使植株代谢紊乱,生长受抑[33]。研究表明,盐胁迫下添加硅可降低黄瓜叶绿体和线粒体内H2O2和MDA的含量,增加抗氧化酶活性以及抗氧化物质含量,使膜流动性增加,线粒体氧化磷酸化及能量代谢提高,叶绿体活性氧清除能力增强,缓解盐胁迫对植物线粒体和叶绿体膜的伤害[34-35];添加硅能降低盐胁迫下植物体内MDA和H2O2含量及O2-·产生速率,提高SOD、CAT、POD活性,从而保护植株叶片光合机构,改善光合功能,增强植株的耐盐性[21,30,33]。本研究结果表明,XD和K31的保护酶活性对盐浓度响应趋同,但两者酶活性达到峰值时的盐浓度以及SOD和POD达到峰值时的酶活性存在显著差异,说明高羊茅对盐胁迫的自我调节能力具有一定的限度,植物耐盐性的强弱与其保护酶活性密切相关;盐生境下添加硅能显著减缓高羊茅保护酶活性的降低,这趋同于对狼尾属牧草[13]、番茄[21]、玉米[22]等的研究。而且不同品种的高羊茅在同一盐浓度胁迫环境下添加硅减缓酶活性下降的幅度与酶种类存在差异,在较低盐浓度下添加硅能显著增加XD的SOD、CAT活性,而在较高盐浓度下添加硅显著增加K31的SOD、POD和CAT活性,说明不同高羊茅品种的酶活性对盐浓度和硅的响应存在分歧,其响应结果与形态学指标对硅的响应结果基本一致,也说明在较低盐浓度下硅对抗性较弱品种K31的盐害缓解程度小于抗性较强品种XD,而在较高盐浓度下硅对抗性较弱品种K31盐害缓解程度大于抗性较强品种XD。
结果表明,在盐生境条件下,加硅有效调节了高羊茅的保护酶活性,使保护酶具有更强清除自由基的能力,但硅提高高羊茅耐盐性的能力与品种自身的抗盐性密切相关,同时也说明硅参与了高羊茅耐盐性的生理活动,但其参与机制尚需进一步研究。

