病原菌多重耐药与生物膜表型和毒力因子的相关性
张 略, 马 欢
(1.沈阳市第四人民医院 检验科,辽宁 沈阳 110031;2.沈阳市骨科医院 检验科,辽宁 沈阳 110041)
尿路感染是世界上最常见的细菌性疾病之一,每年约有2.5亿人患尿路感染[1],其中导尿管相关尿路感染是最常见的医院获得性尿路感染之一,约有70%~80%尿路感染是由于使用导尿管所致[2]。导尿管相关尿路感染最重要的原因是病原微生物沿导管内外表面形成生物膜,导尿管上生物膜群落的建立被认为是慢性和复发性尿路感染的原因,因为生物膜群落能够绕过宿主防御机制并耐受抗菌药物的治疗[3]。导尿管相关性尿路感染患者的生物膜形成与多药耐药均显著高于社区获得性尿路感染[4],而且一旦生物膜形成会难以去除,进而导致更高的脓毒症和死亡率[5]。目前,关于尿路感染病原菌的耐药性与生物膜和毒力因子的研究较少,已有研究仅局限于伊朗地区[6-8]。本研究对沈阳市第四人民医院导尿管相关尿路感染患者病原菌耐药性进行分析,同时研究多重耐药与生物膜表型和毒力因子的相关性,为多重耐药菌引发尿路感染的治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 研究对象 选取2018年1月至2019年12月于沈阳市第四人民医院住院期间出现导尿管相关尿路感染的156例患者为研究对象。导尿管相关尿路感染满足《导尿管相关尿路感染预防与控制技术指南(试行)》[9]中的诊断标准,主要是指患者留置导尿管后,或者拔除导尿管48 h内发生的泌尿系统感染。
1.1.2 试验菌株 病原菌分离自研究对象的尿液培养标本。质控菌株为金黄色葡萄球菌ATCC29213、大肠埃希菌 ATCC25922、铜绿假单胞菌 ATCC27853、粪肠球菌ATCC29212。菌株分离培养严格按照卫生部《全国临床检验操作规程》进行。
1.1.3 主要试剂与仪器设备 MH琼脂培养基、营养肉汤(NB) 培养基(青岛海博生物有限公司),药敏纸片(英国奥克欧德有限公司)。全自动微生物鉴定仪 (VITEK 2 Compact,法国梅里埃); CO2培养箱(3951,美国热电);盐水分配器(Brand Dispensette,法国梅里埃);浊度计(Plus,法国梅里埃);移液器(89079-962,美国威达优尔);生物安全柜(11228 BBC 86,济南博科);PCR 扩增仪(C1000 TM Thermal Cycle,美国伯乐公司);紫外可见分光光度计(752Pro,上海棱光技术有限公司)。
1.2 方法
1.2.1 菌株鉴定与药敏试验 采用全自动微生物分析仪和纸片扩散法(K-B法)进行菌株鉴定和药敏试验,结果判读参照CLSI 2018年标准。纳入研究的抗菌药种类包括:头孢菌素类、β-内酰胺类/β-内酰胺酶抑制剂复合制剂、喹诺酮类、碳青霉烯类、呋喃妥因、磷霉素。根据药敏结果将大肠埃希菌中耐药菌株分组:对头孢菌素类、β-内酰胺类/β-内酰胺酶抑制剂复合制剂、喹诺酮类、碳青霉烯类抗菌药物产生耐药性大于或等于三个种类的菌株设为多重耐药组;仅对上述四个种类抗菌药物中的一个种类或两个种类产生耐药的菌株设为非多重耐药组。
1.2.2 测定大肠埃希菌生物膜附着力 将大肠埃希菌中耐药菌株接种于营养肉汤中37 ℃培养24 h,取20 μL细胞悬液加至96孔板,加入200 μL营养肉汤37 ℃继续培养24 h,生理盐水洗涤3次除去未黏附细胞。结晶紫染料对黏附细胞染色,去除染料后,洗涤烘干,V醇∶V丙酮溶液=80∶20溶解染料,600 nm波长下读取分光光度值A,设置阴性对照(A0)。根据测量结果分类:(A/A0)≤1.0无附着力;1.0<(A/A0)≤2.0弱附着力;2.0<(A/A0)≤4.0中等附着力;(A/A0)>4.0强附着力。
1.2.3 测定大肠埃希菌毒力因子 利用聚合酶链式反应分别检测多重耐药组和非多重耐药组大肠埃希菌毒力基因。采用煮沸法提取大肠埃希菌DNA,将5 mL大肠埃希菌接种于营养肉汤,37 ℃培养6 h,10 000 r/min离心2 min弃上清,加1 mL 生理盐水震荡,10 000 r/min离心5 min弃上清,于沉淀中加入100 μL蒸馏水震荡后置于100 ℃水浴10 min,10 000 r/mim 离心5 min,上清即为扩增模板DNA。反应体系包括10×PCR buffer 5.0 μL、Taq酶聚合物0.5 μL、dNTP mixture 2.5 μL、上游引物和下游引物各1 μL(引物序列见表1)、ddH2O 34 μL, DNA模板2.0 μL。扩增条件:预变性94 ℃ 5 min→变性94 ℃ 30 s→退火63 ℃ 30 s→延伸72 ℃ 1 min,共30个循环,产物分析采用含0.5 μg/mL 溴乙锭的2%琼脂糖凝胶电泳法,采用凝胶成像系统紫外线下观察结果。观察多重耐药组和非多重耐药组毒力基因表达的差异性,纳入研究的毒力基因包括:第一类,黏附因子类基因:fimH、papG、sfa、afa、iha;第二类,铁载体相关基因:feoB、fyuA、irp-2、iroN、iutA、sitA;第三类,细胞毒素相关基因:hlyD、cnf-1、sat;第四类,保护素相关基因:kspMT、neuA。

表1 毒力基因PCR扩增引物
1.2.4 统计学处理 采用统计学软件SPSS 22.0对研究数据进行分析处理,生物膜阳性率和毒力基因检出率比较采用χ2检验,生物膜附着力等级比较采用秩和检验,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 临床资料统计
共收集导尿管相关尿路感染患者156例,具体资料见表2,其中男女比例45∶111,60岁以上患者103例(66.03%),住院时间超过14 d患者91例(58.33%),留置尿管超过7 d的患者98例(62.82%),入住ICU患者100例(64.10%)以及有糖尿病病史患者121例(77.56%)。伴有危险因素女性、60岁以上、入住ICU、伴有糖尿病的患者以及住院时间、留置天数较长的患者更易尿路感染。

表2 临床资料统计
2.2 病原菌的种类及其分布
156份尿液培养标本中分离出病原菌172株,革兰阴性杆菌140株(81.39%),包括大肠埃希菌(Escherichiacoli)97株(56.4%)、肺炎克雷伯菌(Klebsiellapneumoniae)28株(16.28%)、铜绿假单胞菌(Pseudomonasaeruginosa)6株(3.49%)、奇异变形杆菌(Proteusmirabilis)6株(3.49%),其他3株(1.74%);革兰阳性菌27株(15.70%),包括肠球菌(Enterococcus)15株(8.72%)、无乳链球菌(Streptococcusagalactiae)4株(2.33%)、腐生葡萄球菌(Staphylococcussparophvticus)3株(1.74%)、草绿色链球菌(Viridansstreptococci)3株(1.74%),其他2株(1.16%);真菌仅有5株(2.91%)。病原菌中革兰阴性菌占比较多,其中大肠埃希菌最常见,具体构成见表3。
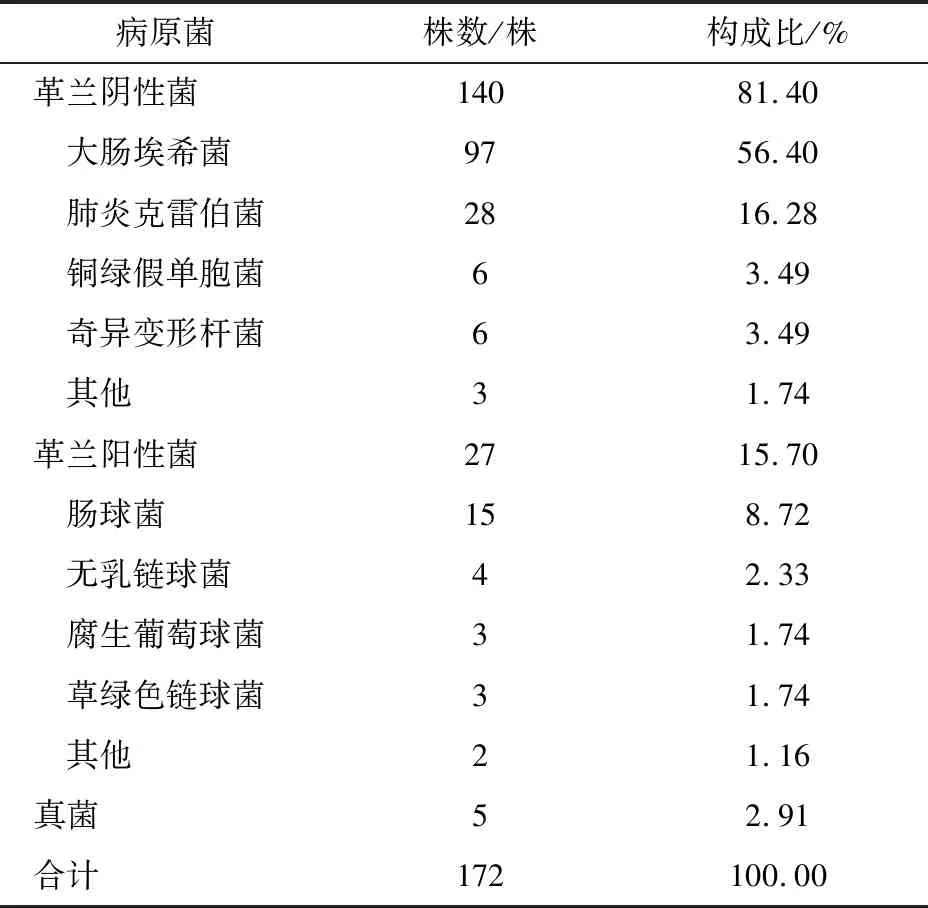
表3 病原菌的种类及分布
2.3 主要病原菌耐药情况
对占比最多的大肠埃希菌进行耐药性分析,统计其对多种抗菌药物的耐药率,结果如表4所示。除氨苄西林和头孢呋辛外,大肠埃希菌总体对抗菌药物的耐药率均低于60%,对磷霉素耐药率为38.14%,呋喃妥因耐药率30.39%,阿莫西林/克拉维酸、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦耐药率均低于30%,美罗培南耐药率最低为5.15%,可以作为常规经验性治疗用药。非多重耐药组对于头孢菌素类耐药率超过60%,但对于β-内酰胺类/β-内酰胺酶抑制剂复合制剂耐药率低于50%,美罗培南耐药率仍最低为11.54%,仍然可以作为严重感染的最后一道防线。多重耐药组对于各类抗菌药物的耐药率均超过60%,成为临床中治疗的难点。

表4 大肠埃希菌对抗菌药的耐药率
2.4 大肠埃希菌多重耐药性与生物膜表型
多重耐药组和非多重耐药组进行生物膜附着力测定,结果如表5所示。大肠埃希菌生物膜实验阳性率为44.78%,其中多重耐药组生物膜实验阳性率为80%,非多重耐药组生物膜实验阳性率为34.62%。多重耐药组与非多重耐药组相比,生物膜阳性率差异有统计学意义(χ2=9.698,P<0.05),附着力强度等级差异也有统计学意义(P<0.05)。多重耐药组更多表现为强附着力生物膜,而非多重耐药组则更多表现为无附着力生物膜。

表5 大肠埃希菌生物膜的附着力等级
2.5 大肠埃希菌多重耐药性与毒力因子
采用PCR 法检测参与大肠埃希菌4种毒力因子(黏附素、保护素、细胞毒素、铁载体)编码的16种基因的表达,结果如图1所示。多重耐药组大肠埃希菌中,黏附素基因fimH(84.44%)和铁载体基因feoB(84.44%)、fyuA(62.22%)、irp-2(75.56%)、iutA(68.89%)、sitA(82.22%)表达较高,均超过了60%。与非多重耐药组相比,多重耐药组大肠埃希菌的黏附素基因fimH、sfa、afa、iha表达差异有统计学意义(χ2=4.685,P<0.05; χ2=9.890,P<0.01;χ2=5.479,P<0.05;χ2=6.084,P<0.05),与大肠埃希菌的多重耐药密切相关。


图1 多重耐药组与非多重耐药组毒力因子表达水平Fig.1 Expression levels of virulence genes in multi-drug resistance group and non-multidrug resistance groupA: 黏附素相关基因表达水平;B: 铁载体相关基因表达水平;C: 细胞毒素相关基因表达水平;D: 保护素相关基因表达水平A: Expression levels of adhesin genes;B: Expression levels of siderophore genes;C: Expression levels of cytotoxin genes;D: Expression levels of protectin genes
3 讨 论
导尿管尿路感染是临床常见的问题,尤其是伴有相关危险因素,如女性曾使用导管插入,有糖尿病基础疾病等,更易引发尿路感染,同时伴随导尿管插入时间、住院时间以及ICU停留时间延长,尿路感染的发病率也会更高[10-12]。本研究尿液培养标本中分离出的病原菌分布与目前已知尿路感染病原菌中革兰阴性菌占大多数,其中大肠埃希菌更常见的细菌学结果是一致的[13-14]。但是多重耐药组和非多重耐药组大肠埃希菌对抗菌药物的耐药率相差很大,其中多重耐药组对于各类抗菌药物耐药率均较高且差别较小,主要与生物膜的产生密切相关[15-16]。生物膜是微生物菌落不可逆地结合在接触物表面,分泌大量细胞外聚合物,包括肽聚糖、纤维蛋白和磷脂等,并将其自身包绕其中形成的膜样物[17]。 这些包裹于生物膜内的细菌与浮游细菌相比会表现出不同的活性[18],对抗菌药的耐药性要高10~1 000倍[19],而且缺乏对抗菌药物的选择性。这正是生物膜耐药区别于其他类型如产β-内酰胺酶耐药的独特之处,也正因为如此,一些难治性尿路感染给予常规抗菌药物治疗效果较差,更换高级别抗菌药物后仍难以治愈。
生物膜对抗菌药物耐药性的增加使得基于生物膜的感染在抗生素治疗的情况下长期持续。形成的细菌生物膜不仅能够帮助病菌抵御宿主的免疫反应,产生更强的毒性,而且有助于其向多重耐药菌株方向进化[20]。本研究中大肠埃希菌多重耐药组生物膜实验阳性率显著高于非多重耐药组,证实了生物膜在尿路感染中的重要作用,并且其对病原菌向多重耐药方向进化很可能也起到一定帮助。生物膜附着力按照强、中、弱分为三个等级,非多重耐药组强附着力占比最少,中附着力占比居中,弱附着力占比最多,这与已知生物膜附着力的研究结果是一致的[21]。但是多重耐药组附着力各等级占比完全不同,强附着力占比最多,且超过50%,而且与非多重耐药组相比,等级之间秩和检验结果也具有统计学差异。这提示生物膜附着力强弱与菌株发生多重耐药存在相关机制,通过对不同生物膜附着力等级的大肠埃希菌做进一步研究,了解生物膜的相关基因和毒力因子,从而打破生物膜耐药机制。
大肠埃希菌在尿上皮细胞中的入侵、生长、增殖和持续存在的能力取决于其形成生物膜的能力以及利用不同毒力因子的能力[22]。黏附素家族中fimH、sfa、afa、iha基因分别编码生成I型菌毛、S 菌毛、Dr黏附素、其他黏附因子,其编码的黏附蛋白及侵袭蛋白可识别特异性受体对宿主进行黏附、侵入,同时产生强生物膜,增强菌株对药物的耐药性以及对宿主免疫攻击的抵抗力。Rosa 研究中提到fimH基因与产生强生物膜的能力密切相关[23]。Tajbakhsh等[21]研究表明,生物膜的产生与fimH、pap、afa和sfa毒力基因显著相关。黏附素基因在多重耐药组中高表达进一步证实了病原菌多重耐药与毒力因子参与生物膜的产生,帮助其形成强黏附力表型密切相关。虽然铁载体相关基因在两组之间没有差异性,但其也参与调节生物膜的形成,且整体表达水平最高。铁载体是铁进入细菌细胞的主要途径,当生物有效铁被细菌细胞吸收后,可以直接调控多种功能代谢物的水平,如L-色氨酸、亚精胺和L-亮氨酸,直接调控生物膜形成[24]。因此,为打破多重耐药菌难治的局限性,未来可以对黏附素和铁载体相关基因开展深入研究,探索出多种手段抑制或破坏这些毒力基因表达,以实现长期有效治疗多重耐药病原菌的目标。
综上所述,导尿管相关尿路感染病原菌的多重耐药与毒力因子参与产生强生物膜表型有关。目前针对生物膜的治疗策略局限于对易形成生物膜的材料表面进行杀菌或预防[25-27]。随着对生物膜毒力因子研究的不断深入,在未来会研发出对毒力因子有特异性抑制作用的新型药物。