诱变选育法夫酵母耐热突变株及基因组变异检测
梁紫涵, 刘诗文, 申镕宾, 刘冰南
(大连工业大学 生物学院,辽宁 大连 116034)
虾青素是天然的抗氧化剂和着色剂,主要存在于微生物、藻类和部分水生动物体内,具有提高机体免疫力,防治多种疾病的作用,在食品、医药和化妆品等领域有广泛的应用[1-2]。法夫酵母(Xanthophyllomycesdendrorhous)是天然虾青素产生菌,其发酵过程不需要光照,培养基条件简单,培养周期短,能够在发酵罐中高密度培养,因此具有工业化生产虾青素的潜力[3-4]。Miao等[5]通过菌株诱变和基因工程改造,获得的法夫酵母工程菌株虾青素产量达到248.6 mg/g。最新研究表明,在10 m3的发酵罐中,经过培养基优化,虾青素产量达到360.3 μg/mL[6]。目前,虾青素产量已基本能够达到工业化需求,但发酵温度低仍是制约法夫酵母工业化生产虾青素的关键因素。通常野生型法夫酵母最适细胞生长和色素合成的温度为17~21 ℃,因此在大部分地区夏季生产成本增加[7]。微生物发酵生产中产生大量的发酵热,生长温度低意味着需要消耗更多的冷却水和能源来维持发酵温度,大规模生产中甚至需要投入制冷设备,大大增加了成本。因此,筛选出法夫酵母耐热菌株对降低虾青素生产成本至关重要。龚玉姣等[8]通过抗霉素A筛选,得到了能在28 ℃生长的法夫酵母突变株。黄晓燕[9]通过原生质体融合技术获得了能在30 ℃下生长的融合菌株,但虾青素产量降低。目前虽然获得了一些法夫酵母耐热菌株,但对法夫酵母的耐热机制还不清楚。本研究通过诱变获得法夫酵母耐热突变株,并对该突变株进行基因组重测序,分析其突变位点,为后续的法夫酵母耐热机制研究提供参考。
1 材料与方法
1.1 材料
1.1.1 试验菌株 法夫酵母(Xanthophyllomycesdendrorhous)CBS6038,购自韦斯特迪克真菌生物多样性研究所。法夫酵母YB25是法夫酵母CBS6938经亚硝基胍(NTG)诱变后,筛选得到的突变株。
1.1.2 培养基 土豆葡萄糖琼脂(PDA)培养基,液体培养时不添加琼脂(PD)。
1.1.3 主要试剂与仪器设备 酵母核酸纯化试剂盒(Takara),NTG,氯化钠,葡萄糖,柠檬酸。三元叠加振荡器(ZWYR-D2403,上海智城分析仪器制造有限公司);高效液相色谱仪(E2695,Waters Corporation);超微量紫外分光光度计(K5800,北京凯奥科技发展有限公司)。
1.2 方法
1.2.1 菌株培养 挑取法夫酵母平板中的单菌落,接种于5 mL PD培养基中,20 ℃,180 r/min培养24 h。取500 μL菌液接种于50 mL PD培养基中,20 ℃,180 r/min培养12 h,菌液经5 000 r/min离心10 min后得到法夫酵母菌体,无菌生理盐水洗涤两次,10 mL柠檬酸缓冲溶液重悬,调整菌液菌数为107个/mL。
1.2.2 NTG诱变 选择不同终浓度的NTG处理法夫酵母细胞,终浓度分别为20、40、60 μg/mL。经生理盐水清洗后重悬,稀释菌液浓度至103个/mL,分别取100 μL菌液涂布于PDA平板,以未经NTG处理的法夫酵母细胞作为对照组,20 ℃培养5 d,计算致死率。取一定量的上述菌液于50 mL离心管中,加入NTG溶液,使菌液NTG终浓度为20 μg/mL,不断振荡10 min后,10 000 r/min离心4 min,弃上清。加入1 mL生理盐水重悬上述实验所得菌体,取100 μL涂布于PDA平板,倒置于25 ℃培养箱中培养,筛选出红色菌落。将已筛选出的红色菌落,接种于新鲜PD培养基中,25 ℃,180 r/min培养96 h,测定该诱变菌株虾青素含量。经过5次传代培养,测定该诱变菌株每一代菌体的虾青素合成量,以此鉴定该诱变菌株能否在25 ℃条件下稳定生长并生产虾青素。虾青素含量测定方法参考文献[10]。
1.2.3 诱变菌株法夫酵母YB25全基因组重测序 首先提取法夫酵母YB25基因组DNA(酵母核酸纯化试剂盒,Takara),并用超微量紫外分光光度计检测DNA的浓度,然后将样品送至北京诺禾致源科技股份有限公司建库测序。
1.2.4 数据分析 参考基因组选择法夫酵母基因组(https://www.ncbi.nlm.nih.gov/genome/43947?genome_assembly_id=995437),测序数据经过质控去除有接头、无法确定碱基含量超过10%以及低质量的数据后,使用BWA软件与参考基因组进行比对,获得单核苷酸多态性(SNP)、长度小于50 bp的小片段插入与缺失(InDel)、结构变异(SV)和拷贝数变异(CNV)等信息,具体分析软件和方法参考周梦琳等[11]的方法,简述如下。应用SAMTOOLS软件检测SNP和InDel;利用BreakDancer软件进行SV检测;通过CNVnator软件进行CNV检测。所有变异检测后,使用ANNOVAR进行变异注释。
2 结果与分析
2.1 诱变筛选耐热突变株
2.1.1 最适NTG诱变浓度 诱变过程中,需保持一定NTG浓度以达到需要的致死率和突变率。本研究发现,NTG终浓度在40 μg/mL和60 μg/mL时处理法夫酵母,致死率高达99.24%和99.87%,而NTG终浓度在20 μg/mL时,处理法夫酵母的致死率为80.7%。因此,选择20 μg/mL NTG作为诱变条件。
2.1.2 诱变菌株的筛选及遗传稳定性验证 经过大量诱变和筛选,获得一株能够在25 ℃条件下生长并合成虾青素的菌株(图1)。结果表明,经过五代培养,每一代诱变菌株合成虾青素的能力未发生变化。表明该诱变菌株在25 ℃培养条件下,能够稳定生长并合成虾青素,将该菌株命名为法夫酵母YB25。

图1 诱变菌株各代菌体虾青素含量Fig.1 Astaxanthin content in different generations of mutagenized strain
2.2 法夫酵母YB25发酵特性
如图2所示,菌株YB25在25 ℃条件下培养54 h时,OD600值达到41.76,然后菌体生长进入稳定期,直至培养到96 h,OD600值无显著性变化。
培养72 h时,菌株YB25虾青素产量达到182 μg/g细胞干重(DCW),与野生型法夫酵母发酵84 h的虾青素产量相当(184 μg/g DCW)。培养120 h时,虾青素产量达到237.19 μg/g DCW,考虑到时间的延长将提高培养成本,所以培养截止至120 h。
与法夫酵母CBS6938 20 ℃培养相比,菌株YB25在发酵初期(0~24 h)生长较为缓慢,这是因为培养温度提高,菌体的生长需要一定的适应过程。菌株YB25在24~54 h发酵时间段,菌体生长进入对数期,生长速度快。生成相同含量的虾青素(184 μg/g DCW),菌株YB25比野生型法夫酵母发酵所用时间缩短了12 h,表明菌株YB25与野生型法夫酵母相比减少了培养时间,从而降低了生产成本。培养到120 h,虾青素最大合成量提高了29%。
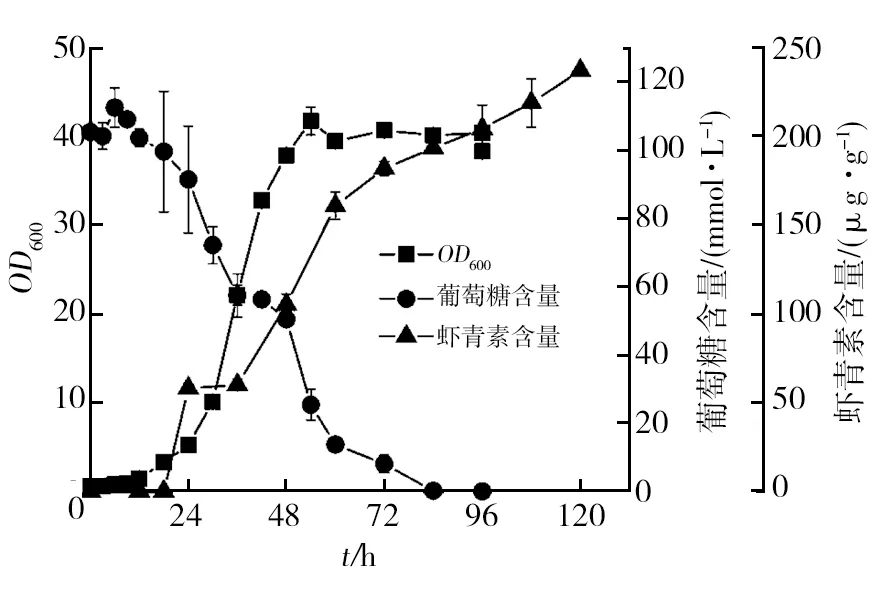
图2 菌株YB25发酵动力学曲线Fig.2 YB25 fermentation curve
2.3 法夫酵母YB25基因组重测序
2.3.1 数据质量控制 提取后的菌株YB25基因组DNA,经过浓度纯度检测,文库构建,上机进行Illumina HiSeq测序,在数据比对之前过滤筛选了原始数据,控制数据的质量(表1)。如表1所示,经过去除接头和低质量数据等,最终得到的clean reads占总数据的99.31%。进行数据质量控制之后,可以保证后续与法夫酵母基因组进行比对的数据质量更高,从而保证后续比对分析结果的准确性。

表1 原始数据过滤结果
2.3.2 SNP检测 通过与法夫酵母野生菌株基因组的比对发现,菌株YB25发生碱基转换435个,碱基颠换191个,杂合率为0.030‰,SNP位点总数为626个,49个变异位于外显子区域,85个非同义突变。通过分析法夫酵母合成虾青素代谢通路上关键基因的碱基突变情况,发现在虾青素合成酶基因crtS上一个G转换为A,该碱基突变导致菌株YB25虾青素合成酶上第401位氨基酸由天冬氨酸变成天冬酰胺,推测这一变化可能是诱变菌株能够高产虾青素的原因。另外,乙酰辅酶A羧化酶基因1 393位的A突变为C,使得乙酰辅酶A羧化酶第465位蛋氨酸突变为亮氨酸。Δ9脂肪酸去饱和酶基因中第38位的T突变为C,使Δ9脂肪酸去饱和酶第13位异亮氨酸突变为苏氨酸;第199位A突变为G,使第67位赖氨酸突变为谷氨酸;第295位T突变为C,使第99位丝氨酸突变脯氨酸。
2.3.3 InDel检测 通过与法夫酵母野生菌株基因组的比对,利用软件对所得结果进行分析,菌株YB25中发生小片段的插入和缺失序列共184个,InDel杂合率为0.009‰。有7个变异位于外显子,其中有2个片段的缺失导致该基因阅读框改变,有4个片段缺失和1个片段插入导致所编码氨基酸的缺失或插入,但是并未改变基因阅读框。这些变异中,二酰甘油酰基转移酶基因的1 127~1 135发生非移码缺失,使二酰甘油酰基转移酶第376~379位氨基酸缺失。
2.3.4 SV检测 通过与法夫酵母野生型菌株基因组的比对,利用软件对所得结果进行分析。菌株YB25中发生大片段的插入、缺失、倒置、易位等现象共703个,其中60个变异位于外显子区域,36个变异位于内含子区域,8个变异位于基因间区。结构变异对法夫酵母基因组产生较大影响,特别是变异位于编码区时,会导致蛋白质序列和结构的改变,从而影响该蛋白质的功能。但SV也可能是基因多样性的来源,从而赋予生物新的功能。
2.3.5 CNV检测 通过与法夫酵母野生型菌株基因组的比对,利用软件对所得结果进行分析。菌株YB25中发生基因组片段拷贝数增加或减少的现象共293个,其中78个变异位于外显子区域,28个变异位于内含子区域,58个变异位于基因间区。拷贝数增加40个,减少253个。
2.3.6 基因组结构变异可视化 为了形象化展示法夫酵母YB25基因组中的结构变异,绘制了Circos 分布图(图3)。由于基因组数据庞大且复杂,通过可视化,可以直观地展示法夫酵母YB25基因组上的SNP、InDel、SV和CNV等结构变异,更好地进行差异比较。
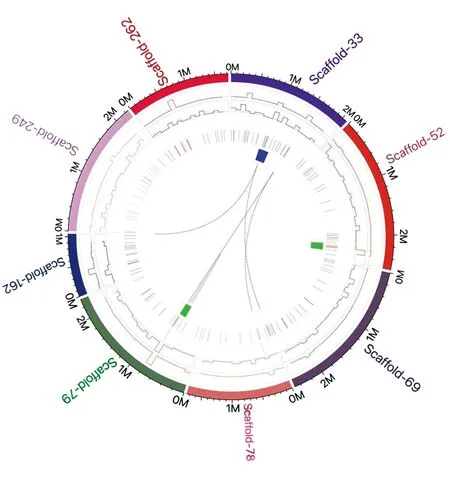
图3 法夫酵母YB25基因组结构变异分布Fig.3 Distribution of genome structure variation由外到内依次为染色体、SNP、InDel、CNV 增加、CNV 减少、SV插入、SV缺失、SV 倒位、SV染色体内部重排、SV 染色体间重排From the outside to the inside in order: chromosome, SNP, InDel, the increase of CNV, the decrease of CNV, SV insertion, SV deletion, SV inversion, chromosome internal rearrangement, chromosome rearrangement
3 讨 论
NTG是重要的化学诱变剂,具有诱变效率高等特点,其诱变机理清楚,已经广泛应用于微生物遗传育种等技术中[12]。NTG剂量会导致致死率和突变效率的差异,有研究表明致死率达到80%左右时,菌株诱变效果较好[13]。本研究通过NTG诱变筛选,获得了能在25 ℃发酵生产虾青素的法夫酵母突变株YB25,其虾青素产量比野生型菌株提高29%。其他一些研究也获得了耐热菌株,一般能在25 ℃下生长并合成虾青素,例如,通过细胞融合,获得最适生长温度为25 ℃并合成虾青素的融合菌,但其虾青素产量与法夫酵母亲株NT221比较下降了64.4%[14]。Miao等[15]使用60Co与NTG配合诱变,获得25 ℃生长并高产虾青素的法夫酵母菌株。本研究获得的法夫酵母YB25可以作为后续代谢工程改造的底盘细胞,为实现虾青素的高产提供参考。
为了解法夫酵母YB25在基因组水平上产生了哪些变异,本研究通过基因组重测序,获得了突变菌株法夫酵母YB25的遗传图谱和基因组结构变异结果。基因组重测序技术能够为遗传性状的进化机制提供重要的数据支持[16]。SNP、InDel、SV和CNV等变异使菌株YB25的基因组与野生型菌株相比发生了显著变化。在众多的结构变异中发现,多个与脂代谢相关基因发生突变,包括乙酰辅酶A羧化酶基因、Δ9脂肪酸去饱和酶基因和二酰甘油酰基转移酶基因。有研究表明,脂肪酸的饱和程度会影响菌株的热稳定性,不饱和/饱和脂肪酸比率对菌株长期的热耐受性是至关重要的[17]。通过对酿酒酵母中4 792个基因进行耐热基因高通量筛选发现,只有乙酰辅酶A羧化酶基因缺失对酵母的耐热性有中度影响[18]。由此推测法夫酵母的耐热性可能与脂代谢相关。另外,虾青素合成酶基因的突变可能与法夫酵母YB25的虾青素产量提高有关,该酶催化β胡萝卜素合成虾青素,其过表达有利于虾青素的生产。