利用合成气生产生物基醇类化学品的研究进展
邓立康, 刘佳昕, 刘晓峰, 吴又多, 程 驰, 薛 闯*
(1.国投生物能源(铁岭)有限公司,辽宁 铁岭 112700;2.大连理工大学 生物工程学院,辽宁 大连 116024)
化石燃料的持续使用引起了空气中CO2浓度持续增加等一系列的环境问题,严重危害到全球的气候。因此,寻找和开发绿色、清洁、低碳、环保的可再生能源迫在眉睫。习近平主席在第七十五届联合国大会一般性辩论上提出,中国“力争于2030年前实现碳达峰,努力争取2060年前实现碳中和”的目标,对能源转型提出了迫切的要求。以生物乙醇、丁醇和己醇为代表的液体生物燃料,作为可再生能源及重要的生物基化学品,具有广泛的应用前景。到目前为止,生物乙醇是全球交通运输中使用最广泛的生物燃料。丁醇是继燃料乙醇之后又一个备受瞩目的可再生生物燃料,其与汽油热值相近(丁醇 29.2 MJ/L,汽油32 MJ/L)[1],使其成为潜在的优良的生物替代能源之一;丁醇在食品领域被广泛用作溶剂,是有机合成的重要前体;己醇是一种高附加值中链醇,因其具有高能量密度、低水溶性和低挥发性等特点可与汽油混合作为燃料使用,近些年也越来越受到研究人员的广泛关注,在医药化工领域,己醇也是许多产品的重要前体原料[2]。生物炼制是近年来生产大宗化工产品的首选绿色可持续工艺。利用生物法生产乙醇、丁醇、己醇等生物基醇类化学品,其反应条件温和可控,有害副产物远低于化学合成[3],有助于推动能源转型和碳中和目标实现。合成气是一种供化学合成用的原料气,以CO2、CO和H2为主要组分。其原料来源广泛,既可由化石燃料煤或焦炭等固体燃料气化产生,也可由农林废弃物等生物质通过气化产生。以农林废弃物等生物质为原料生产合成气进行醇类发酵的一般过程:首先将农林废弃物气化转化为以CO2、CO和H2为主要组分的合成气,再通过化学催化和微生物发酵将合成气转化为燃料乙醇等液体燃料以及其他生物基醇类化合物和精细化学品等。相较于传统的生物炼制工艺,以农林生物质、市政废弃物为初始原料的合成气进行乙醇发酵不仅可以避开与粮食供应的竞争,而且还有效避开纤维原料酸、酶水解的技术障碍,并且克服了传统生物转化过程中木质素不能被有效利用的缺陷,避免了糖酵解途径中CO2的释放,有效提高了碳原子的利用率,降低了原料成本,减少了发酵过程的CO2排放。与化学催化合成法相比,合成气发酵具有反应条件温和,产物得率高,副产物少,对CO和H2比例要求不严格,以及对硫化物耐受性高等优点[4]。此外,气化过程可将原料中所有组分转化为以CO2、CO和H2为主要组分的合成气,可消除原料之间的化学差异性,一些有毒或难降解的有机物也可通过气化、发酵等过程,转化为乙醇和其他有用化学品[4]。目前虽然基于合成气转化的生物基醇类化学品已实现商业化生产,但是其产物浓度及生产强度不高,设备及生产过程成本较高,市场占有率还很低[5]。本文针对利用合成气生产生物基醇类化学品的研究现状,从代谢途径、菌株改造、发酵过程、合成气成分气液传质几方面入手,讨论了合成气利用及醇类产物合成的研究现状,并探讨了存在的问题及未来的研究方向。
1 Wood-Ljungdahl途径与产乙酸菌的能量节约机制
1.1 产乙酸菌的Wood-Ljungdahl途径
产乙酸菌(Acetogen),即可以通过Wood-Ljungdahl途径(也称为还原性乙酰辅酶A途径,Reductive Acetyl-CoA Pathway)作为主要能量代谢机制,利用CO2合成乙酰辅酶A的严格厌氧菌[6]。在Wood-Ljungdahl途径中,细胞利用还原力(H2, NAD(P)H, FdH2)将CO2还原成乙酰辅酶A(图1)。Wood-Ljungdahl途径可以分为甲基分支(Methyl Branch,也称为Eastern Branch)和羰基分支(Carbonyl Branch,也称为Western Branch)。在甲基分支中,CO2首先在甲酸脱氢酶(Formate Dehydrogenase, FDH)的作用下转化为甲酸,然后在甲酰四氢呋喃合酶(Formyl-THF Synthase, FTHFS)、甲酰四氢呋喃环化水解酶(Formyl-THF Cyclohydrolase, FTC)、亚甲基四氢呋喃脱氢酶(Methylene-THF Dehydrogenase, MTDH)、亚甲基四氢呋喃还原酶(Methylene-THF Reductase, MTHFR)和转甲基酶(Methyltransferase, MTF)的依次作用下,生成甲基-钴铁硫蛋白(Methyl-CoFeSP)。在羰基分支中,CO2在一氧化碳脱氢酶(CO Dehydrogenase, CODH)的作用下转化为CO。甲基分支的产物甲基-钴铁硫蛋白与羰基分支的产物CO(或来自于合成气的CO)在一氧化碳脱氢酶/乙酰辅酶A合酶(Acetyl-CoA synthase, ACS)复合体(CODH/ACS)的催化下,生成乙酰辅酶A[7]。乙酰辅酶A可以在磷酸转乙酰酶(Phosphotransacetylase, PTA)以及乙酸激酶(Acetate Kinase, ACK)的催化下进一步生成乙酸,或在醛/醇脱氢酶(Aldehyde/Alcohol Dehydrogenase, AdhE2)的作用下生成乙醇。乙酸也可以在醛:铁氧还蛋白氧化还原酶(Aldehyde:ferredoxin Oxidoreductase, AOR)及醇脱氢酶(ADH)或AdhE2的催化下转化为乙醇。乙酰辅酶A进行碳链延长可生成丁酰辅酶A、己酰辅酶A,继而生成丁酸、丁醇、己酸、己醇等。合成醇类生物基化学品常用的产乙酸菌包括可以合成乙醇的杨氏梭菌(Clostridiumljungdahlii)、自产乙醇梭菌(Clostridiumautoethanogenum)以及可以合成乙醇、丁醇、己醇的食一氧化碳梭菌(Clostridiumcarboxidivorans)、克鲁维梭菌(Clostridiumkluyveri)、ClostridiumragsdaleiP11等。
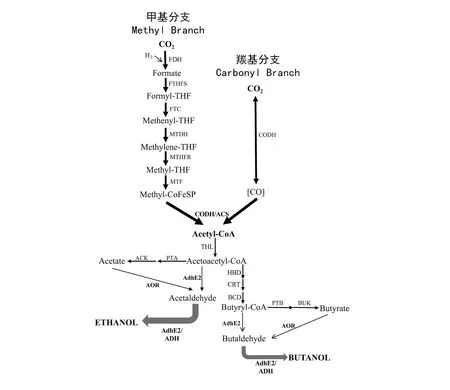
图1 Wood-Ljungdahl途径及其下游的乙醇、丁醇合成途径Fig.1 The Wood-Ljungdahl pathway and ethanol and butanol synthesis pathwaysFDH: formate dehydrogenase(甲酸脱氢酶); FTHFS: formyl-THF synthase(甲酰四氢呋喃合酶); FTC: formyl-THF cyclohydrolase(甲酰四氢呋喃环水解酶); MTDH: methylene-THF dehydrogenase(亚甲基四氢呋喃脱氢酶); MTHFR: methylene-THF reductase(亚甲基四氢呋喃还原酶); MTF: methyltransferase(转甲基酶); CODH: CO dehydrogenase(一氧化碳脱氢酶); ACS: acetyl-CoA synthase(乙酰辅酶A合酶); PTA: phosphotransacetylase(磷酸乙酰转移酶); ACK: acetate kinase(乙酸激酶); PTB: phosphotransbutyrylase(磷酸丁酰转移酶); BUK: butyrate kinase(丁酸激酶); AdhE2: aldehyde/alcohol dehydrogenase(醛/醇脱氢酶); AOR: aldehyde:ferredoxin oxidoreductase(醛:铁氧还蛋白氧化还原酶); ADH: alcohol dehydrogenase(醇脱氢酶); HBD: hydroxybutyryl-CoA dehydrogenase(羟基丁酰辅酶A脱氢酶); CRT: crotonase(烯酰水合酶); BCD: butyryl-CoA dehydrogenase(丁酰辅酶A脱氢酶)
1.2 产乙酸菌的能量节约机制
在Wood-Ljungdahl途径的甲基分支中,每还原1 mol CO2,需要消耗1 mol ATP。在乙酰辅酶A或丁酰辅酶A合成乙酸或丁酸的过程中,每生成1 mol乙酸或丁酸,可以生成1 mol ATP;乙酰辅酶A或丁酰辅酶A生成乙醇或丁醇的过程中没有ATP生成。因此,若产乙酸菌只能通过底物磷酸化合成ATP,则每固定CO2生成1 mol乙酸,ATP净产量为0;每生成1 mol乙醇,ATP净产量为-1 mol。为了保证细胞在生成醇类产物时能够产生足量的ATP,产乙酸菌进化出了特别的能量节约机制,一方面利用基于黄素的电子歧化(Flavin-based Electron Bifurcation, FBEB),将电子传递过程中的放热与吸热氧化还原反应偶联[8];另一方面将放热反应(在产乙酸菌中通常是电子传递反应)与质子的跨膜传递偶联,并利用跨膜质子(H+)或钠离子(Na+)浓度梯度产生ATP[9]。研究发现,综合考虑到产乙酸菌通过底物磷酸化、电子歧化及跨膜质子或梯度产生的ATP,在野生型自产乙醇梭菌中,生成1 mol乙酸的净ATP产量为1 mol,生成1分子乙醇的净ATP产量为0.5 mol(乙醇由乙酰辅酶A在AdhE2催化下生成)或1.2 mol(乙醇由乙酰辅酶A在PTA、ACK、AOR、ADH的依次催化下生成)[10]。目前只有少数产乙酸菌的能量节约机制被深入研究,主要包括杨氏梭菌、醋酸杆菌(Acetobacteriumwoodii)、热醋酸莫氏菌(Moorellathermoacetica)、自产乙醇梭菌等[9]。产乙酸菌的能量节约机制可以根据形成跨膜浓度梯度的离子(H+或Na+)及跨膜离子转移蛋白(Rnf复合物或Ech复合物)分为几类:Rnf复合物驱动质子形成跨膜浓度梯度,Rnf复合物驱动钠离子形成跨膜浓度梯度,以及Ech复合物驱动质子形成跨膜浓度梯度。利用Ech复合物驱动跨膜钠离子浓度梯度的产乙酸菌尚未发现[9]。质子或钠离子形成浓度梯度后,可以由细胞膜上的ATP酶(ATPase)生成ATP。杨氏梭菌可以利用Rnf复合物形成跨膜质子浓度梯度[11]。另外,推测杨氏梭菌中的氢酶(HydABC)或氢酶-甲酸脱氢酶复合物具有电子歧化功能;其MTDH的辅因子为NADH,MTHFR的辅因子仍不能确定[9]。醋酸杆菌则是利用Rnf复合物驱动跨膜钠离子浓度梯度的形成[12],其氢酶具有电子歧化功能,可利用1 mol H2还原0.5 mol NAD+及0.5 mol 铁氧还蛋白(Fd)[13],它的MTDH及MTHFR的辅因子均为NADH[9]。热醋酸莫氏菌利用Ech复合物驱动跨膜质子浓度梯度形成,除了具有电子歧化能力的氢酶外,推测其MTHFR也具有电子歧化能力,而其MTDH消耗的辅因子为NADPH[9,14]。另外,杨氏梭菌与热醋酸莫氏菌中都发现了电子歧化型转氢酶(Electron-bifurcating transhydrogenase, Nfn),可利用1 mol NADH及1 mol 还原型铁氧还蛋白(FdH2)提供的还原力还原2 mol NADP+[9]。尽管产乙酸菌进化出了多种多样的能量节约机制以适应在合成气中的生长,自养生长条件下,供能不足依然是限制细胞生长代谢的重要因素,而醇类产物能量密度较高,与利用合成气生产有机酸相比,生产醇类产物难度较大,需要对发酵菌株及过程进行深入的研究。
2 产乙酸菌的遗传操作工具及代谢改造
2.1 产乙酸菌的遗传操作工具
产乙酸菌大部分为革兰阳性菌,细胞壁较厚,且具有复杂的限制修饰系统,限制了外源DNA的导入效率;另一方面,常用的遗传操作技术如CRISPR/Cas、Red/ET等在产乙酸菌中缺乏深入研究。由于产乙酸菌的遗传转化效率较低、代谢改造工具较匮乏,而开发产乙酸菌的基因操作工具是对其进行代谢改造的先决条件。2013年,Leang等[15]探究了杨氏梭菌中可用的复制子,优化了将质粒通过电转化法导入杨氏梭菌的条件,并通过双交换同源重组(Double-crossover Homologous Recombination)删除了fliA基因(CLJU_c10410,推测为与菌毛形成相关的σ因子)。2016年,Molitor等[16]进一步优化了杨氏梭菌电转化的条件,探究了带有不同复制子(pBP1、pCB102、pWV01ts、pIM13/pIMP1)的质粒通过电转化法导入杨氏梭菌的效率差别,并构建了可以在杨氏梭菌中使用的温敏型质粒。该研究还证明了商用的基于黄素单核苷酸的荧光蛋白(Flavin Mononucleotide-based Fluorescent Proteins, FbFPs)可以在杨氏梭菌中作为荧光报告系统。
近年来,CRISPR/Cas9、位点特异性重组等基因编辑工具也成功应用于产乙酸菌。在杨氏梭菌中分别利用启动子Pthl和PAaraE启动Cas9蛋白和sgRNA的表达,利用CRISPR/Cas9介导pta、adhE1、ctf(编码脂酰辅酶A转移酶Acyl-CoA Transferase)和pyrE(编码乳清酸磷酸核糖转移酶Orotate Phosphoribosyltransferase)基因删除的效率分别达到了100%、>75%、100% 和 >50%[17]。在自产乙醇梭菌中,Cas9蛋白的不受控表达严重降低了转化效率。因此,Nagaraju 等[18]通过筛选和构建四环素诱导型启动子文库,选用合适的诱导型启动子调控Cas9蛋白的表达,实现了该菌利用CRISPR/Cas9介导基因删除的效率>50%。Huang等[19]在杨氏梭菌中构建了基于噬菌体丝氨酸重组酶的位点特异性重组系统,可以将来自丙酮丁醇梭菌的长达8.5 kb的产丁酸途径一次性整合到杨氏梭菌染色体上,实现了大片段DNA的快速整合。在杨氏梭菌中利用四环素阻遏启动子(Tetracycline Repressor Promoter)tetR-Ptet调控dCas9的表达,可以实现CRISPRi介导的pta及aor2基因表达强度的降低[20]。类似地,Fackler等[21]在自产乙醇梭菌中利用四环素诱导型启动子(IPL-12)启动dCas9的表达,成功将CRISPRi系统应用于自产乙醇梭菌,并利用该系统分别降低了2,3丁二醇及异丙醇合成途径基因的表达强度,证明了该系统调控基因表达的效果。除常用的电转化法外,研究人员还尝试通过接合法将质粒导入杨氏梭菌中,并通过诱导来自角蝇(Haematobiairritans)的转移酶Himar1的表达,促进同源重组。研究人员优化了接合条件,包括接合培养基、菌液用量、具有不同甲基化能力的质粒供体菌、质粒的复制蛋白等。作为概念证明,研究人员利用木糖诱导型启动子表达Himar1转移酶,将来自丙酮丁醇梭菌的丙酮合成途径导入杨氏梭菌中[22]。
2.2 产乙酸菌的代谢工程改造
一些研究尝试通过改造产乙酸菌Wood-Ljungdahl途径及溶剂合成途径的相关基因提高其合成醇类产物的能力。野生的杨氏梭菌只能生产乙醇,无法生产丁醇。在杨氏梭菌中表达来自丙酮丁醇梭菌中的丁醇合成途径后,在合成气发酵中丁醇浓度最高达到0.15 g/L,但发酵后期丁醇被转化为丁酸,发酵末期时丁醇质量浓度降低到了<0.015 g/L[11]。通过在自产乙醇梭菌中删除3个编码CODH的基因(acsA、cooS1、cooS2),研究人员发现cooS1和cooS2对于自养生长不是必需的。当菌株在含有H2和CO2的环境下生长时,删除cooS1的菌株甚至表现出比野生菌更短的延滞期和更高的生长速率[23]。同一个课题组[24]在自产乙醇梭菌中删除了2个编码AOR的基因,以及2个编码AdhE2的基因,比较了改造菌株在CO、H2和CO2或果糖作为底物时细胞生长及产物形成的情况,证明了AOR对于自养条件下细胞生长的必要性,并发现敲除adhE可以将乙醇浓度提高180%,将副产物乙酸降低38%。另一项研究在食一氧化碳梭菌中过表达编码AOR、AdhE2和铁氧还蛋白:NAD+还原酶(Ferredoxin:NAD+Oxidoreductase, FNR)的基因。在合成气发酵中,与野生型相比,过表达adhE2的菌株乙醇浓度提高约50%,而同时过表达adhE2和fnr的菌株丁醇与乙醇浓度分别提高约18%和22%,证明了通过过表达同源和异源基因在两种不同途径中增加醇产量的潜力[25]。除了直接改造产乙酸菌外,研究人员还尝试了将Wood-Ljungdahl导入产溶剂梭菌中。在丙酮丁醇梭菌中表达来自于杨氏梭菌的和食一氧化碳梭菌的Wood-Ljungdahl途径后,发现改造菌株可以进行Wood-Ljungdahl途径甲基分支和羰基分支的全部反应;进一步在该菌株中表达CODH/ACS复合体后,发现改造菌表现出了CODH和ACS的活性。但由于ACS或Wood-Ljungdahl途径中其他蛋白的表达量较低,改造菌无法在发酵中将CO2转化为乙酰辅酶A[26-27]。
相比于利用糖基及纤维素类底物生产生物基醇类化学品,目前改造产乙酸菌、提高其利用合成气生产生物基醇类化学品的研究仍需深入。开发更多高效的遗传操作手段,解析其代谢关键酶(如AOR、AdhE2、CODH、FDH等)在自养条件下的表达强度及协同作用,深入探究产乙酸菌能量节约及电子传递的机制,对于构建利用合成气高效合成生物基醇类化学品具有重要的意义。
3 利用合成气生产生物基醇的过程工程调控
3.1 温度
大部分产乙酸菌的最适生长温度均为37 ℃,然而,研究普遍发现,37 ℃并不是最适合产乙酸菌合成生物基醇类的温度。在食一氧化碳梭菌的最适生长温度37 ℃培养该菌时,菌株在对数期的快速生长会造成大量有机酸的快速积累,其中,乙酸的大量积累可能会引起醇类产物合成减少。类似的现象在产溶剂梭菌中也经常出现,被称为“酸崩溃”(Acid Crash)。而在25 ℃时培养食一氧化碳梭菌可以避免酸崩溃,可显著提高醇类产物的浓度。在37 ℃时,菌株利用合成气生产了0.07 g/L乙醇及微量丁醇、己醇,而在25 ℃时产生了1.48 g/L乙醇,1.07 g/L丁醇,以及0.84 g/L 己醇[28]。另一项研究发现低温(25 ℃)促进食一氧化碳梭菌产物的碳链延长[29]。Shen等[30-31]在连续两项研究中考察了温度对食一氧化碳梭菌生物基醇产量的影响,发现培养基成分的优化没有显著提高长链醇的合成,然而两段温度培养方法(37 ℃培养48 h后,25 ℃培养120 h)对于醇类产物,尤其是长链醇(己醇和丁醇)的合成有显著提高,且减少了细胞絮凝。最终醇类产物浓度为6.97 g/L,其中丁醇浓度为1.67 g/L,己醇浓度为1.33 g/L,而在发酵温度为37 ℃时,丁醇和己醇浓度分别为0.45 g/L和0.02 g/L。
多项研究均表明尽管较低的培养温度(25~33 ℃)会降低细胞生长速率,但更有利于醇类产物的合成。醇类产物普遍对细胞具有毒害作用,通过增加细胞膜流动性,引起细胞成分的泄露,常见的醇类产物,对细胞的毒害作用从强到弱排序为己醇>丁醇>乙醇[32]。低温下细胞膜流动性降低,细胞对醇类及有机酸的耐受性增强,且相比于短链醇(乙醇),低温发酵对于丁醇及己醇的合成更为有利。低温对于长链醇合成的优势也与细胞的基因表达水平有关。37 ℃时,Wood-Ljungdahl途径基因的表达较高,促进合成气的利用和细胞生长;但25 ℃提高了酰基缩合反应(Acyl-condensation Reaction)相关基因的表达,更多的碳原子流向C4、C6产物[31]。
3.2 pH
与温度对发酵的影响类似,最适合产乙酸菌生长的pH通常不是最适合产醇的pH。对于食一氧化碳梭菌,较高的培养pH(6.2)有利于细胞生长,但在此条件下细胞只合成有机酸,没有醇类产物生成[33]。另一项研究[34]对比了5.75及4.75两种发酵pH,发现最大的细胞生长速率可以在较高的pH(5.75)条件下获得(0.072 vs. 0.005 7/h),最大的醇类比生产速率可以在较低的pH(4.75)时获得,然而,低pH条件下的醇类浓度却低于高pH下的醇类产物浓度。该研究结果说明,低pH时单位细胞合成醇类产物的能力较强,但持续的低pH培养不利于积累细胞量,导致最终的醇类产物浓度及生产强度较低。
多项研究采取了多阶段pH控制的方式,利用较高的pH促进细胞生长,利用较低的pH促进醇类产物的合成。例如,Richter等[35]采用两阶段pH控制法进行杨氏梭菌的合成气发酵,首先在 1 L 的搅拌釜反应器中将pH控制在5.5左右,该条件有利于菌株生长及乙酸合成;然后在4 L的鼓泡式反应器中进行乙醇生产,该鼓泡式反应器控制较低的pH (4.5~4.7),并带有气体循环装置及细胞循环模块,在保留细胞量的同时,提高气液接触面及气体的停留时间,该研究最终获得了20.7 g/L 乙醇,生产强度达到0.37 g/(L·h)。另一项研究将自产乙醇梭菌发酵在高pH(5.75)与低pH(4.75)之间循环变化[36],获得了7.14 g/L乙醇和1.621 g/L 2,3-丁二醇。类似地,将两个搅拌釜反应器串联,pH分别维持在6(促进细胞生长、产酸)及5(促进产溶剂)进行食一氧化碳梭菌的合成气发酵,最终获得了1.5 g/L醇类产物[37]。利用含有克鲁维梭菌、ClostridiumragsdaleiP11等产乙酸菌的混合菌群进行合成气发酵,发现pH是碳链延长的关键因素,己醇只在培养pH 4.5~5之间才能被合成。在pH 4.8时,C6产物(0.8 g/L)及醇类产物(乙醇1.7 g/L、丁醇1.1 g/L、己醇0.6 g/L)达到最大[38]。
3.3 金属离子
在利用合成气生产生物基化学品的过程中,合成气是唯一的碳源及能量来源,而固定合成气的Wood-Ljungdahl途径中的多种金属酶的活性受到金属离子(如Fe2+、WO2-、Ni2+等)的显著影响,因此,金属离子的成分及浓度对利用合成气生产醇类生物基化学品有显著影响。Saxena等[39]发现,培养基中去除镍后,细胞无法生长。与ATCC (American Type Culture Collection) 1754标准培养基相比,优化镍浓度后的培养基使菌株的生长速率从0.34/d提高到0.49/d,CODH活性及氢化酶(Hydrogenase, H2ase)的特定活性从38.45和0.35 U/mg分别提高到48.5和1.66 U/mg蛋白。在培养基中去除WO4-则使乙醇浓度从35.7 mmol/L降低到1.14 mmol/L,使FDH的活性从45.4 U/mg降低到8.79 U/mg蛋白;相反,采用10倍于ATCC 1754标准培养基的WO4-浓度时,乙醇浓度提高到了72.29 mmol/L。在培养基中添加10倍浓度的Zn2+,可以使乙醇浓度显著提高到187.80 mmol/L,然而CODH, FDH, H2ase和ADH的活性没有受到明显的影响。培养基中去除Fe2+显著降低了CODH、FDH、H2ase和ADH的活性,并使乙醇浓度从35.7 mmol/L降低到6.3 mmol/L。另一项研究利用响应面设计法,系统探究了多种金属离子对于食一氧化碳梭菌合成醇类产物的影响,并确定最优的金属离子浓度(相对于ATCC 1754标准培养基):5倍的Ni2+、Co2+、SeO4-、WO4-;3.48倍的Cu2+;0.55倍的MoO4-;0.5倍的Zn2+与(NH4)2SO4·FeSO4·6H2O;以及额外添加44.32 μmol/L的FeCl3·6H2O。该研究发现,对于醇类产物的浓度,MoO4-表现出最明显的负面影响,猜测原因是钼可以在含钨蛋白的活性位点中取代钨并抑制蛋白获取钨,降低含钨蛋白的活性。Wood-Ljungdahl途径中的关键蛋白FDH,以及有机酸重吸收的关键蛋白AOR中具有含钨的活性位点,造成了钼元素对于醇类产物浓度的负面影响[30]。其他研究也发现镍和铁对于食一氧化碳梭菌在合成气中的生长是必需的,而仅仅55 μg/L的钼就足以对Wood-Ljungdahl途径、丁醇合成及有机酸重吸收途径产生抑制作用[40]。
3.4 有机氮源
有机氮源是影响利用合成气生产生物基醇类化学品的重要因素。Park等[41]探究了几种培养基成分(酵母提取物、微量元素溶液、微生物溶液,以及Na2S·9H2O)对自产乙醇梭菌细胞生长的影响,发现酵母提取物是影响最大的成分。将酵母提取物的质量浓度从0.5 g/L提高到5 g/L,可以使细胞生长提高2.3倍。Abubackar等[42]通过二水平完全要因实验(Two-level Full Factorial Design)发现,对于自产乙醇梭菌利用CO的发酵,将pH从5.75降低到4.75,并将酵母提取物质量浓度从1.6 g/L降低到0.6 g/L,可以使乙醇产量提高200%。基于ATCC 2713培养基成分,优化可得最适于食一氧化碳梭菌细胞生长的培养基成分,含有胰蛋白胨14 g/L ,酵母提取物9 g/L, L-精氨酸1.4 g/L,以及一种最适于该菌合成醇类产物的培养基,含有胰蛋白胨12 g/L,来自明胶的蛋白胨12 g/L,酵母提取物7 g/L,L-精氨酸1.4 g/L,葡萄糖1 g/L。在72 h的合成气发酵中,采用最适合醇类产物合成的培养基,获得了2.28 g/L乙醇及0.74 g/L丁醇[43]。使用来自生物质的廉价有机氮源,可以在不显著影响细胞生长的同时降低培养基的成本。采用0.5 g/L玉米浸出液(Corn Steep Liquor),麦芽提取物(Malt Extract)及蔬菜提取物分别作为自产乙醇梭菌合成气发酵的氮源,细胞的OD600值分别为1.44、1.37、1.71,乙醇质量浓度分别为2.24、3.37、3.76 g/L[44]。采用玉米浆(Corn Syrup)或乳清粉(Whey Powder)代替微量元素及酵母提取物培养杨氏梭菌,发现使用30 g/L乳清粉时乙醇质量浓度最大,达到2.5 g/L[45]。
3.5 硝酸盐

3.6 其他培养基成分
由于产乙酸菌中的AOR蛋白可以在CO或H2的存在下将有机酸转化为相应的醇,在反应体系中添加乙酸可以提高相应醇类产物的产量。在不同的乙酸浓度下,食一氧化碳梭菌中差异表达的基因主要包括显著下调的pta和显著上调的aor、COdh和adh。其中pta是乙酸合成途径的关键基因,而aor、COdh与adh则在乙酸转化为乙醇过程中起到重要的作用[48]。
Kim等[49]尝试在发酵体系中加入不同的纳米粒,发现0.3%(质量分数)的二氧化硅纳米粒在促进气液传递方面表现出最好的效果,使溶解的CO、CO2和H2浓度分别提高了272.9%、200.2%和156.1%,使细胞量提高了34.5%,丁醇浓度提高166.1%。
4 合成气成分及气液传质效率
由于合成气是发酵中唯一的碳源,合成气与液体的传质速率以及合成气的组成对于发酵有着极其重要的影响。然而,不同研究中经常使用不同组成及来源的合成气,并在发酵中采用不同的气体压力,以及传质系数迥异的发酵设备,导致不同研究间的产物浓度难以进行横向比较。从代谢途径上来说,1 mol CO可以比1 mol H2提供更多的还原型铁氧还蛋白,有助于还原性产物的合成;但是实际发酵中,由于不同微生物CODH及H2ase的活性不同,有些菌株在H2含量较高的合成气中反而醇类产物产量更高。例如,Valgepea等[50],将合成气中H2/CO比例从0.4提高到3,自产乙醇梭菌发酵的乙醇通量从25%提高到61%,乙酸通量从27%降低到15%。Jack等[51]探究了H2/CO比例从0.5到2.0范围内杨氏梭菌发酵产物的变化,发现H2/CO比例为2.0时乙酸产量最高,为2.11 g/L;H2/CO比例为0.5时,乙醇产量最高,为0.35 g/L。另一项研究[52]发现,杨氏梭菌在pH为6.0、气压为0.1 MPa时进行发酵,在气体组成为H2/CO2时,主要产物为乙酸;而当采用CO气体时,可以合成乙醇,CODH和AOR在CO利用和乙醇合成中起到重要作用。总之,合成气成分对于发酵产物有重要的影响,然而在不同的培养基、不同的气压等发酵条件下,难以断言合成气中各组分对于产物的影响。
在实际生产中,合成气的成分通常是确定的,因此实际生产中更关键的问题是通过优化发酵装置,提高体积传质系数(Volumetric Mass Transfer Coefficient, kLa)及气液传质效率。Xu等[53]提出可以使用气体采样袋作为自产乙醇梭菌合成气发酵的培养装置。气体采样袋可以在维持密闭的同时提高气液接触面积、提高传质效果,是一种廉价、操作简便的气体培养装置。Shen等[54]设计了单片生物膜反应器(Monolithic Biofilm Reactor, MBR),由于MBR通道中形成了弹状流模式(Slug Flow Pattern),MBR的体积传质系数kLa高于作为对照的鼓泡式反应器(Bubble Column Reactor, BCR)。在合成气流速为300 mL/min,液体流速为500 mL/min,稀释速率为 0.48/d的条件下,MBR中的食一氧化碳梭菌合成了4.89 g/L乙醇,比BCR反应器高52.8%。Shen等[55]进一步开发了中空纤维膜反应器(Hollow Fiber Membrane Reactor, HFM Reactor),在此反应器中体积传质系数进一步提升至1 096.2/h,高于大部分已报道的反应器设计。在HFM反应器中进行食一氧化碳梭菌的合成气发酵,乙醇质量浓度可达23.93 g/L,是目前文献报道的最高浓度。由此可见,提高反应器的传质系数、优化反应器设计,对于提高醇类产物的浓度具有重要意义。
5 展 望
利用合成气生产乙醇、丁醇、己醇等醇类生物基化学品,对于推动能源绿色低碳转型、促进“碳中和”目标的实现具有重要意义。近年来,在产乙酸菌遗传转化工具的开发方面取得了大量进展,也有一些研究尝试了对产乙酸菌进行代谢工程改造。然而,产乙酸菌中的基因编辑效率仍不够高,大部分研究只进行了产乙酸菌中的单基因或双基因敲除,所研究的菌株与基因较为零散,菌株生产能力不能满足工业化要求。为了深入解析产乙酸菌中利用合成气生产醇类产物的关键基因、构建高效利用合成气生产醇类生物基化学品的菌株,需要提高产乙酸菌的基因编辑效率,开发高通量基因编辑手段,利用多组学技术解析产乙酸菌CO2利用、能量节约、产物合成等相关途径的调控机制。另外,可以尝试在模式菌株(如丙酮丁醇梭菌、大肠埃希菌等)中构建合成气利用途径,表达Wood-Ljungdahl途径及能量节约相关基因(如Rnf复合物基因、电子歧化型转氢酶基因等),优化各基因表达强度及辅因子平衡,使模式菌株具备利用合成气的能力。
发酵条件及反应器的优化对于提高醇类生物基化学品的浓度、生产强度与产物选择性十分有效。某些调控手段(如加入大量有机氮源、采用较高的气体压力等)在工业应用中难以实现。未来的过程调控研究应集中于实现低成本、低能耗、较低气压下醇类产物的高效合成。一方面,优化温度、pH及反应器设计是相对而言简单有效、廉价且低能耗的调控方案;此外,应尝试利用廉价培养基成分代替高价成分,降低发酵成本,促进该过程的工业化。