芽胞结构的研究进展
纪 芳,梁 勇
(江汉大学 医学院,湖北 武汉 430056)
在遭遇逆境时,多数细菌都能以某种程度停滞生长,以等待合适条件的来临,最常见的如芽胞杆菌属Bacillus spp.和梭状芽胞杆菌属Clostridi⁃um spp.,其在营养受限的条件下可以产生芽胞。芽胞是一种休眠形式的细胞,能抵抗多种不利条件而存活下来,比如高温、高寒、高压、放射线、营养缺乏、杀菌剂等,少数甚至能耐受外太空的恶劣条件,一些芽胞在历经数百万年以上仍能保持休眠状态。当环境条件改善时,休眠芽胞就会活化、萌发并且脱出外壳,细胞体积迅速增大,形成营养体细胞,紧接着以二分裂的方式进行营养期繁殖。芽胞的高度抗逆性提高了细菌的存活力,但给食品工业带来了麻烦,也是导致患者腹泻的重要原因[1]。
芽胞具有高度的抗逆性,学者们对芽胞的结构和组成有着浓厚的兴趣,开展了大量的研究工作。目前对芽胞的了解主要来自于芽胞杆菌属,笔者对芽胞结构的研究进展进行综述。
1 芽胞的主要结构
芽胞有一些保护性构造,形成一系列同心的壳层,每一层都对芽胞的耐受力起着不可缺少的作用,其结构如图1所示。常以枯草芽胞杆菌Bs(Bacillus.subtilis)为模式菌对芽胞进行研究,其芽胞从内至外可分为芽胞内核、芽胞皮层、芽胞衣3层结构。而很多其他芽胞杆菌特别是蜡状芽胞杆菌Bc(Bacillus.cereus)在芽胞衣外还有一层被称为芽胞外壁的松散泡状结构,如图2[2]所示。

图1 芽胞的结构图

图2 金属投影法扫描电镜观察Bc的芽胞
1.1 芽胞内核
芽胞内核由一层薄膜包裹,里面含有与酸溶性蛋白质结合的DNA、蛋白质、RNA、脂类、核糖体、酶,少量的糖和盐类[3]。内核的含水量很低,只有28%~57%,有助于抵抗高温和化学物质[4],很好地保护了DNA。
1.2 芽胞皮层
芽胞皮层较厚,含黏性复合物。主要成分为肽聚糖,与营养体细胞的肽聚糖相似,但结构松散,肽聚糖的交联程度很低,且不含营养体细胞的多聚糖磷壁酸。皮层维持着芽胞内核的形态,使其保持干燥状态并具耐热性能[5]。
1.3 芽胞衣
芽胞衣是一种紧密覆盖在皮层外的多层次蛋白质结构,其层次数量和表面形态的复杂性依种的不同有明显差异[1]。传统上,Bs的芽胞衣可分为两层:一个染色较深的外层和一个染色较浅的内层。外层由交叉的杆状物组成,内层由六角形的穿孔物组成,孔位于六角形的中央,并常有一等同直径的颗粒状填充物。最近一项精细的研究把Bs的芽胞衣结构根据蛋白的种类分为4层[6]。
芽胞衣的大部分成分是蛋白质,含少量的糖类(6%)。最近一项研究[7]发现,在芽胞杆菌的芽胞衣里还沉积着一层硅元素,可以提高芽胞的抗酸性。硅元素在土壤和水中是天然存在的,这意味着细菌可以自然地摄入硅。当细菌遇到酸性环境时,比如动物的胃液,芽胞中沉积的硅盐层将有助于细菌的存活。
芽胞衣形态学上的复杂性反映了其蛋白质组成的复杂性。目前已经发现了超过70种芽胞衣蛋白[6],学者们对其中一些已做了精细的分析[8-10]。芽胞衣蛋白有可溶性和不可溶型两类,前者大概占70%。不可溶的芽胞衣蛋白多具有二硫键,其他的交联方式包括二酪氨酸的交联和赖氨酸的交联。芽胞衣的化学性质和抗性机制很可能与蛋白质的重度交联有关。组成芽胞衣的蛋白中既有结构蛋白,也有起控制装配作用的蛋白。在实验室条件下研究发现,大多数芽胞衣蛋白对于发挥芽胞衣的屏障功能无关紧要,因为缺失其中任何一个基因都检测不到异常。但是两个关键的蛋白除外,即SpoIVA和CotE。SpoIVA位于芽胞衣和皮层之间,将芽胞衣与芽胞表面相连接,如果没有SpoIVA,芽胞衣可以形成,但不能附着于芽胞。CotE则定位于外芽胞衣和内芽胞衣之间的交界面,它负责整个外芽胞衣以及几个内芽胞衣蛋白的装配。另外有几种蛋白也有介导装配的功能,研究较多的是SpoVID和SafA,它们在芽胞装配的早期发挥一定的作用。研究表明,SpoVID和CotE在芽胞衣的形成过程中直接发生相互作用[11]。在Bs中,对芽胞衣装配起关键作用的蛋白质通常也影响萌发。一项研究[6]结果显示,大多数芽胞衣蛋白在一个主要的与形态发生有关的蛋白质的控制下进行装配。
1.4 芽胞外壁
与Bs不同,Bc和其他一些种在芽胞衣外多了一层芽胞外壁。芽胞外壁不与芽胞衣直接相连,中间被暂名为衣壁空间(interspace)的区域隔开,如图1所示。处于衣壁空间中物质的性质仍然未知。芽胞外壁对芽胞抗性所起的作用还未见报道,它在诸如Bs等一些种中是缺乏的,而这些菌种同样能经受环境压力。可能芽胞外壁在特殊的小生境或生命周期中及非一般性的保护或萌发中发挥一定的作用。因为芽胞研究的模式菌Bs缺乏芽胞外壁,所以对芽胞外壁的研究尤其在分子细节方面相对较薄弱。
Bc的芽胞外壁比较相似,在电子显微镜下观察可分为两层,内层为基质层,外层为着生在基质层上的绒毛样层(如图3[12]所示)。芽胞外壁含有蛋白质、脂类和糖类物质,各占干重的43%~52%、15%~18%以及23%。
如前文所述,因为研究芽胞发育的模式菌Bs没有芽胞外壁,所以对芽胞外壁的研究在分子水平上与芽胞衣相比相对不足。近年来不断发生的恐怖袭击活动,使人们对生物武器有了更多的关注,从而也加强了研究相关细菌及其芽胞的紧迫性。最近的研究主要集中在炭疽芽胞杆菌Ba(Bacillus anthracis)芽胞和哺乳动物免疫系统之间的相互作用和发展更准确快捷的芽胞检测手段。这两方面的研究都需要清楚了解Ba芽胞的最外层即芽胞外壁的分子细节。因为这层囊泡样的芽胞外壁是芽胞直接接触外部环境或宿主细胞的部分。初步分析芽胞外壁至少含有12种不同的蛋白质和糖蛋白[13]。

图3 芽胞外壁结构图
现在已经在Ba芽胞外壁的绒毛层中鉴定出两种糖蛋白:BclA和 BclB[14-15],是主要结构蛋白。BclA在细胞中以糖基化形式存在,且具有一个CLR(collagen-like region,类似胶原蛋白的区域),这两项特征在原核生物的蛋白质中都是罕见的。而另一种绒毛样外层的结构蛋白BclB,也是一种类似胶原蛋白的糖蛋白,与BclA相比含量较少,但对芽胞外壁结构的装配与保持也起重要作用[14]。
芽胞外壁的基质内层也由数种不同蛋白质所组成[13,16]。2005 年 C.T.Steichen 等[13]首先对其中的BxpB进行了深入研究,其结果显示BxpB是基质层的组成蛋白之一,与BclA、潜在的基质层蛋白ExsY及其他几种蛋白质一起组成一个稳定的复合体,并且它对BclA附着到芽胞外壁是必须的,还对芽胞的萌发有一定的抑制。bxpB基因缺失突变株的芽胞外壁虽然失去了绒毛样外层,但基质层的外观没有明显变化,说明是另外几种蛋白质决定了基质层的外观性质。2006年,M.J.Johnson等[17]以 B.cereus为 研 究 对 象 ,J.A.Boydston等[18]以B.anhracis为研究对象,分别发表论文阐述了基质层中的另一种蛋白质ExsY于芽胞外壁形成中所起的作用。两人的研究结果都显示ExsY对于芽胞外壁的正常装配是不可缺少的。如果exsy缺陷,则在液体培养基中产生的芽胞会失去芽胞外壁,在固体培养基中的芽胞仅在一极具有帽子样的芽胞外壁片段。2011年又定位了一种基质层蛋白BetA,也具有类似胶原的结构域,与芽胞外壁的组装有关[19]。
多位学者的研究都显示芽胞外壁不正常或完全缺失的Ba突变株其原有的毒力不受影响,说明芽胞外壁与病原菌的致病性无关,但仍然对芽胞有其他影响,比如导致萌发效率下降等。弄清楚芽胞外壁在芽胞的抗性、致病性以及在环境中的维持能力方面所起的作用是未来研究的一个重要方向。
2 芽胞的其他特殊构造
对芽胞杆菌属中的苏云金芽胞杆菌Bt(Bacil⁃lus.thuringiensis)来说,芽胞的形成是其正常生活周期的一个阶段,而不仅是对不良环境的简单反应[20],其完整生命循环包括营养体细胞和芽胞的交替形成。Bt在芽胞形成的过程中会形成一种特殊成分,称为伴胞晶体,是一类毒杀昆虫的活性物质,能够在昆虫碱性的肠道中溶解致昆虫死亡。由于这类伴胞晶体能高效杀虫且对人畜无毒,现已成为生物农药的主要成分之一。
不同Bt的伴胞晶体在大小、形状和数量上各有差异。晶体形成的位置通常有两种,游离型和粘联型。多数晶体形成于芽胞外壁以外,芽胞成熟时母细胞会破裂,释放出游离晶体,称为游离型(图4A[21]);少数形成于衣壁空间(interspace),芽胞成熟释放后不与芽胞分离,称为粘联型(图4B[21]),目前已有报道的有粘联型晶体的菌种仅有近10种,如苏云金芽胞杆菌幕虫亚种幕虫亚种B.thuringiensis subsp.finitimus和华中亚种B.thuringiensis subsp.huazhongensis。而通过基因克隆技术,一个细胞内甚至可以同时出现两种晶体,如图 4C[21]所示。
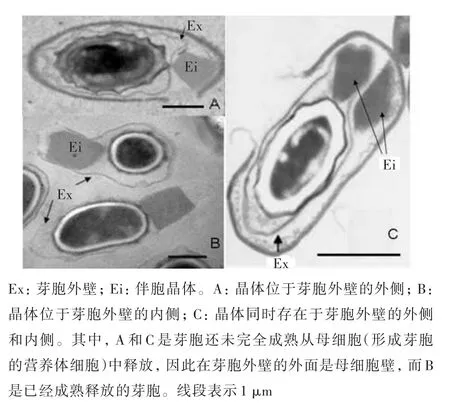
图4 芽胞与伴胞晶体的薄层透射电镜照片
在某些Bt的芽胞外壁表面还出现单根菌毛结构,它由芽胞外壁底部伸出,邻近伴胞晶体,如图5[22]所示,且在芽胞萌发为营养体时也会继续附着在细胞上。
而在不产晶体的Bc的芽胞外壁内侧也可经常看到薄片样的不连续的伴胞包涵体,如图6[2]中箭头所指,其成分和功能尚有待进一步研究。
3 芽胞的动态变化

图5 有菌毛结构的苏云金芽胞杆菌Bt2-56的电子显微镜照片

图6 Bc的完整芽胞的透射电镜照片
芽胞保护性构造的一个最关键的功能就是牢牢锁住DNA,使其保持一种稳定干燥的结晶态,将其与有害分子隔离开。芽胞的这种休眠特性,以及干燥坚硬以保护DNA的特点很容易让人以为它是非常稳固的,没有可运动变化的部分。可是,研究发现Bt芽胞的大小能根据相对湿度的变化发生明显改变,如图7所示,其改变幅度甚至可达到平均30%。而相对湿度是芽胞存在的自然环境如土壤中最易改变的一个参数。前面已提到,芽胞皮层主要是松散交联的肽聚糖,其交联程度是可以发生变化的。这种变化能改变皮层的弹性,同时改变其膨胀或收缩以应对离子浓度变化的能力。而在以前,这种变化被认为是芽胞核脱水所致。Dricks等在用原子力显微镜AFM对芽胞进行观察时,发现芽胞衣呈现出众多的嵴状突起,如图8[23]所示,这正是芽胞衣折叠的表现。这种折叠说明了芽胞衣还有相当大的膨胀扩展空间,以适应于不同的湿度环境和芽胞萌发。在环境湿度和温度恒定的条件下测量芽胞的大小,或观察比较芽胞表面嵴状突起的差异,可以作为区分不同种的参考依据。
4 结语

图7 相对湿度的变化引起芽胞形态变化的结果

图8 对B.subtilis芽胞的AFM分析照片
芽胞是很多细菌在不利环境条件下产生的休眠体,能够抵抗多种极端的环境压力,在保存自身、顽强存活的同时,也给人类的生活和健康带来了不利的影响。芽胞强大的耐受能力显然与其特殊的构造有关。芽胞的结构一般可分为内核、皮层、芽胞衣这3个大的层次,有的在芽胞衣外还有一层芽胞外壁。每一层结构的形成与装配都受到严格的调控。通常认为主要由前3种的特殊组成和性质来提供芽胞的抗逆性。但是对于一些病原菌来说,芽胞外壁是其与宿主直接接触的部分,因此也得到学者们的关注。
对芽胞的研究不仅有助于消除芽胞的抗逆性带来的不利影响,同时芽胞作为一种研究细胞复杂结构的装配与调控的理想模型,也具有重要的理论研究意义。
[1]Higgins D,Dworkin J.Recent progress in Bacillus subti⁃lis sporulation[J].FEMS Microbiol Rev,2012,36(1):131-148.
[2]Gerhardt P,Ribi E.Ultrastructure of the exosporium en⁃veloping spores of Bacillus cereus[J].J Bacteriol,1964,88:1774-1789.
[3]Setlow P.I will survive:DNA protection in bacterial spores[J].Trends Microbiol,2007,15(4):172-180.
[4]Sunde E P,Setlow P,Hederstedt L,et al.The physical state of water in bacterial spores[J].Proc Natl Acad Sci U S A,2009,106(46):19334-19339.
[5]Leggett M J,McDonnell G,Denyer S P,et al.Bacteri⁃al spore structures and their protective role in biocide resistance[J].J Appl Microbiol,2012,113(3):485-498.
[6]McKenney P T,Driks A,Eskandarian H A,et al.A dis⁃tance-weighted interaction map reveals a previously un⁃characterized layer of the Bacillus subtilis spore coat[J].Curr Biol,2010,20(10):934-938.
[7]Hirota R,Hata Y,Ikeda T,et al.The silicon layer sup⁃ports acid resistance of Bacillus cereus spores[J].J Bac⁃teriol,2010,192(1):111-116.
[8]Kodama T,Matsubayashi T,Yanagihara T,et al.A novel small protein of Bacillus subtilis involved in spore germination and spore coat assembly[J].Biosci Biotech⁃nol Biochem,2011,75(6):1119-1128.
[9]Masayama A,Kato S,Terashima T,et al.Bacillus sub⁃tilis spore coat protein LipC is a phospholipase B[J].Biosci Biotechnol Biochem,2010,74(1):24-30.
[10]Kuwana R,Takamatsu H,Watabe K.Expression,lo⁃calization and modification of YxeE spore coat protein in Bacillus subtilis[J].J Biochem,2007,142(6):681-689.
[11]Qiao H,Krajcikova D,Xing C,et al.Study of the inter⁃actions between the key spore coat morphogenetic pro⁃teins CotE and SpoVID[J].J Struct Biol,2013,181(2):128-135.
[12]Henriques A O,Moran C P Jr.Structure,assembly,and function of the spore surface layers[J].Annu Rev Microbiol,2007,61:555-588.
[13]Steichen C T,Kearney J F,Turnbough C L Jr.Charac⁃terization of the exosporium basal layer protein BxpB of Bacillus anthracis[J].J Bacteriol,2005,187(17):5868-5876.
[14]Thompson B M,Hoelscher B C,Driks A,et al.Assem⁃bly of the BclB glycoprotein into the exosporium and evi⁃dence for its role in the formation of the exosporium"cap"structure in Bacillus anthracis[J].Mol Microbi⁃ol,2012,86(5):1073-1084.
[15]Thompson B M,Waller L N,Fox K F,et al.The BclB glycoprotein of Bacillus anthracis is involved in exospo⁃rium integrity[J].J Bacteriol,2007,189(18) :6704-6713.
[16]Swiecki M K,Lisanby M W,Shu F,et al.Monoclonal antibodies for Bacillus anthracis spore detection and functional analyses of spore germination and outgrowth[J].J Immunol,2006,176(10):6076-6084.
[17]Johnson M J,Todd S J,Ball D A,et al.ExsY and CotY are required for the correct assembly of the exospo⁃rium and spore coat of Bacillus cereus[J].J Bacteriol,2006,188(22):7905-7913.
[18]Boydston J A,Yue L,Kearney J F,et al.The ExsY protein is required for complete formation of the exospo⁃rium of Bacillus anthracis[J].J Bacteriol,2006,188(21):7440-7448.
[19]Thompson B M,Hoelscher B C,Driks A,et al.Local⁃ization and assembly of the novel exosporium protein BetA of Bacillus anthracis[J].J Bacteriol,2011,193(19):5098-5104.
[20]喻子牛.苏云金杆菌[M].北京:科学出版社,1990.
[21]Ji F,Zhu Y,Ju S,et al.Promoters of crystal protein genes do not control crystal formation inside exosporium of Bacillus thuringiensis ssp.finitimus strain YBT-020[J].FEMS Microbiol Lett,2009,300(1):11-17.
[22]Rampersad J,Khan A,Ammons D.A Bacillus thuringi⁃ensis isolate possessing a spore-associated filament[J].Curr Microbiol,2003,47(4):355-357.
[23]Chada V G,Sanstad E A,Wang R,et al.Morphogene⁃sis of bacillus spore surfaces[J].J Bacteriol,2003,185(21):6255-6261.

